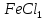контрольная работа по химии 6 вариант. ЛТП(б)з-11 Бабанина Е.А Химия (лабор.). Отчет по лабораторной работе 4 химическая кинетика и равновесие
 Скачать 61.92 Kb. Скачать 61.92 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Тихоокеанский государственный университет» ЛАБОРАТОРНЫЕ РАБОТЫ ПО ХИМИИ РАБОЧИЙ ЖУРНАЛВыполнил: студент группы ЛТБ(б)з-11 Бабанина Е.А № зачетной книжки 210016656 Проверил: Хабаровск 2022 ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ № 4 «ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ» Цель работы: исследование зависимости скорости химической реакции и равновесия в химической системе от концентрации реагирующих веществ и нагревания.  Теоретические основыработы Зависимость скорости гомогенной химической реакции aA + bB = cC + dD от концентрации исходных веществ описывается произведением молярных концентраций реагирующих веществ в степени их стехиометрических коэффициентов от температуры — определяется правилом Вант-Гоффа 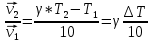 Для гетерогенных процессов скорость возрастает с ростом поверхности конденсированной фазы. Изменение состояния равновесия в системе возможно при изменении температуры и концентрации веществ, а для систем с газовой фазой — давления Опыт 4. Состояние химического равновесия и способы его смещенияИсследуемая реакция: 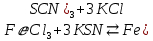 Желтый бесцветный красный бесцветный В равновесном состояний бурый Выражение константы химического равновесия для изучаемой реакции: 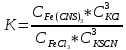 Таблица 4.3 Результаты эксперимента и выводы по смещению равновесия
Реакция протекает с выделением тепла; H_ <0 Вывод: При увеличений концентраций исходных веществ равновесие смещается в сторону образования продуктов реакций в право. При увеличений концентраций продуктов реакций равновесия смещается в сторону образования исходных веществ (в лево)   ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ № 11 «ИССЛЕДОВАНИЕ КОРРОЗИИ МЕТАЛЛОВ»  Цель работы: изучение важнейших процессов, протекающих при коррозии металлов. Цель работы: изучение важнейших процессов, протекающих при коррозии металлов.Теоретические основы работыКоррозией называется самопроизвольное разрушение металла в результате его физико-химического взаимодействия с агрессивной внешней средой  Химическая коррозия металлов протекает в средах не проводящих электрический ток Электрохимическая коррозия протекает в средах электролитов и сопровождается возникновением гальванической гальванический элемет с раствором одного электролита в котором анодом служит более активный металл катодом — пассивный металл гальванической пары На аноде идет процесс окисления на катоде восстанавливаются компоненты среды В кислых растворах — это восстановление Н (процессы с водородной деполяризацией) В нейтральных и щелочных средах на катоде идет процесс Восстановление растворенного в воде О2Деполяризация в этом случае — __ кислородная Опыт 3. Коррозия железа, защищенного металлическим покрытиемОпыт 3.1. Реакция обнаружения ионов железа (II)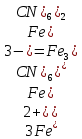 Опыт3.2. Коррозия оцинкованного и луженогожелеза Оцинкованное железо 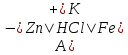 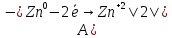 окисление окисление| | 1 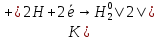 восстановление восстановление Zn0+2HCl=ZnCl2+H2  Луженое железо А (-) Fe 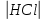 Fe (+) K Fe (+) KA(-) Fe0 - 2  Fe+2 | 2 | окисление Fe+2 | 2 | окисление| | 1 К (+) 2Н + 2 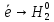 | 2 | восстановление | 2 | восстановлениеFe+2HCl=FeCl2+H2  Синее окрашивание раствора следует ожидать на луженом железе _ Наблюдения: предположение подтвердилось Вывод: Олова в ряду активности металлов стоит после железа, а цинк перед железом, по этому олово будет разрушаться медленнее железа, а цинк быстрее железа. При нарушенном лужением покрытий изделия выидет из строя быстрее чем оцинкованное _ Zn(-0,76) Sn(-0,14) Рис. 11.3. Области расположения в ряду напряжений потенциалов металлов, образующих анодные и катодные покрытия на изделиях из железа. |