Отчет по лабораторной работе №8 «Реакции в растворах электролитов». Отчет по лабораторной работе 8 Реакции в растворах электролитов
 Скачать 104.68 Kb. Скачать 104.68 Kb.
|
|
ИрГТУ КАФЕДРА ХИМИИ И ПИЩЕВОЙ ТЕХНОЛОГИИ Отчет по лабораторной работе №8 «Реакции в растворах электролитов» Выполнил студент группы ММб-19-1 Москвин М.М. Проверил преподаватель Соболева В. Г. Иркутск 2019 Цель работы: изучить понятия «электролиты», «электролитическая диссоциация», рассмотреть кислоты, основания, амфотерные электролиты, соли с точки зрения теории электролитической диссоциации, отличать сильные и слабые электролиты, научиться составлять ионно-молекулярные уравнения. Задание: провести реакции обмена в растворах электролитов, выполнить требования к результатам опытов и оформить отчёт, решить задачу. Теоретическое введение Электролитами называют вещества (кислоты, основания, соли), которые в растворах диссоциируют на ионы и проводят электрический ток. Электрическая диссоциация – распад молекул растворённого вещества на ионы под действием полярных молекул растворителя. Кислоты – электролиты, диссоциирующие в растворах с образованием ионов водорода: 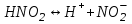 Основания – электролиты, диссоциирующие в растворах с образованием гидроксид-ионов: 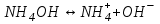 Существуют электролиты, которые могут диссоциировать как кислоты и как основания. Такие электролиты называются амфотерными. К ним относятся Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3? Ga(OH)3, Cr(OH)3. Диссоциацию растворимой части амфотерного электролита можно представить следующей схемой: 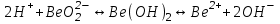 Соли - электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов: 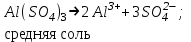 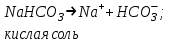  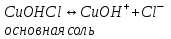 Все электролиты делятся на сильные и слабые. Сильные электролиты – это вещества, которые в водных растворах практически полностью диссоциируют на ионы. Сильными электролитами являются: все хорошо растворимые соли, кислоты (H2SO4, HNO3, HCl, HI, HBr, HClO4), щелочи (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2). Слабые электролиты – это вещества, которые в водных растворах не полностью диссоциируют на ионы. К слабым электролитам относятся: H2O, NH4OH; некоторые соли; кислоты CH3COOH, HF, HNO2, HCN, HClO, H2SO3, H2CO3, H2S, H3PO4; все нерастворимые в воде основания, например Mg(OH)2, Fe(OH)3, Cu(OH)2. Реакции в растворах электролитов протекают между ионами. Обычно такие реакции изображаются при помощи ионно-молекулярных уравнений, порядок составления которых следующий: записывают молекулярное уравнение реакции и в обеих частях уравнения подчёркивают вещества, которые не будут полностью диссоциировать на ионы (нерастворимые вещества, слабые электролиты, газы): 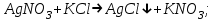 составляют полное ионное уравнение реакции. Осадки, газы и слабые электролиты полностью на ионы не диссоциируют, поэтому в ионных уравнения записываются в молекулярном виде: 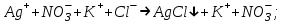 составляют краткое ионное уравнение, сокращая одинаковые ионы с обеих сторон: 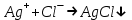 Реакции обмена в растворах сильных электролитов протекают до конца или практически необратимо, когда ионы, соединяясь друг с другом, образуют вещества: нерастворимые( 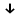 ): ):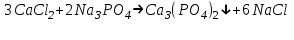 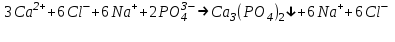 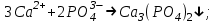 газообразные( 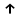 ): ):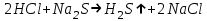 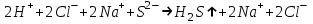 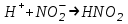 В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, слабого электролита, реакции обмена не протекают. Нередко встречаются процессы, в уравнениях которых с одной стороны равенства имеется малорастворимое соединение, а с другой – слабый электролит. Такие реакции протекают обратимо, причём равновесие смещается в сторону наименее диссоциированных веществ. Так, равновесие в системе 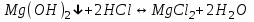 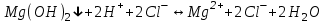 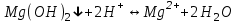 смещено вправо, в сторону малодиссоциированных молекул воды. Выполнение работы Опыт 1. Сравнение химической активности кислот 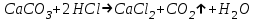 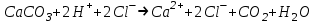 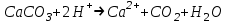 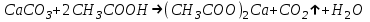  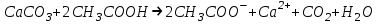 Скорость выделения газа зависит от концентрации ионов Н+. Концентрация таких ионов больше в растворе НСl, наименьшая – в растворе СН3СООН. Хлороводородная кислота относится к сильным кислотам, а уксусная кислота – к слабым. Поэтому намного быстрее мрамор реагирует с хлороводородной кислотой. Опыт 2. Реакции, идущие с образованием осадка 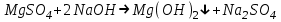  (Mg(OH)2 – студёнистый осадок белого цвета) 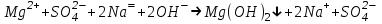  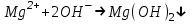 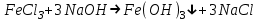 (Fe(OH)3 – осадок красно-коричневого цвета)  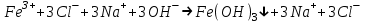 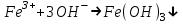 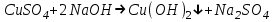 (Cu(OH)2 – осадок тёмно-голубого цвета) 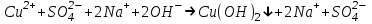 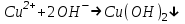 Опыт 3. Реакции, идущие с образованием слабого электролита 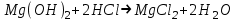 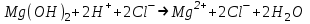 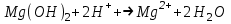 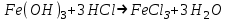 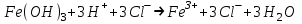 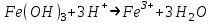 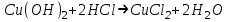 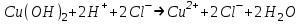 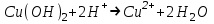 Гидроксид магия II, гидроксид железа III и гидроксид меди II растворяются в соляной кислоте потому, что в результате этой реакции образуются растворимые соли хлорида магния II, хлорида железа III и хлорида меди II. Опыт 4. Реакции, идущие с образованием газа 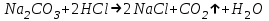 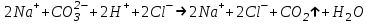 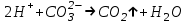 Опыт 5. Амфотерные электролиты 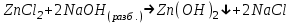 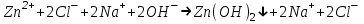 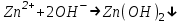 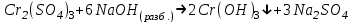 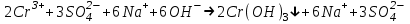 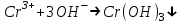 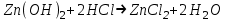 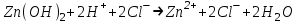  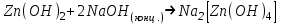 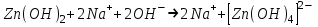 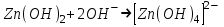 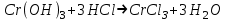 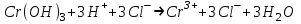 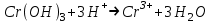 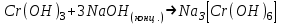 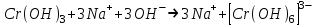 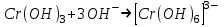 Уравнения диссоциации гидроксидов пот типу: кислоты 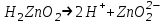 основания 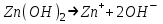 кислоты 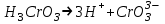 основания 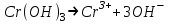 Вывод: изучил понятия «электролиты», «электролитическая диссоциация», рассмотрел кислоты, основания, амфотерные электролиты, соли с точки зрения теории электролитической диссоциации, научился различать сильные и слабые электролиты и составлять ионно-молекулярные уравнения. Задачи и упражнения для самостоятельного решения 8.8 Ba(OH)2+KOH(основания не реагируют друг с другом) Sn(OH)2+KOH(основания не реагируют друг с другом) NiSO4+2KOH=Ni(OH)2+K2SO4 Ni(2+)+SO4(2-)+2K(1+)+2OH(1-)=Ni(2+)+2OH(1-)+2K(1+)+SO4(2-) H3PO4+3KOH=K3PO4+3H2O 3H(1+)+PO4(3-)+3K(1+)+3OH(1-)=3K(1+)+PO4(3-)+6H(1+)+3O(2-) |
