Отчет по лабораторной работе влияние температуры на активность фермента
 Скачать 302.59 Kb. Скачать 302.59 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «Сибирский государственный университет науки и технологий имени академика М.Ф. Решетнева» Институт химических технологий Кафедра химической технологии древесины и биотехнологии ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА АКТИВНОСТЬ ФЕРМЕНТА Преподаватель Е. В. Исаева Обучающийся ББП19-01 192320008 В. Б. Степанова Красноярск 2022 Влияние температуры на активность фермента Цель работы: оценить влияние температуры на активность фермента. Задачи работы: освоить методику влияния температуры на активность фермента фруктофуранозидазы. Обеспечивающие средства: электроплитка; колбы на 100 см3; штатив с пробирками; пипетки на 1, 5 и 10 см3; фарфоровая ступка; фильтровальная бумага и водяная баня, центрифуга. Реактивы: быстродействующие хлебопекарные дрожжи; фосфатный буфер рН 7,0; 1%-й раствор сахарозы; фелинговая жидкость. Сущность метода. Метод основан на расщеплении фруктофуранозидазой сахарозы на глюкозу и фруктозу. Молекулярная формула (1) расщепления сахарозы: С12Н22О11 +Н2О = 2С6Н12О6. (1) Структурная формула расщепления сахарозы представлена на рисунке 1: 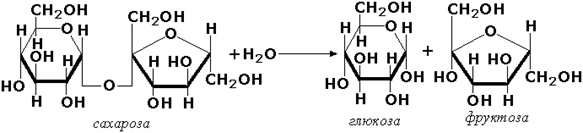 Рисунок 1 – Структурная формула расщепления сахарозы Ход работы. Для получения фермента фруктофуранозидазы 2 г быстродействующих хлебопекарных дрожжей растирают в течение 20 мин с толченым стеклом и 5 см3 фосфатного буфера (рН 7,0). Затем добавляют 20 см3 буфера, нагретого до 60 °С, перемешивают и выдерживают 30 мин. Полученный раствор фильтруют через складчатый бумажный фильтр. Фильтрат должен быть прозрачным. Первые мутные порции фильтрата возвращают на воронку для фильтрования. Для определения активности фермента в четыре предварительно пронумерованные пробирки наливают по 1 см3 вытяжки. Пробирку № 1 устанавливают в сосуд со снегом или толченым льдом; пробирка № 2 остается при комнатной температуре; пробирку № 3 помещают на водяную баню, нагретую до плюс 35 °С; содержимое пробирки № 4 тщательно кипятят. Во все пробирки добавляют по 5 см3 1 %-го раствора сахарозы, содержимое тщательно перемешивают и устанавливают пробирки по местам. По истечении 15 мин во все пробирки приливают по 5 см3 фелинговой жидкости и нагревают на кипящей водяной бане. Выпадает красный осадок Сu2О, по количеству которого судят о влиянии температуры на активность фруктофуранозидазы. Реакция окисления фелинговой жидкостью полученной глюкозы представлена на рисунке 2. 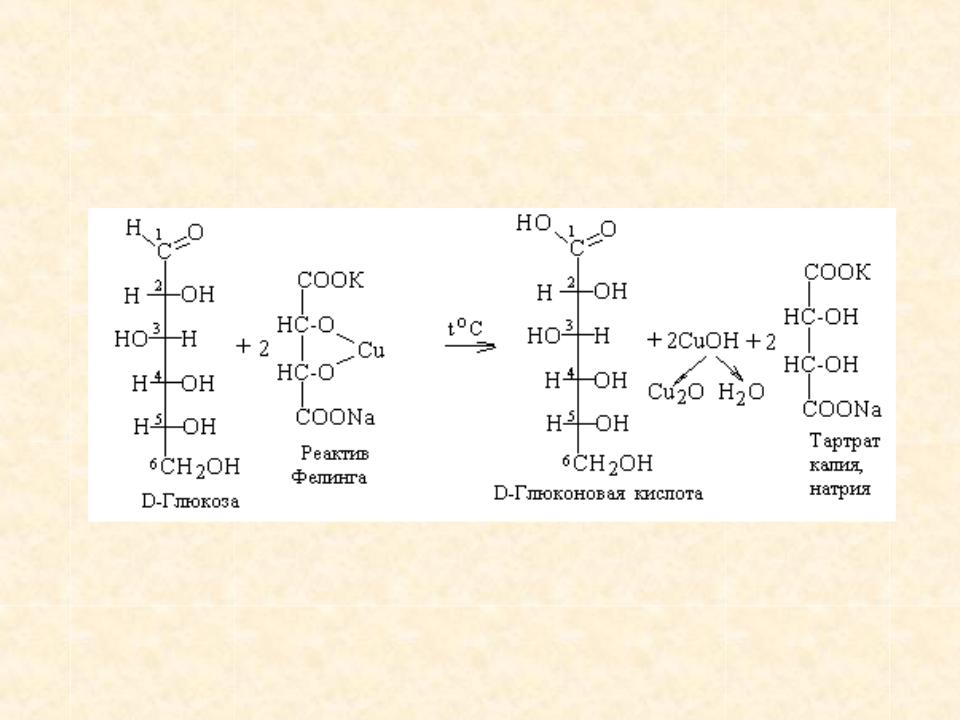 Рисунок 2 – Реакция окисления фелинговой жидкостью полученной глюкозы Полученные данные приведены в таблице 1. Таблица 1 – Экспериментальные данные
Результат реакции окисления глюкозы реактивом Фелинга представлен на рисунке 3.  Рисунок 3 – Результат реакции окисления глюкозы реактивом Фелинга. Фото представлено студентом ББП19-01 Шалиным Владиславом По полученным данным, представленным в таблице, строим график зависимости активности фермента от температуры. График представлен на рисунке 4.  Рисунок 4 – График зависимости активности фермента от температуры Вывод: в ходе работы оценили влияние температуры на активность фермента фруктофуранозидазы. В первой пробирке, помещенной в снег, масса осадка составила 0,113 г; во второй пробирке при комнатной температуре масса осадка равна 0,119 г; в третьей пробирке при температуре 35 °С масса осадка составила 0,127 г; в четвертой пробирке осадок не образовался. В первой пробирке наименьшее количество образовавшегося осадка - низкая температура снижает активность фермента; повышение температуры от минимальной до оптимальной увеличивает активность фермента, что мы и наблюдаем по второй пробирке, которая стояла при комнатной температуре. Температурным оптимумом (значением температуры, при котором регистрируется наибольшая его активность) фруктофуранозидазы оказалось значение 35 °С – в третьей пробирке количество образовавшегося осадка оказалось максимальным. В четвертой пробирке осадка не образовалось, так как высокая температура (обычно выше 60 °С) ингибирует ферменты. Это объясняется тепловой денатурацией белковой молекулы и потерей ее каталитической активности. Библиографический список 1. Исаева, Е. В. Химия биологически активных веществ : лабораторный практикум / Е. В. Исаева, О. Н. Еременко / СибГУ им. М.Ф. Решетнева. – Красноярск, 2019. – 83 c. – Библ.: с. 80-81. – Текст : электронный. |
