УП АНАТОМИЯ ОТЧЁТ ПОПОВА. Отчет по практике учебная общепрофессиональная практика Исполнитель студент гр. 21 Попова Нина Александровна
 Скачать 6.01 Mb. Скачать 6.01 Mb.
|
|
ФГБОУ ВО «Оренбургский государственный аграрный университет» Факультет ветеринарной медицины Кафедра морфологии, физиологии и патологии ОТЧЕТ ПО ПРАКТИКЕ Учебная общепрофессиональная практика Исполнитель: студент гр. 21 Попова Нина Александровна 01.10.2022 г. Курс 2 Специальность 36.05.01 Ветеринария Оренбург 2022 г. ФГБОУ ВО «ОРЕНБУРГСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ» Индивидуальное задание на учебную общепрофессиональную практику (Анатомия животных) На студента 21 группы: Поповой Нины Александровны Факультет ветеринарной медицины Кафедра морфологии, физиологии и патологии Наименование предприятия (организации) ФГБОУ ВО Оренбургский ГАУ кафедра морфологии, физиологии и патологии. Срок прохождения практики с 19.09.2022 по 01.10.2022 г. Содержание задания на практику (перечень подлежащих рассмотрению вопросов): Закрепить методику препарирования тканей и кровеносных сосудов, изучить технику инъекций кровеносных сосудов оплотневающими массами, освоить методику фиксации и изготовления влажных макропрепаратов. Индивидуальное задание: Освоить методику изготовления связочных препаратов. Соединение костей черепа. Тип, строение височно-нижнечелюстного сустава. Изучить технику инъекции кровеносных сосудов. Топография дуги аорты и её ветви у домашних животных. Изучить технику изготовления полостных органов. Изготовление мочевого пузыря крупного рогатого скота. Отличительные особенности строения, топография мочеточника и мочевого пузыря домашних животных, функции. Подпись руководителя практики от кафедры ____________________ Матвеев О.А. (подпись) «___» ____________2022 г. Ознакомлен _________________ (подпись студента) «___» ____________2022 г. Отметка о выполнении индивидуального задания Подпись руководителя практики от предприятия: (подпись) (расшифровка подписи) « » 2022 г. СОДЕРЖАНИЕ Отчет по разделу «Анатомия животных»…………………………………………..….....4 Индивидуальное задание Тема: «Освоить методику изготовления связочных препаратов. Соединение костей черепа. Тип, строение височно-нижнечелюстного сустава. Изучить технику инъекции кровеносных сосудов. Топография дуги аорты и её ветви у домашних животных. Изучить технику изготовления полостных органов. Изготовление мочевого пузыря крупного рогатого скота. Отличительные особенности строения, топография мочеточника и мочевого пузыря домашних животных, функции.»…………….….....…6 Заключение……………………………………………………………………………..…....17 Список используемой литературы………………………………………………….…..….18 Отчет по разделу «Анатомия животных» 19.09.2022 г. Тема: Особенности строения костей грудной клетки домашних животных (лошадь, крупный рогатый скот, овца, свинья, собака). Экскурсия в анатомический музей Оренбургского государственного медицинского университета. Экскурсия в Патологоанатомическое отделение (ПАО) оренбургского областного клинического онкологического диспансера (ООКОД) Ознакомились с правилами работы и техникой безопасности при изготовлении костных, мышечных препаратов, а также с бально-рейтинговой оценкой по практике. Рассмотрели особенности строения костей грудной клетки домашних животных. Зарисовали кости и на рисунках сделали обозначения. Описали отличительные особенности строения костей грудной клетки домашних животных. Освоили методику изготовления скелетов различных видов животных, связочных и мышечных препаратов. В анатомическом музее Оренбургского государственного медицинского университета рассмотрели влажные макропрепараты органов по разделам: «Миология», «Спланхнология», «Ангиология», «Нейрология», а также изучили пластификаты внутренних органов человека и ознакомились с интерактивным столом Пирогова. Музей кафедры нормальной анатомии человека. В музее собрана обширная коллекция препаратов, относящихся ко всем разделам анатомии. Имеются препараты и с аномалиями в развитии органов. Все препараты используются с учебной целью, помогают студентам узнать строение тела человека, его органов и систем. Музей содержит разнообразные препараты, которые помогают понять особенности строения организма человека, его органов, как в норме, так и при патологии. В настоящее время музей насчитывает большое количество экспонатов по всем разделам анатомии человека – остеологии, миологии, артросиндесмологии, спланхнологии и ангиологии и неврологии. Гордостью анатомической коллекции являются препараты человеческого организма в натуральную величину – ангионеврологические и миологические. В числе выставленных образцов довольно представительная коллекция разного рода патологий организма человека, как врожденных, так и обусловленных болезнями. Витрины музея содержат препараты сердца, внутренних органов, центральной нервной системы, органов чувств, лимфатической системы, эндокринных органов, органов 21.09.2022 г. Тема: Синдесмология. Типы соединения костей. Строение сустава. Соединение костей грудной конечности (локтевого и запясного сустава) Рассмотрели и зарисовали типы соединений костей. Разобрали строение сустава. Изучили соединение костей грудной конечности. 22.09.2022г. Тема: Мышцы грудной конечности. Рассмотрели строение и топографию мышц грудной конечности. В тетрадях зарисовали и сделали обозначения. Описали топографию, функции, отличительные особенности у разных видов домашних животных. 23.09.2022 г. Тема: Анатомо-топографические особенности органов кроветворения и иммунной защиты (лимфатические узлы, селезенка) домашних животных (лошадь, крупный рогатый скот, овца, свинья, собака). Зарисовали и на рисунках сделали обозначения. Описали топографию, строение и отличительные особенности органов у домашних животных. 24.09.2022 г. Тема: Артерии тазовой конечности Зарисовали в тетради и на рисунках сделали обозначения артерии тазовой конечности. Описали ход и ветвление артериальных сосудов тазовой конечности, отличительные особенности у домашних животных (лошадь, крупный рогатый скот, овца, свинья, собака). 25.09.2022 г. Тема: Составление и оформление отчета по практике. Отчет по учебной практике выполнен в электронном и распечатанном варианте. В отчет вложены формы индивидуальных заданий по разделам практики. Отчет содержит описание этапов учебной деятельности по каждому дню. Выполнена тема индивидуального задания. Дано заключение и список использованной литературы. Индивидуальное задание по курсу «Анатомия животных»: Освоить методику изготовления связочных препаратов. Соединение костей черепа. Тип, строение височно-нижнечелюстного сустава. Изучить технику инъекции кровеносных сосудов. Топография дуги аорты и её ветви у домашних животных. Изучить технику изготовления полостных органов. Изготовление мочевого пузыря крупного рогатого скота. Отличительные особенности строения, топография мочеточника и мочевого пузыря домашних животных, функции. Освоить методику изготовления связочных препаратов. Примерный перечень препаратов по синдесмологии: 1. Связочный аппарат локтевого сустава. 2. Связочный аппарат запястного сустава. 3. Связочный аппарат тазобедренного сустава. 4. Связочный аппарат коленного сустава. (Например, лошади – рисунок 1) 5. Связочный аппарат заплюсневого сустава. 6. Связочный аппарат позвоночного столба. 7. Связочный аппарат позвоночно-реберного сочленения. 8. Связочный аппарат височно-челюстного сустава 9. Связочный аппарат крестцово-подвздошного сустава. Д 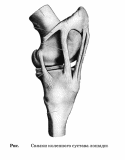 ля изготовления анатомических препаратов по синдесмологии используют свежеотобранный секционный материал. Для этого кости в области сустава скелетируют, ля изготовления анатомических препаратов по синдесмологии используют свежеотобранный секционный материал. Для этого кости в области сустава скелетируют, сохраняя капсулу и связки. Их фиксируют и хранят в 5%-ном растворе формалина. Анатомические препараты по синдесмологии можно готовить в сухом и влажном виде. Сухие препараты связок и суставов, приготовленные методом обычной сушки, быстро изменяют цвет и не позволяют экспериментально производить движения в суставе, а при этом связки теряют контурность. Влажные препараты суставов и связок фиксируют и хранят в 5%-ном растворе формалина в небольших емкостях. Такие суставы также малоподвижны. Целесообразнее готовить эластичные препараты с использованием глицерина . Отпрепарированный препарат помещают вначале в 25%-ный раствор глицерина, затем в 50%-ный и, наконец, в 75%-ный на два-три месяца. На нем хорошо визуализируются связки и капсула, сустав остается подвижным. Нередко препараты суставов, выполненные таким методом, монтируют на подставке или хранят в емкости без строгой герметичности. Кроме того, они удобны в эксплуатации и долговечны. Соединение костей черепа. Кости скелета головы между собой соединяются преимущественно непрерывно посредством синдесмоза, швов и синхондроза. Исключение составляют соединения нижней челюсти с височной костью. У новорожденных синдесмоз представлен межкостными перепонками, особенно в области свода черепа, а синхондроз – в области основания черепа. У молодых животных на границе соединяющихся костей хорошо выражены швы, которые именуются по названиям костей, например, sutura occipitosquamosa, sutura sphenofrontalia, sutura vomeropalatina и т.д. Л 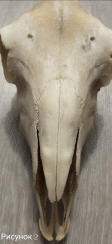 ишь отдельные швы имеют специальные названия. Сагиттальный шов (sutura sagittalia), проходящий между теменными костями. Краниально он продолжается в межлобный (sutura interfrontalia), а последний – в межносовой шов (sutura internasalia). (Рисунок 2) ишь отдельные швы имеют специальные названия. Сагиттальный шов (sutura sagittalia), проходящий между теменными костями. Краниально он продолжается в межлобный (sutura interfrontalia), а последний – в межносовой шов (sutura internasalia). (Рисунок 2)Ламбдовидный шов (sutura lambdoidea ) проходит между теменной костью и чешуей затылочной кости. Венечный шов (sutura coronalis) проходит между лобной и теменной костями. У старых животных границы между отдельными костями скелета головы в силу замещения фиброзной и хрящевой тканей костной становятся малозаметными или полностью исчезают. Подвижными в течение всей жизни остаются подъязычная кости и нижнечелюстная. В подъязычной кости суставными капсулами соединены ее членики. С шиловидным (подъязычным) отростком височной кости проксимальный членик подъязычной кости образуют височно-подъязычный сустав. Соединения члеников подъязычной кости между собой, с ее телом и черепом у домашних животных характеризуются большими отличиями. У лошади эпигиоид со стилогиоидом и тирогиоид с базигиоидом имеют костные соединения, тогда как все другие элементы подъязычной кости между собой соединены суставами. У жвачных эпигиоид с кератогиоидом и кератогиоид с базигиоидом соединяются суставами, в то время как стилогиоид с эпигиоидом и тирогиоид с базигиоидом имеют костные соединения. У свиньи между члениками подъязычной кости суставных соединений нет; эпигиоид представлен связкой (lig. epihyoideum), а тирогиоид с базигиоидом соединен синхондрозом. У хищных все костные элементы подъязычной кости соединены суставами. С гортанью подъязычная кость у лошади, жвачных и хищных соединена щитовидноподъязычным суставом (art. thyrohyoideum), который образуется между тирогиоидом и ростральным рогом щитовидного хряща. У свиньи в силу отсутствия ростральных рогов тирогиоид с щитовидным хрящом соединен посредством синдесмоза. Височно-подъязычное соединение (art. temporhyoidea) – у различных видов домашних животных имеет свои характерные отличия. У лошади и жвачных подъязычная кость своим тимпаногиоидом соединена с шиловидным отростком височной кости синхондрозом. У свиньи тимпаногиоид соединен с затылочным отростком чешуи височной кости син-десмозом. У хищных тимпаногиоид соединен с сосцевидным отростком височной кости, так же, как и у свиньи, через посредство соединительной ткани. соединения нижней челюсти между собой и с височной костью. Межнижнечелюстное соединение (art. intermandibularis) образуется между резцовыми частями тел нижнечелюстных костей, где у лошади, жвачных и свиньи имеется хрящевое соединение (synchondrosis intermandibularis), которое у лошади и свиньи очень рано переходит в синостоз. У хищных на этом месте выражено шовное соединение (sutura intermandibularis). Типы соединений костей черепа: З 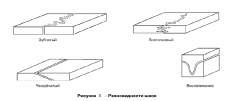 убчатый шов (sutura serrata) – зубчатые края соединяющихся костей плотно входят друг в друга (соединение носовых костей с лобными или лобных костей с теменными). (Рисунок 2,3) убчатый шов (sutura serrata) – зубчатые края соединяющихся костей плотно входят друг в друга (соединение носовых костей с лобными или лобных костей с теменными). (Рисунок 2,3)Листочковый шов (sutura foliata) – по форме имеет сходство с зубчатым, но у него отдельные зубцы в виде древесного листа глубоко внедряются в край соседней кости (соединение крыльев клиновидной кости с лобной и теменной костями). Такое соединение отличается большой прочностью. (Рисунок 3) Чешуйчатый шов (sutura squamosa) – когда края костей налегают друг на друга, как чешуя у рыбы (соединение теменной кости с чешуей височной кости). (Рисунок 3) Плоский шов (sutura plana) - когда края соединяющихся костей имеют ровные поверхности. Такое соединение характеризуется непрочностью и поэтому при вываривании или мацерации кости легко отделяются от скелета (соединение носовых костей между собой, особенно у жвачных). Клиновидное, или расщепленное, соединение (schindylesis) – когда острый край одной кости вклинивается в расщепленный край другой кости (соединение носовых отростков резцовой кости с верхнечелюстной костью). Синхондроз (synchondrosis) - это соединение, при котором хрящевая прослойка между соединяющимися костями или их частями представлена гиалиновым хрящем (соединение тел клиновидной и затылочной костей). С возрастом гиалиновый хрящ замещается костной тканью с образованием костного соединения, или синостоза. Тип, строение височно-нижнечелюстного сустава. Височно-нижнечелюстной сустав (art. temporomandibularis) образован суставным бугорком чешуи височной кости и мыщелковым отростком нижнечелюстной кости. (Рисунок 4) Его основной функцией является опускание и поднимание нижней челюсти, её смещение вперед и назад, вправо и влево. У хищных животных боковые движения сильно ограничены. Височно-нижнечелюстной сустав сложный, инконгруэнтный, двухосный, комбинированный (т.к. правый и левый суставы взаимосвязаны) . Между суставными поверхностями головки нижней челюсти и нижнечелюстной ямки чешуи височной кости имеется суставной диск (discus articulare), выравнивающий инконгруэнтные поверхности сочленяющихся костей. Суставная капсула охватывает сочленяющиеся поверхности и, дополнительно закрепляясь по краям суставного диска, образует верхнюю и нижнюю камеры суставной полости. Также в сустав составляют латеральная и каудальная (у свиньи и хищных эта связка отсутствует) связки. Латеральная связка (lig. laterale) представляет собой утолщение латеральной поверхности сустава. Каудальная связка (lig. caudale) построена из эластических волокон, которые берут начало от засуставного отростка височной кости и заканчиваются на каудальной поверхности мыщелкового отростка нижней челюсти. У свиньи и хищных эта связка отсутствует. Изучить технику инъекции кровеносных сосудов. Инъекции имеют большое значение при лечении животных, так как лекарственное вещество попадает напрямую в кровь, минуя пищеварительный тракт и не подвергаясь действию пищеварительных ферментов, и с ее помощью быстро действует на организм. На что стоит обратить внимание перед проведением инъекции: Асептика: шприцы, иглы, место инъекции, руки должны быть стерильными; Вводить лекарственные растворы необходимо спокойно и медленно; Необходимо следить за тем, чтобы в вводимом лекарственном растворе не было пузырьков воздуха. Внутривенные инъекции. Могут проводиться как шприцем с иглой, так и посредством предварительной установкивнутривенного катетера. При выборе места катетеризации необходимо учитывать простоту доступа к месту пункции и пригодностьсосуда для катетеризации. Осложнений практически не бывает, если соблюдены основные правила. За катетером должен быть обеспечен безупречный уход. У крупного рогатого скота и других крупных животных внутривенные инъекции делают преимущественно в яремную вену в верхней трети шеи, где отсутствуют в сосуде клапаны, а вена лежит более поверхностно. Вену прижимают пальцем, чтобы она хорошо контурировала под кожей. У крупных быков и лошадей шею перетягивают жгутом или сжимают вену специальными щипцами. Иглу вкалывают по направлению к голове. После появления крови из иглы ее вводят в вену на 1/3 длины и присоединяют шланг от инфузионного аппарата, который держат ниже уровня укола иглы. Как только в аппарате покажутся первые порции крови,его поднимают, отпускают вену и приступают к вливанию. По окончании вливания аппарат опускают, вену снова прижимают, промывая током крови иглу, а затем ее вынимают, предварительно прекратив прижатие вены. Этим предупреждается попадание в околососудистую ткань части раствора и исключается раздражающее его действие при введении таких небезразличных для тканей веществ, как хлоралгидрат, хлорид кальция и др., способных вызвать пери- и тромбофлебит. Е 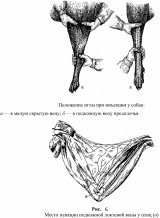 сли для вливания пользуются аппаратом Боброва, то после пункции вены к игле присоединяют шланг и раствор нагнетают посредством резинового баллона. Кроме яремной вены, у лошадей инъекция возможна в наружную грудн сли для вливания пользуются аппаратом Боброва, то после пункции вены к игле присоединяют шланг и раствор нагнетают посредством резинового баллона. Кроме яремной вены, у лошадей инъекция возможна в наружную грудн ую вену, а коровам — в подкожную вену живота (рис. 5.) и даже в ушную вену. У свиней инъецируют жидкость в большую ушную вену на наружной поверхности ушной раковины, предварительно перетянув ее у основания резиновым жгутом или пережав пальцем. После укола иглы (направление основания уха) жгут снимают и приступают к инъекции. У небольших свиней венопункцию и внутривенную инъекцию легко сделать в одну из парных подкожных вен живота. ую вену, а коровам — в подкожную вену живота (рис. 5.) и даже в ушную вену. У свиней инъецируют жидкость в большую ушную вену на наружной поверхности ушной раковины, предварительно перетянув ее у основания резиновым жгутом или пережав пальцем. После укола иглы (направление основания уха) жгут снимают и приступают к инъекции. У небольших свиней венопункцию и внутривенную инъекцию легко сделать в одну из парных подкожных вен живота. У собак, а также у мелкого рогатого скота чаще всего раствор инъецируют в малую скрытую вену, хорошо контурируемую над заплюсневым суставом при сдавливании конечности выше колена (рис. 6). На грудной конечности для прокола и инъекции доступна подкожная вена предплечья, идущая на его дорсальной поверхности (рис. 6). Вену прижимают выше места инъекции. После ее прокола прекращают прижимание и начинают инъекцию. При известном опыте иглу вкалывают, не отделяя шприца. Как только в нем покажется кровь, начинают инъекцию. У птицы обычно пунктируют подкожную локтевую вену, которая идет под кожей в области плеча, локтя и предплечья. Место пункции - участок вены вблизи локтевого сустава. На этом месте выщипывают перья и, нажав пальцем выше локтя, находят вздувшуюся вену (рис. 6). Повторная пункция в одном и том же месте противопоказана. Она может привести к развитию тромбофлебита, образованию гематомы в околососудистой клетчатке. При слабой струе крови или ее отсутствии недопустимо прочищать иглу мандреном, так как кусочек ткани из иглы может попасть в просвет сосуда. Для внутривенных инъекций можно использовать предварительно установленные катетеры. При выборе места установки катетера необходимо учитывать простоту доступа к месту пункции и пригодность сосуда для катетеризации. Осложнений практически не бывает, если соблюдены основные правила и за катетером обеспечен безупречный уход. Внутриаортальные и интраартериальные инъекции. Их применяют для введения антибиотиков и других лекарственных веществ при лечении острых гнойно-некротических процессов в дистальном отделе конечностей. У крупных животных относительно легко сделать инъекцию в срединную артерию.Раствор вводят иглой Боброва на 2–3 см ниже локтевого сустава, позади заднего края лучевой кости, слегка вытянув конечность животного вперед. В намеченном участке ощущают пульсацию артерии. Пальцем левой руки прижимают сосуд ниже места пункции, а правой вкалывают иглу сверху вниз под углом 40–60°, прокалывая кожу, поверхностную и глубокую фасции предплечья. Появление из иглы пульсирующей струи свидетельствует о правильном положении иглы. Чтобы избежатьвыскальзывания иглы из сосуда, ее присоединяют к шприцу резиновым шлангом. В настоящее время практикуют инъекции в брюшную аорту (перитонит, эндометрит, мастит и др.) и другие артерии. Топография дуги аорты и её ветви у домашних животных. Дуга аорты (arcus aortae) располагается справа от легочной артерии и поднимается дорсально к пятому (шестому) грудному позвонку, переходя здесь в грудную аорту. Помимо венечных артерий от дуги аорты краниально отходит крупный сосуд — плечеголовной ствол. По строению своей стенки дуга аорты относится к сосудам эластического типа. В области створок полулунного клапана от луковицы аорты отходят правая и левая венечные артерии (aa. coronariae dextra et sinistra), ветвящиеся в стенке сердца. П 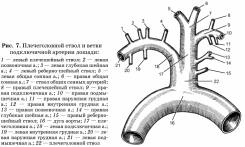 о выходе из перикардиальной полости от нее отходят правая (плечеголовной ствол) и левая подключичная артерия. (Рисунок 7) После их отхождения дуга аорты направляется к позвоночному столбу и, направляясь каудально, получает название нисходящей аорты (aorta descendens). До диафрагмы нисходящую аорту называют грудинной (aorta thoracica), а от диафрагмы до отхождения подвздошных артерий – брюшной (aorta abdominalis). После отхождения подвздошных артерий она продолжается как срединная крестцовая (a. sacralis mediana), а на хвосте – срединная хвостовая (a. caudalis mediana). Последние две артерии у разных видов животных развиты неодинаково. о выходе из перикардиальной полости от нее отходят правая (плечеголовной ствол) и левая подключичная артерия. (Рисунок 7) После их отхождения дуга аорты направляется к позвоночному столбу и, направляясь каудально, получает название нисходящей аорты (aorta descendens). До диафрагмы нисходящую аорту называют грудинной (aorta thoracica), а от диафрагмы до отхождения подвздошных артерий – брюшной (aorta abdominalis). После отхождения подвздошных артерий она продолжается как срединная крестцовая (a. sacralis mediana), а на хвосте – срединная хвостовая (a. caudalis mediana). Последние две артерии у разных видов животных развиты неодинаково.Плечеголовной ствол (truncus brachiocephalicus) из всех домашних животных наибольшую длину имеет у хищных; у жвачных и лошади он отходит вместе с левой подключичной артерией одним общим стволом. У собаки от него отходит правая и левая общие сонные артерии (aa. carotis communis dextra el sinistra). У других видов животных обе общие сонные артерии объединяются в единый ствол (truncus bicaroticus). После отхождения общих сонных артерий плечеголовной ствол продолжается как правая подключичная артерия (a. subclavia dextra). Исключение составляет лошадь, у которой плечеголовной ствол до отхождения общей сонной артерии первоначально отдает реберно-шейный ствол, глубокую шейную и позвоночную артерии. Особенности отхождения плечеголовного ствола от дуги аорты и последующие его разветвления находятся в прямой зависимости от степени подвижности шейно-грудного отдела позвоночного столба, формы и длины грудной клетки, степени смещения сердца от входа в грудную полость в каудальном направлении. Изучить технику изготовления полостных органов. Чаще всего полостные органы делают в виде влажных препаратов. Приготовление влажных препаратов состоит из трех последовательных этапов: Фиксация в формалино-солевом растворе (первая жидкость), в котором гемоглобин крови переходит в метгемоглобин. Орган при этом принимает серо-бурую окраску. Для достижения хороших результатов фиксации необходимо соблюдать следующие условия: - объем фиксирующей жидкости должен в 5-10 раз превышать объем препарата; - нельзя допускать контакта фиксируемых препаратов со стенками посуды, а потому их обязательно кладут на вату, изолируя при этом и от боковых стенок; - препарат должен лежать в жидкости совершенно свободно. Если в одну и ту же посуду приходится помещать сразу несколько объектов, их обязательно перекладывают ватой и располагают таким образом, чтобы они не оказывали друг на друга значительного давления; - препараты, всплывающие на поверхность жидкости, покрывают ватой или положенной в несколько слоев марлей, которые предварительно смачивают фиксирующей жидкостью; - фиксирующая жидкость должна быть совершенно прозрачной; - при окрашивании кровью, помутнении и загрязнении ее заменяют свежей. Через 1-2 дня после пребывания препарата в фиксаторе можно извлекать все посторонние предметы, введенные в полости, каналы и трубчатые образования. Время пребывания препаратов в формалино-солевом растворе весьма различно и зависит от многих условий: величины и плотности объекта, количества и глубины сделанных разрезов и надрезов, свежести и крепости фиксатора, температуры. Восстановление естественной окраски препарата в спирте (вторая жидкость). После фиксации в первой жидкости препарат промывают в водопроводной проточной воде (от 10 мин до 12 ч, смотря по величине органа) и переносят во вторую жидкость (96% этиловый спирт) для восстановления цвета. Восстановление цвета наступает быстро (1-2 ч, а для крупных объектов – 3-6 ч). Как только орган принял свою естественную окраску, обработку спиртом прекращают. Не следует задерживать препарат в спирте более 12-18 ч. При длительном нахождении в спирте препарат постепенно обесцвечивается, вследствие извлечения из тканей нейтрального гематина. Использование более слабых по концентрации спиртов и денатуратов, особенно окрашенных, дает неудовлетворительные результаты. При недостатке спирта восстановление можно вести в обильно смоченной в спирте вате, в которую заворачивают препарат. При этом время восстановления окраски увеличивается. Окончательное хранение. Для окончательного хранения препаратов используют смеси содержащие глицерин (третья жидкость). В ветеринарной и медицинской практике применяют следующие смеси. Мельникова-Разведенкова: глицерин 600 мл; ацетат калия или натрия 400 г; вода водопроводная 1000 мл. Кайзерлинга: глицерин 200-350 мл; ацетат калия или натрия 200-800 г; вода водопроводная 1000 мл. Иореса: глицерин 500 мл; вода 500 мл. Приведенные глицериновые смеси готовят на горячей (кипяченной) водопроводной воде. Для предотвращения образования плесени и помутнения в эти смеси добавляют немного (на кончике скальпеля) камфоры или тимола. При перенесении препарата из спирта в третью жидкость она иногда несколько мутнеет, а поэтому рекомендуется первоначально препарат переносить в старую, бывшую в употреблении третью жидкость на несколько дней (10-14). По истечении этого срока препарат переносят в свежеприготовленную третью жидкость. Если третья жидкость даже при повторной ее смене краснеет, значит фиксация препарата была недостаточной, в этом случае следует препарат снова поместить в спирт, а затем в первую жидкость и повторить весь цикл консервирования. Пропитывание в третьей жидкости проводят в темноте, для чего посуду покрывают темной тканью или клеенкой. Пропитывание продолжается довольно долго. Тонкостенные органы пропитывают 1-2 недели, остальные органы не менее 3-5 недель. После этого препарат подлежит окончательной заделке. Монтаж и хранение влажных препаратов. Для хранения влажных патологоанатомических препаратов используют различной формы музейные банки. Они должны быть прозрачными, не искажать цвет и форму органа, без возможных пузырей и закрываться специально вырезанными стеклами. Помещаемый в банку препарат, прикрепляют нитками к специально вырезанной стеклянной пластинке. Последняя должна быть такой же ширины, как банка, намеченная для данного препарата, а по высоте несколько ниже. Банку заполняют свежеприготовленной третьей жидкостью, добавляют немного тимола или камфоры, или сверху наслаивают на жидкость тонкий слой вазелинового масла. Затем банку закрывают стеклянной крышкой, которую приклеивают эпоксидной смолой, клеем «Момент», силиконовой замазкой или другими современными клеями. На приготовленный препарат наклеивают табличку с названием препарата. Препараты полостных органов также готовят методом высушивания, предварительно надувая их; фиксированные препараты также набивают опилками, стружками или ватой и затем высушивают. Сосуды, бронхиальное дерево наливают специальными массами, затем органическую составляющую удаляют в растворе кислоты. Изготовление мочевого пузыря крупного рогатого скота. Извлекаем мочевой пузырь из тела животного. Препарируем его, отсекая жировые ткани и оболочки. Промываем мочевой пузырь под проточной водой, предварительно сделав надрез. Воду выливаем через надрез или через уретру. Зашиваем или затягиваем мочеточники, уретру, надрезы, если последние есть. Фиксируем препарат в формалино-солевом растворе. Чтобы пузырь не слипся, можно заполнить его ватой, смоченной формальном. Также можно набрать в мочевой пузырь формалин, но так, чтобы он не лопнул. О  ставляем препарат в растворе на длительное время (время зависит от размеров препарата). ставляем препарат в растворе на длительное время (время зависит от размеров препарата).Орган, принявший нужную форму, оставляем в сухом помещении или выносим на улицу. Первое время препарат необходимо протирать скипидаром, для предотвращения появления плесени. Высушенный препарат по надобности покрываем краской, например, чтобы показать какие-либо части мочевого пузыря. Покрываем мочевой пузырь бесцветным лаком в несколько слоев. Фиксируем препарат на стойке. Отличительные особенности строения, топография мочеточника и мочевого пузыря домашних животных, функции. Мочеточник ( ureter ) - типичный трубчатый орган, соединяющий почечную лоханку с полостью мочевого пузыря (Рисунок 8). По топографическому признаку мочеточник подразделяется на брюшную (pars abdominalis) и тазовую (pars pelvina) части. Отойдя от почки, левый мочеточник располагается над брюшиной вблизи аорты, а правый рядом с каудальной полой веной. Оба мочеточника затем проходят вентрально от наружной и внутренней подвздошных артерий и, пересекая их, вступают в тазовую полость. Тазовая часть мочеточника у самцов проходит в мочеполовой складке брюшины, а у самок – в широкой маточной связке. Достигнув дорсальной поверхности мочевого пузыря, мочеточники сближаются и вблизи шейки пузыря проходят некоторое расстояние между его мышечной оболочкой и основой подслизистой оболочки, заканчиваясь мочеточниковым отверстием (ostium ureteris) на поверхности слизистой оболочки. Z-образный изгиб, образуемый мочеточником при прохождении в стенке мочевого пузыря, служит своеобразной гидравлической заслонкой, препятствующей обратному току мочи из мочевого пузыря в мочеточники, однако не затрудняя ее новых поступлений, так как почки функционируют постоянно. Слизистая оболочка мочеточника выстлана переходным эпителием и лишь у лошади содержит в начальном участке слизистые мочеточниковые железы (gll. uretericae). Мышечная оболочка имеет три слоя пучков гладких мышечных волокон, из которых наружный и внутренний являются продольными, а средний – циркулярным. Последний имеет наибольшее развитие. Он исчезает лишь в области впадения мочеточника в мочевой пузырь. У лошади, крупных жвачных и свиньи наружный мышечный слой представлен отдельными изолированными мышечными пучками. Внутренний мышечный слой наиболее дифференцирован у крупных жвачных, у лошади он имеется в брюшном отделе, у овцы, свиньи и собаки выражен слабо, а у кошки отсутствует. Снаружи мочеточник имеет адвентициальную оболочку. О 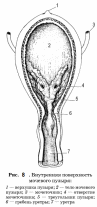 собенности наиболее выражены лишь у крупных жвачных. У них мочеточник образуется после слияния стебельков, отходящих от почечных чашечек. Вначале оба мочеточника располагаются рядом справа от каудальной полой вены. Затем левый мочеточник постепенно смещается на левую сторону. На дорсальной стенке мочевого пузыря мочеточник своими каудальными участками сильно сближается и поэтому их отверстия на слизистой оболочке располагаются рядом, в силу чего треугольник пузыря небольшой и узкий. собенности наиболее выражены лишь у крупных жвачных. У них мочеточник образуется после слияния стебельков, отходящих от почечных чашечек. Вначале оба мочеточника располагаются рядом справа от каудальной полой вены. Затем левый мочеточник постепенно смещается на левую сторону. На дорсальной стенке мочевого пузыря мочеточник своими каудальными участками сильно сближается и поэтому их отверстия на слизистой оболочке располагаются рядом, в силу чего треугольник пузыря небольшой и узкий.Мочевой пузырь (vesica urinaria) - служит временным резервуаром, в котором задерживается образовавшаяся моча (Рисунок 8). Он представляет собой грушевидной формы перепончатомышечную емкость, на которой различают тело (corpus vesicae), вершину (apex, s. vertex vesicae), обращенную в брюшную полость, шейку (cervix vesicae), направленную в тазовую полость, и две поверхности – дорсальную и вентральную (facies dorsalis et ventralis). Шейка мочевого пузыря переходит в мочеиспускательный канал. Для стенки мочевого пузыря характерно трехслойное строение. Слизистая оболочка мочевого пузыря толстая, мягкая, без желез, выстлана переходным эпителием. При опорожненном пузыре она собрана в многочисленные складки. На дорсальной стенке мочевого пузыря в местах прохождения каудальных концов мочеточника видны два валиковидных возвышения – столбы мочеточника (columnae uretericae). На уровне каудального конца столба находится отверстие мочеточника (ostium ureteris). От каждого отверстия к шейке пузыря проходит мочеточниковая складка (plica ureterica), ограничивающая с боков пузырный треугольник (trigonum vesicae). Мочеточниковые складки, сливаясь, формируют на стенке мочеиспускательного канала мочеиспускательный гребень (crista urethralis). Мышечная оболочка мочевого пузыря состоит из двух продольных (наружного и внутреннего) и циркулярного, расположенного между ними, слоев. Наружный мышечный слой на дорсальной поверхности пузыря простирается от мочеиспускательного канала до срединной пузырной связки. От этого слоя часть пучков продолжается в каудальном направлении до боковых стенок прямой кишки (m.rectourethralis), а в краниальном направлении до лонных костей (m. pubovesicalis). На боковых поверхностях верхушки пузыря мышечные пучки образуют петли и продолжаются на вентральную поверхность. В области дна тела пузыря мышечные пучки расходятся на его боковые стороны и сливаются с пучками среднего мышечного слоя. В среднем слое мышечные пучки проходят циркулярно и равномерно по всей поверхности мочевого пузыря. Внутренний слой своими продольными мышечными пучками простирается от срединной пузырной связки до шейки мочевого пузыря. По своему ходу мышечные пучки образуют характерное сплетение в виде петель различной длины и разнообразной формы. Вокруг верхушки мочевого пузыря внутренний мышечный слой отсутствует. Серозная оболочка покрывает вершину и тело мочевого пузыря. С вентральной поверхности верхушка мочевого пузыря переходит на вентральную стенку брюшной полости с образованием срединной пузырной связки (lig. vesicae medianum), в которой заключены соединительнотканные тяжи от бывших здесь у плодов мочевого протока (urachus) и концевых отделов пупочных артерий. Кроме того, здесь же проходит значительное количество эластических волокон и мышечных пучков, составляющих основу лоннопузырной мышцы (m. vesicalis). С боковых стенок мочевого пузыря серозная оболочка переходит на боковые стенки тазовой полости, образуя парную латеральную связку пузыря (lig. vesicae laterale). В ее основе проходит круглая пузырная связка (lig. teres vesicae), представляющая собой облитерированный участок пупочной артерии, который у плодов продолжается до плаценты. Кровоснабжение мочевого пузыря осуществляется сосудами, отходящими от ветвей внутренней подвздошной артерии (a. iliaca interna): a. vesicalis cranialis от a. umbilicalis и aa. vesicalescaudales от a. vaginalis (у самок) или a. prostatica (у самцов), а также от ветвей наружной подвздошной артерии (a. iliaca externa): a. vesicalis media от a. epigastrica caudalis. Иннервацию мочевой пузырь получает от pl. vesicalis, в образовании которого участвуют симпатические, проходящие в составе ветвей от n. hypogastricus, и парасимпатические нервные волокна, проходящие в составе ветвей от тазового сплетения (pl. pelvinus). Особенности: У собаки мочевой пузырь почти полностью находится в брюшной полости и очень вместителен (при наполненном состоянии может достигать диафрагмы). Пузырный треугольник хорошо выражен. У свиньи мочевой пузырь на 2/3 выступает в брюшную полость. Мочеточниковые складки двойные. У хряков они с латеральной стороны доходят до семенного холмика, а медиальные сливаются между собой. В области прохождения мочеточников слизистая оболочка очень тонкая. Пузырный треугольник четко выражен. У крупных жвачных мочевой пузырь объемистый и на 1/3 вдается в брюшную полость. В силу близкого расположения отверстий мочеточников пузырный треугольник не выражен. У самцов мочевой гребень достигает семенного холмика. У лошади мочевой пузырь почти полностью находится в тазовой полости, в результате чего вентральная часть тела и шейка пузыря серозной оболочкой не покрыта. Пузырный треугольник выражен слабо. Заключение В ходе прохождения учебной общепрофессиональной практики закреплены знания по: анатомии животных с учетом видовых особенностей животных, топографии органов и их систем, методики изготовления макропрепаратов, сущности биологических процессов, За период практики освоены методики изготовления костных препаратов, препарирования скелетных мышц, наливки кровеносных сосудов оплотневающими массами. По разделу биология с основами экологии освоены схемы жизненных циклов протозойных и паразитарных возбудителей заболеваний человека и животных. Закрепили знания: о представителях местной фауны Оренбуржья – пресмыкающиеся, земноводные, птицы, млекопитающие, методах сбора беспозвоночных и позвоночных животных, способах работы с зоологическим оборудованием, методе «кошения», о паразитах животных и человека их морфологических признаках. В течение прохождения практики приобретен практический опыт, который в дальнейшем будет использован в профессиональной деятельности. Список использованной литературы Пехов А.П. Биология с основами экологии /А.П. Пехов. - Спб.: Издательство «Лань», 2007. – 688 с. Юдичев, Ю.Ф. Анатомия животных / Ю.Ф. Юдичев, В.В. Дегтярев, Г.А. Хонин// – Оренбург. Изд. Центр ОГАУ. – 2013. Т. . – 298 с. Юдичев, Ю.Ф. Анатомия животных / Ю.Ф. Юдичев, В.В. Дегтярев, А.Г. Гончаров. – Оренбург. Изд. Центр ОГАУ – 2013. Т. . – 406 с. Методология научных исследований в ветеринарии и зоотехнии / Н. А. Слесаренко, И. С. Ларионова, Е. Н. Борхунова; Под ред.: Слесаренко Н. А.. — 2-е изд., стер. — Санкт-Петербург : Лань, 2022. — 296 с. Руководство учебной практикой по анатомии домашних животных : учебное пособие / Р. И. Ситдиков, И. Ю. Тяглова, О. Т. Муллакаев, Е. Г. Кирллов. – изд. – Казань, КГАВМ им. Баумана: Лань, 2021. — 95 с. Оперативная хирургия у животных : учебник для вузов / Б. С. Семенов, В. Н. Виденин, А. Ю. Нечаев. — 2-е изд., стер. — Санкт-Петербург : Лань, 2021. — 704 с. Баймишев, Р. Х. Практика по получению первичных профессиональных умений и навыков, в том числе первичных умений и навыков научно-исследовательской деятельности : методические указания / Р. Х. Баймишев, Д. Ш. Кашина. — Самара, СамГАУ: Лань, 2018. — 99 с. Дауда, Т. А. Зоология беспозвоночных : учебное пособие / Т. А. Дауда, А. Г. Кощаев. – СПб. : Лань, 2014. – 207 с. Кахикало, В. Г. Разведение животных : учебник / В. Г. Кахикало, В. Н. Лазаренко, Н. Г. Фенченко, О. В. Назарченко. – СПб :Лань, 2014. – 448 с. Кахикало, В. Г. Практикум по разведению животных : учебное пособие / В.Г.Кахикало, Н. Г.Предеина О. В.Назарченко. – СПб. : Лань, 2013. – 320 с. Кузнецов, А. Ф. Гигиена содержания животных : учебное пособие / А. Ф. Кузнецов, В. Г. Тюрин, В. Г. Семенов, В. Г. Софронов. – СПб : Лань, 2017. – 380 с. Найденский, М. С. Зоогигиена с основами проектирования животноводческих объектов / М. С. Найденский, А. Ф. Кузнецов. – М. : Колос, 2007. – 512 с. Нефедова, С. А. Биология с основами экологии : учебное пособие / С. А. Нефедова, А. А. Коровушкин, А. Н. Бачурин [и др.]. – СПб. : Лань, 2015. – 368 с. |
