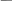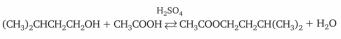Государственное бюджетное профессиональное образовательное учреждение
Новосибирской области
«Новосибирский химико-технологический колледж им.
Д. И. Менделеева»
Специальность:
18.02.12 Технология аналитического контроля химических соединений
Отчет
по учебной практике «Неорганический синтез»
Исполнитель: студент 18.12.41 ___________________ Николаенко Г.М.
(номер группы) (подпись, дата) (инициалы фамилия)
Руководитель практики:_____________ Шапорев М.С.
(подпись, дата) (инициалы, фамилия)
Отчет защищен _________ Оценка ____________
(дата)
Руководитель практики: _____________ Шапорев М.С.
(подпись) (инициалы, фамилия)
Новосибирск – 2022
Содержание
Общие правила работы в химической лаборатории. Правила техники безопасности. Первая помощь при несчастных случаях в лаборатории ……..3
Общие правила работы в химической лаборатории;
Правила техники безопасности;
Первая помощь при несчастных случаях в лаборатории;
Основные лабораторные операции, применяемые в органическом синтезе...6
Методы разделения и очистки веществ………………………………………..12
Лабораторные работы…………………………………………………………...14
Лабораторная работа №1 «Синтез бромэтана»;
Лабораторная работа №2 «Получение натриевой соли пара-толуолсульфокислоты»;
Лабораторная работа №3 «Синтез ацетона»;
Лабораторная работа № 4 «Синтез уксусноизоамилового эфира (изоамилоцетата)»;
Лабораторная работа № 5 «Синтез уксусноэтилового эфира (этилацетата)»;
1. Общие правила работы в химической лаборатории. Правила техники безопасности. Первая помощь при несчастных случаях в лаборатории
1.1. Общие правила работы в химической лаборатории
Приступая к практическим занятиям в аналитической лаборатории, необходимо помнить, что малейшая неаккуратность в работе приводит к искажению результатов анализов, на которые затрачивается много труда и времени.
Следует внимательно следить за тем, чтобы рабочее место всегда было чисто и сухо. Нельзя загромождать его посторонними предметами. На столе должно находиться только то, что необходимо для проведения текущей операции, все лишнее надо убирать.
При выполнении отдельных количественных определений следует тщательно соблюдать установленную методику работы. Нужно помнить, что результаты анализа могут быть хорошими только тогда, когда строго соблюдаются все условия, при которых данный метод был разработан и проверен. Не менее тщательно должны соблюдаться также правила, касающиеся техники выполнения отдельных операций, например, фильтрования, промывания, высушивания и прокаливания осадков и т.д.
Важное значение имеет ведение лабораторных записей. Ни в коем случае не разрешается делать эти записи на отдельных листках или кусках бумаги, а следует обязательно завести лабораторный журнал. При ведении журнала следует все необходимые данные заносить в него сразу, избегая переписываний. Каждому определению отводят особую страницу.
Рабочее место после выполнения лабораторной работы должно быть убранным и сдано дежурному студенту или лаборанту. Бумагу, спички, битое стекло выбрасывают в корзины.
1.2 Правила техники безопасности
Нельзя применять реактивы без этикеток, так как при реакциях с неизвестными веществами могут образовываться опасные продукты.
Нагретую посуду ставят на керамическую плитку, асбестовую сетку. Нагревание необходимо проводить осторожно и постепенно. Нельзя нагибаться над реакционным сосудом и заглядывать в него.
Включать в сеть электронагревательные приборы можно только сухими руками и в розетку с соответствующим напряжением. Следует помнить, что ток напряжением 220-380 В опасен для жизни.
Нельзя пить воду из химической посуды. Нельзя пробовать на вкус и вдыхать химические вещества.
Запрещается начинать работу без точного знания методики опыта.
На рабочем столе должен быть безупречный порядок.
Работы с ядовитыми, дурнопахнущими, огне- и взрывоопасными веществами выполняются обязательно в вытяжном шкафу.
При работе под тягой, голову необходимо держать вне вытяжного шкафа.
При работе с горючими веществами недопустимо наличие поблизости открытого огня.
Не пробовать на вкус и не вдыхать неизвестное вещество.
В лаборатории категорически запрещено есть, курить.
Нельзя оставлять работающие приборы без наблюдения.
Смешивая концентрированные кислоты с водой, лить кислоту в воду.
Наполнение пипеток кислотами, щелочами и другими ядовитыми веществами путем засасывания ртом запрещается.
Для наполнения пипеток следует пользоваться грушей.
Работать одному в лаборатории категорически запрещается, так как в ситуации несчастного случая некому будет оказать помощь пострадавшему и ликвидировать последствия аварии.
В процессе работы необходимо соблюдать чистоту и аккуратность, следить, чтобы вещества не попадали на кожу лица и рук, так как многие вещества вызывают раздражение кожи и слизистых оболочек.
Сосуды с веществами или растворами необходимо брать одной рукой за горлышко, а другой снизу поддерживать за дно.
В каждой лаборатории обязательно должны быть защитные маски, очки.
1.3. Первая помощь при несчастных случаях в лаборатории
1. Работающий в лаборатории должен знать, где находится аптечка первой помощи.
2. При ожогах водяным паром, горячими предметами, брызгами горячей воды и т.д. смазывают пораженное место 5-10%-ным раствором перманганата калия KMnO4, борным вазелином.
3. При попадании кислоты или щелочи на руки (одежду) следует смыть их водой, а затем кислоту нейтрализовать 3%-ным раствором гидрокарбоната натрия NaHCO3, а щелочь – 5%-ным раствором борной кислоты H3BO3 или 2%-ным раствором уксусной кислоты CH3COOH.
4. При попадании химических реактивов на лицо или в глаза необходимо сразу промыть их большим количеством воды, а затем, если необходимо, обратиться за медицинской помощью.
5. При порезах необходимо убедиться, нет ли в ране осколков стекла. При небольших порезах смазывают йодной настойкой края порезов, останавливают кровотечение, залив рану 10%-ным раствором хлорида железа(III) FeCl3 или 3%-ным раствором пероксида водорода Н2О2. Затем накладывают стерильную повязку.
2. Основные лабораторные операции, применяемые в органическом синтезе
2.1. Взвешивание
Взвешивание — одна из простых, но и самых ответственных операций в химической лаборатории, и поэтому, несмотря на простоту, она требует особой тщательности при выполнении.
Перед началом взвешивания необходимо убедиться в исправности весов. Легко летучие или неприятно пахнущие жидкости необходимо взвешивать в закрытой посуде, добавление или удаление избытка жидкости производить под тягой. Твердые вещества взвешивают в химическом стаканчике либо специально изготовленной коробочке из плотной бумаги, лучше из кальки. Нельзя помещать вещество непосредственно на чашку весов или производить взвешивание просто на листочке бумаги, тем более на фильтровальной. Взвешивание тары производят до помещения в нее взвешиваемого вещества.
Если в ходе взвешивания вещество просыпано или пролито, надо немедленно убрать его с чашки весов и рабочего стола.
По окончании взвешивания необходимо выключить весы, а также убедиться в том, что чашки весов и другие поверхности весов и стола не загрязнены случайно просыпанным веществом.
2.2. Перемешивание
Перемешивание во всех случаях способствует более равномерному нагреву, охлаждению реакционной массы, ускоряет растворение веществ, протекание реакции, уменьшает возможность локальных перегревов и повышений концентраций веществ и т. п. и всегда благоприятно сказывается на химическом процессе.
Перемешивание можно производить вручную и механически. Перемешивание вручную можно производить, когда реакция идет достаточно быстро (несколько минут) и проводится в открытых сосудах. Если жидкость находится в колбе, перемешивают плавным вращением колбы, держа ее за горло. Перемешивание в стакане лучше осуществлять стеклянной палочкой, в случае водных растворов на кончик стеклянной палочки следует надеть кусочек резиновой трубки.
Значительно чаще в лаборатории органического синтеза применяют механическое перемешивание с помощью разнообразных мешалок, соединяемых с валом электродвигателя с регулируемым числом оборотов.
При перемешивании жидкостей при температуре, далекой от их температуры кипения, а также тогда, когда непосредственный контакт реакционной массы с атмосферой не влияет на ход реакции, стержень мешалки помещают в резиновую пробку с отверстием, немного большим диаметра стержня. Пробку либо вставляют в горло колбы (если горл несколько, то в центральное), либо закрепляют зажимом на штативе. Чтобы обеспечить плавное вращение мешалки, на стержень перед его входом в отверстие пробки вносят одну-две капли глицерина или немного вазелина для смазывания трущихся поверхностей пробки и стержня.
При перемешивании жидкостей в приборах, снабженных обратным холодильником, а также если содержимое реакционного сосуда не должно сообщаться с атмосферой, ввод стержня мешалки в сосуд необходимо уплотнить. С этой целью применяют мешалки с затворами, лучше всего использовать затворы с цилиндрическими шлифами или уплотнителями.
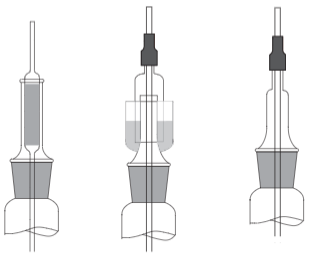 Часто используют резиновое уплотнение. В пробку вставляют направляющую трубку, имеющую диаметр на 2—3 мм больше, чем диаметр стержня мешалки, на эту трубку надевают кусочек резинового вакуумного шланга, который, с одной стороны, плотно облегает стержень, а с другой стороны, при наличии смазки (глицерин, вазелин) не препятствует свободному вращению стержня. Работу мешалки необходимо проверить до загрузки в прибор веществ. Перед включением мешалки ее предварительно прокручивают рукой, чтобы убедиться в свободном вращении и в том, что она не касается стенок сосуда или термометра. Включение электродвигателя производят плавно, придерживая вначале стержень рукой. Перемешивание должно быть достаточно энергичным, но без разбрызгивания жидкости. Часто используют резиновое уплотнение. В пробку вставляют направляющую трубку, имеющую диаметр на 2—3 мм больше, чем диаметр стержня мешалки, на эту трубку надевают кусочек резинового вакуумного шланга, который, с одной стороны, плотно облегает стержень, а с другой стороны, при наличии смазки (глицерин, вазелин) не препятствует свободному вращению стержня. Работу мешалки необходимо проверить до загрузки в прибор веществ. Перед включением мешалки ее предварительно прокручивают рукой, чтобы убедиться в свободном вращении и в том, что она не касается стенок сосуда или термометра. Включение электродвигателя производят плавно, придерживая вначале стержень рукой. Перемешивание должно быть достаточно энергичным, но без разбрызгивания жидкости.
3.3. нагревание и охлаждение
Все органические реакции и процессы, протекающие при выделении и очистке веществ, существенно зависят от температуры, и поэтому во многих случаях оказывается необходимо применять нагревание или охлаждение реакционного сосуда.
При выборе способа нагревания и нагревателя учитывают цель нагревания (проведение реакции при повышенной температуре, доведение раствора до кипения, длительное кипячение и т. д.), а также степень, скорость, длительность, вид нагреваемой жидкости. Помните: применение нагревателей и работа с органическими веществами при повышенных температурах требуют тщательного соблюдения правил техники безопасности и осторожности в работе!
В качестве источников нагрева в лаборатории используют электроплитки (только с закрытой спиралью!) и электрические колбонагреватели. Возможны два способа нагрева: прямой и посредством бани.
Во всех случаях нагревание низкокипящих (с температурой кипения до 60—70С ) можно осуществлять только на водяной бане, предварительно нагретой в другом месте.
Для нагревания жидкостей, кипящих при температуре около 80С, пользуются кипящей водяной баней или колбонагревателем. При кратковременном нагревании жидкостей, кипящих выше 100С, а также при их перегонке, можно пользоваться плиткой с закрытой спиралью. При пользовании плиткой с закрытой спиралью надо помнить, что плитка обладает очень большой инерционностью нагревания и охлаждения, и оперативно регулировать ее нагрев с помощью переключателя невозможно. Нельзя допускать непосредственное соприкосновение нагретой поверхности плитки с нагреваемым сосудом — между ними обязательно должны быть либо воздушный зазор, либо асбестовая прокладка или сетка.
Наиболее хороший и безопасный способ нагревания — использование нагревательных жидкостных бань. Жидкостные бани позволяют избегать перегрева (тем более локального) и обеспечивают равномерное нагревание, а также дают возможность поддерживать необходимый температурный режим в течение достаточно длительного времени. Температура жидкости в бане должна быть на 20—30С выше необходимой температуры в нагреваемом сосуде. В большинстве случаев нагрев бани до заданной температуры осуществляется заранее. Температуру нагрева в некоторых пределах можно регулировать глубиной погружения колбы в жидкость бани. Температуру бани контролируют техническим термометром, закрепленным зажимом на штативе так, чтобы он не касался стенок и дна бани.
В качестве жидкости в жидкостных банях используют вещества, не способные легко воспламеняться, обладающие достаточно высокой температурой кипения. Так, при нагревании колбы до температур порядка 80—90С, используют водяные бани (однако их нельзя использовать при работе с металлическим натрием!). При нагревании от 100 до 200С удобны глицериновые и гликолевые (этиленгликоль, диэтиленгликоль и т. д.) бани. Попадание в такую баню воды не опасно, а остающаяся на поверхности колбы жидкость легко смывается водой. Для нагревания до 250С применяют масляные (лучше всего силиконовое масло) и парафиновые бани. При высоких температурах жидкостные бани начинают «дымить » и с ними необходимо работать только под тягой.
В ряде случаев можно применять воздушную баню из термостойкого стекла. Такая баня обладает малой тепловой инерцией, однако не позволяет передавать большие количества тепла.
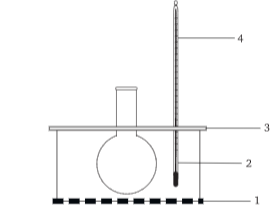
Воздушная баня
1 — асбестовая сетка; 2 — металлический кожух; 3 — круглая пластина
из листового асбеста; 4 — термометр
При нагревании жидкостей необходимо соблюдать ряд правил, основные из которых приведены ниже.
1. При нагревании жидкостей любым способом с целью равномерного нагрева и во избежание перегрева необходимо их перемешивание (ручное или механическое).
2. При кипячении жидкостей во избежание их перегрева и выброса в нагреваемую жидкость обязательно помещают «кипелки». Если кипячение было остановлено, то перед его возобновлением необходимо в нагреваемую жидкость добавить несколько новых «кипелок». Обычно в качестве «кипелок» используют кусочки фарфоровой посуды, размером в поперечнике 2—3 мм. «Кипелки» нельзя помещать в горячие жидкости во избежание их резкого вскипания!
3. Нагреваемый сосуд обязательно должен сообщаться с атмосферой. Категорически запрещается нагревать плотно закрытые колбы (даже пустые!).
4. При нагревании легколетучих или легковоспламеняющихся жидкостей обязательно применение обратных холодильников (в зависимости от температуры кипения жидкости — водяных или воздушных), с тем чтобы исключить попадание паров нагреваемой жидкости (а они часто тяжелее воздуха) на нагревающую поверхность и даже просто в атмосферу. Сообщение с атмосферой при этом должно быть только через холодильник, все остальные отверстия в колбе должны быть плотно закрыты.
5. Обязательно измерение температуры нагреваемой жидкости, даже если контролируется температура бани. Ртутный резервуар термометра должен быть полностью погружен в нагреваемую жидкость (за исключением перегонки жидкости) и не касаться стенок колбы.
Выбор способа охлаждения зависит от температуры, до которой необходимо охладить сосуд с реакционной смесью. Для охлаждения до 15—20С чаще всего используют воду. Для охлаждения до 0С используют тонко измельченный лед или снег. Лед лучше всего измельчать, предварительно завернув в полотенце, с помощью деревянного молотка. Затем в мелко измельченный лед добавляют немного воды до образования кашицы с целью повышения теплопередачи. Для того чтобы вынуть лед из кастрюли, достаточно подставить дно перевернутой кастрюли под струю теплой воды.
Чтобы достичь температур ниже 0С, обычно используют смеси тонко измельченного льда или снега с солями. Наиболее часто применяют смесь льда и поваренной соли в соотношении 3:1, дающей возможность охлаждать до −20С. Такую смесь готовят отдельно, затем покрывают ею дно бани, помещают в баню охлаждаемый сосуд и обкладывают затем его со всех сторон охладительной смесью. Чтобы охлаждающая смесь действовала дольше, баню рекомендуется обернуть асбестовой тканью или хотя бы укутать полотенцем.
3.4. Фильтрование
В лаборатории органической химии отделение осадка от раствора чаще всего проводят фильтрованием с применением вакуума. Создание вакуума в приемном сосуде позволяет резко сократить время фильтрования и более полно отделить осадок от жидкости, а также облегчает процесс промывки твердого продукта. Реализация всех достоинств фильтрования с применением вакуума (отсасывания) возможна, однако, только при соблюдении ряда правил. Так, не рекомендуется фильтровать под вакуумом легко летучие жидкости, поскольку при достаточно сильном разрежении они могут закипеть даже при комнатной температуре. Недопустимо фильтровать в горячем виде концентрированные растворы и легкокипящие жидкости.
Обычный прибор для фильтрования под вакуумом состоит из фарфоровой или стеклянной воронки с дырчатой перегородкой (воронка Бюхнера) и толстостенной конической колбы с боковым отводом (колба Бунзена), подключенной к водоструйному насосу через предохранительную склянку.
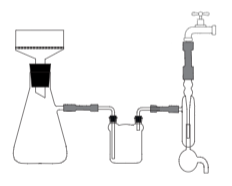
Прибор для фильтрования под вакуумом (нутч-фильтр)
Удобны в работе стеклянные воронки с впаянными пластинками из пористого стекла (воронки Шотта). Колбы Бунзена можно заменить и обычными круглодонными двугорлыми колбами или одногорлыми с применением насадок с отводами (но ни в коем случае не плоскодонными колбами!).
Размер воронки должен соответствовать количеству осадка. Желательно, чтобы осадок в конце фильтрования покрывал фильтр не более чем на половину высоты воронки, более толстый слой затрудняет промывание и отсасывание. Для фильтрования различных осадков (состоящих из крупных, средних или мелких частиц) желательно использовать фильтровальную бумагу соответствующей плотности. Правильно подобранная бумага обеспечивает максимальную скорость фильтрования без прохождения осадка через фильтр.
Скорость фильтрования можно также повысить, взяв воронку большего диаметра. На перегородку накладывают бумажный фильтр, диаметр которого должен быть чуть меньше диаметра перегородки. Фильтр должен ложиться без складок и закрывать все отверстия. При постоянной работе с одними и теми же воронками удобно при вырезании бумажного фильтра пользоваться картонными шаблонами, подогнанными заранее к каждой воронке. Подогнанный фильтр смачивают чистым растворителем, подключают вакуум и убеждаются, что фильтр плотно прилегает к перегородке (о неплотном прилегании фильтра свидетельствует характерный свистящий звук, вызванный подсосом воздуха).
Первоначально на фильтр наливают небольшое количество раствора с осадком, затем доливают суспензию в воронку по мере фильтрования. В тех случаях, когда осадок является целевым продуктом, его необходимо тщательно промыть чистым растворителем. Чтобы избежать потерь осадка за счет его растворимости, используют минимальное количество промывной жидкости. Для повышения эффективности промывания взятое количество растворителя используют не в один прием, а несколькими порциями.
Перед приливанием каждой новой порции растворителя необходимо как можно более полно отжать жидкость из осадка. С этой целью осадок на фильтре разглаживают и сильно прижимают с помощью стеклянной пробки, ликвидируя образующиеся трещины. После того, как жидкость из очередной порции растворителя перестает стекать с носика воронки, отключают вакуум, пропитывают осадок следующей порцией растворителя и опять отсасывают его с отжиманием.
Если осадок склонен к слипанию, то он не очень хорошо промывается подобным образом. В этих случаях осадок следует осторожно перемешать в воронке (а еще лучше перенести его для этого с фильтра в стакан) с небольшим количеством растворителя, после чего провести фильтрование.
По окончании фильтрования осадок отжимают до полного отсасывания жидкости из осадка (жидкость не должна отсасываться из осадка при сильном нажатии на него стеклянной пробкой). Хорошо отжатый осадок по консистенции должен напоминать «халву» и легко отделяться от фильтра.
Для высушивания осадок переносят во взвешенную посуду (бюкс, стаканчик, чашку Петри или коробочку из кальки). Сушат осадок на воздухе или в сушильном шкафу до постоянной массы. Гигроскопичные и легко окисляющиеся вещества следует сушить в вакуум-эксикаторах или в эксикаторах с поглотителями влаги (концентрированная серная кислота, хлористый кальций, силикагель и др.).
3. Методы разделения и очистки веществ
3.1. Перекристаллизация
Перекристаллизация является важнейшим методом очистки твердых веществ. Этим методом можно отделять как более растворимые, так и менее растворимые примеси. Однако следует иметь в виду, что перекристаллизация как метод очистки эффективна только для отделения небольших количеств примесей, т. е. является методом очистки, но не методом разделения. При содержании основного вещества менее 90—95 % перекристаллизация проходит с большими потерями и не дает высокой степени очистки. В этих случаях до перекристаллизации желательно избавиться от основной части загрязнений с помощью других методов. Необходимо также учитывать, что перекристаллизация всегда сопровождается потерей вещества, при этом потери тем больше, чем больше загрязнено вещество.
Выбор растворителя. Правильный выбор растворителя для перекристаллизации в большинстве случаев определяет успешную очистку вещества этим методом. Даже в тех случаях, когда есть литературные данные, необходимо провести предварительные опыты в пробирках с малыми количествами веществ, поскольку растворимость грязного вещества может существенно отличаться от растворимости чистого вещества.
Подходящим растворителем для перекристаллизации будет такой, который плохо растворяет вещество на холоде, хорошо растворяет при кипячении, и при охлаждении полученного раствора выпадают кристаллы очищенного вещества. При подборе растворителя обычно стремятся, в первую очередь, использовать наименее токсичные, представляющие наименьшую опас
Лабораторная работа №1
«Получение бромэтана»
Реактивы: Этиловый спирт 95% - 28 мл. (0,5 моль), бромид калия – 30г.
(0,25 моль), серная кислота (ρ – 1,835 г/см3) 33 мл. (0,6 моль), хлористый кальций (безводный).
Приборы и посуда: Колба круглодонная на 250 мл., колба Вюрца на 100 мл. или круглодонная колба с насадкой Вюрца, делительная воронка, прямой холодильник Либиха, дефлегматор, термометр от 20оС, аллонж изогнутый, колбы конические на 50 мл. (приемные), электроплитка, песчаная баня, кристаллизатор для приготовления ледяной бани.
Х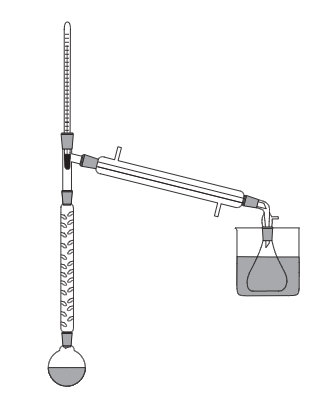 од работы: В реакционную колбу помещают 28 мл. этанола и 20 мл. холодной воды. (Вода добавляется для уменьшения образования побочного продукта – диэтилового эфира; сокращение потерь бромистоводородной кислоты которая обладает высокой летучестью и для частичного разбавления серной кислоты, чтобы исключить окислительно-восстановительную реакцию образования брома. Этиловый спирт берется в избытке, чтобы полнее использовать бромистоводородную кислоту.) Колбу охлаждают и при постоянном перемешивании осторожно приливают серную кислоту, а затем бромид калия. од работы: В реакционную колбу помещают 28 мл. этанола и 20 мл. холодной воды. (Вода добавляется для уменьшения образования побочного продукта – диэтилового эфира; сокращение потерь бромистоводородной кислоты которая обладает высокой летучестью и для частичного разбавления серной кислоты, чтобы исключить окислительно-восстановительную реакцию образования брома. Этиловый спирт берется в избытке, чтобы полнее использовать бромистоводородную кислоту.) Колбу охлаждают и при постоянном перемешивании осторожно приливают серную кислоту, а затем бромид калия.
После прибавления всех реактивов, приступают к сборке прибора и начинают нагревать.
Через некоторое время начинает отгоняться бромэтан, который собирается в конической колбе под слоем воды. Реакционную смесь нагревают до тех пор, пока из холодильника не перестанет стекать не растворившийся в воде бромэтан.
По окончании реакции содержимое приемника переносят в делительную воронку, отделяют нижний слой, содержащий бромэтан, в сухую колбу вместимостью 50-100 мл. добавляют небольшое количество прокаленного хлористого кальция для удаления остатков влаги.
Ч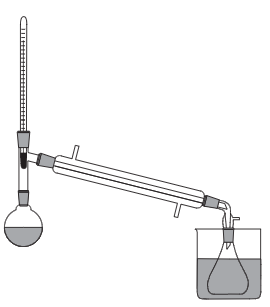 ерез 30-40 мин. высушенный бромэтан переносят в перегонную установку и перегоняют собирая фракцию, кипящую при температуре 36-40оС. ерез 30-40 мин. высушенный бромэтан переносят в перегонную установку и перегоняют собирая фракцию, кипящую при температуре 36-40оС.
KBr + H2SO4 → KHSO4 + HBr
C2H5OH + HBr → C2H5Br + H2O
CH3-CH2-OH + H2SO4 → CH3-CH2-HSO4 + H2O
CH3-CH2-HSO4 + HBr → CH3CH2Br + H2SO4
Галогенирование — процесс введения галогена в молекулу органического вещества, осуществляемый за счет реакции замещения или присоединения.
Неочищенный бромэтан окрашен в желтый цвет, что свидетельствует о наличии примеси в нем брома. В перегонном бромэтане могут быть примеси диэтилового эфира и этанола, от которых можно избавиться промыванием в делительной воронке концентрированной серной кислотой.
m(СH₃СH₂OH)=74*0,36=26,64
m (стакан) = 40,28
m(C7H8O3S + стакан) = 60,72
m(C7H8O3S) = 61,72-40,28 = 20,54
Выход=20,54/26,64*100=77%
Вывод: Получил бромэтан, путем реакции галогенирования.
Лабораторная работа №2
«Получение натриевой соли пара-толуолсульфокислоты»
Реактивы: Толуол -16мл(0,15моль), серная кислота (плотность 1,835г/мл) – 9,5мл (0,18 моль), углекислый натрий – 8г., хлорид натрия -20г.
Приборы и посуда: Колба круглодонная на 100 мл;, обратный холодильник;, стакан термостойкий;, воронка Бюхнера;, колба Бюнзена;, магнитная мешалка с термонагревателем.

CH3
Основная реакция:
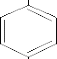 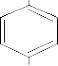 CH3 CH3

+ H2O
 + HOSO3H + HOSO3H

SO3 H
Ход работы:
Прибор 1.
В круглодонную колбу вставляют обратный холодильник и устанавливают на магнитную мешалку с нагревателем. В колбу помещают «якорёк» для перемешивания.
Прибор 2.
К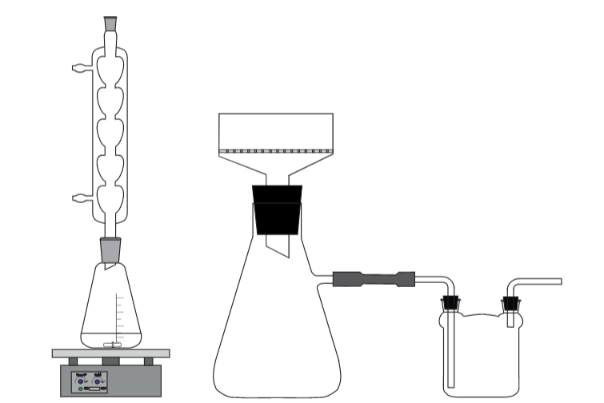 олбу Бюнзена с установленной в ней воронкой Бюхнера присоединяют к вакуумному насосу. олбу Бюнзена с установленной в ней воронкой Бюхнера присоединяют к вакуумному насосу.
Прибор 1 Прибор 2
Выполнение синтеза
В круглодонную колбу прибора 1 помещают 16 мл толуола и осторожно приливают 9,5 мл серной кислоты. Реакционную смесь кипятят в течение 1 часа при перемешивании.
Реакция считается законченной, когда слой толуола почти исчезает, а из холодильника лишь изредка стекают капли конденсата. Затем теплую реакционную массу выливают в стакан с 70 мл воды (если реакционная смесь начнет кристаллизоваться, ее необходимо подогреть) и колбу ополаскивают водой из промывалки. Кислый раствор осторожно нейтрализуют углекислым натрием, прибавляя его небольшими порциями, чтобы избежать вспенивания раствора. Затем добавляют в раствор 20 г хлорида натрия и нагревают смесь до кипения. Полученный раствор охлаждают водой со льдом.
Выпавшие кристаллы натриевой соли n-толуол сульфокислоты отфильтровывают на воронке Бюхнера (прибор 2) и отжимают между листами фильтровальной бумаги.
m(C7H8)=1,835г/мл*9,5м=17,4325
m (стакан) =138,2127
m(n-CH3C6H4SO3H)=0.16*172=27.52
m(C7H8O3S+ стакан) = 148,03 г
m(СH₃СH₂Br) = 55,90-44,34 = 9,8173 г
Выход=9,8173/27.52*100=37%
Вывод: Лабораторным путем получили кристаллы натриевой соли n-толуол сульфокислоты. Научились собирать установки для выполнения синтеза.
Лабораторная работа № 3
«Получение ацетона»
Реактивы: Изопропиловый спирт – 15,6 г (20 мл), 0,26 моль;, дихромат натрия – 15 г, 0,06 моль;, серная кислота (плотность 1,83 г/см3) – 18 мл.
Приборы и посуда: Круглодонная двугорлая колба на 250 мл;, обратный холодильник;, химический стакан на 250 мл;, прямой холодильник Либиха;, аллонж;, коническая колба на 100 мл;, капельная воронка;, термометр;, колбонагреватель.
Ход работы:
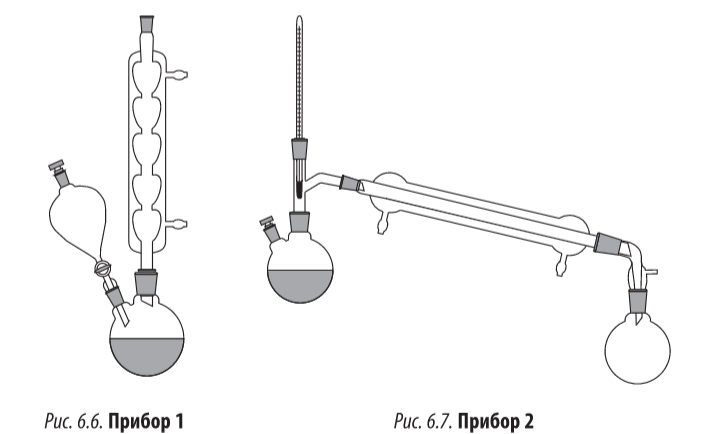
Прибор 1 (рис. 6.6)
В двугорлую круглодонную колбу вставляют капельную воронку и обратный холодильник. Колбу закрепляют в штативе таким образом, чтобы можно было ее периодически встряхивать.
Прибор 2 (рис. 6.7)
В двугорлой колбе заменяют обратный холодильник на прямой холодильник Либиха, к которому подсоединен аллонж и приемная колба на 50 мл. Капельную воронку убирают и открытое горло закрывают стеклянной пробкой.
Выполнение синтеза
В круглодонную колбу прибора 1 наливают 20 мл изопропилового спирта. В химическом стакане готовят хромовую смесь, растворяя 15 г дихромата натрия в 60 мл воды и осторожно приливают концентрированную серную кислоту. Хромовую смесь охлаждают до комнатной температуры и переносят в капельную воронку. Медленно прибавляют смесь к изопропиловому спирту с такой скоростью, чтобы реакционная смесь слабо кипела.
Когда вся хромовая смесь будет прибавлена, колбу нагревают на водяной бане в течение 10 мин. Затем обратный холодильник заменяют на прямой (прибор 2) и начинают перегонку. Собирают фракцию, кипящую при температуре 55 – 58 ⁰С. Выход ацетона
13 г (85%).
Ацетон – это прозрачная легко воспламеняющаяся жидкость. Он хорошо смешивается с водой, спиртом, диэтиловым эфиром в любых соотношениях. Ацетон применяется как растворитель для органических веществ, является составляющей композицией жидкости для снятия лака, некоторых чистящих веществ, клеев, лаков и т.д. Ацетон обладает раздражающим и наркотическим действием, работы с ним следует проводить в вытяжном шкафу.
m (стакан) = 44,34г
m(CH3-CO-CH + стакан) = 55,90 г
m(CH3-CO-CH) = 55,90-44,34 = 11,56 г
Выход=11,56/15,6*100=74%
Вывод: Получили лабораторным путем, ацетон с выходом 74%
Лабораторная работа № 4
«Синтез уксусноэтилового эфира (этилацетата)»
Реактивы: Этиловый спирт 95% 22,5 мл (0,37 моль);, уксусная кислота 20 мл (0,3 моль) ледяная;, кальций хлористый 8 г;, серная кислота (плотность 1,835) 2,5мл;, натрий углекислый 2%-ный раствор;, магний сернокислый безводный.
Приборы и посуда: Круглодонная колба на 100 мл;, насадка Вюрпа;, прямой холодильник Либиха;, термометр;, аллонж;, воронка капельная;, воронка делительная;, колбы конические плоскодонные на 100 мл;, колбонагреватель или плитка с масляной баней.
Сборка приборов
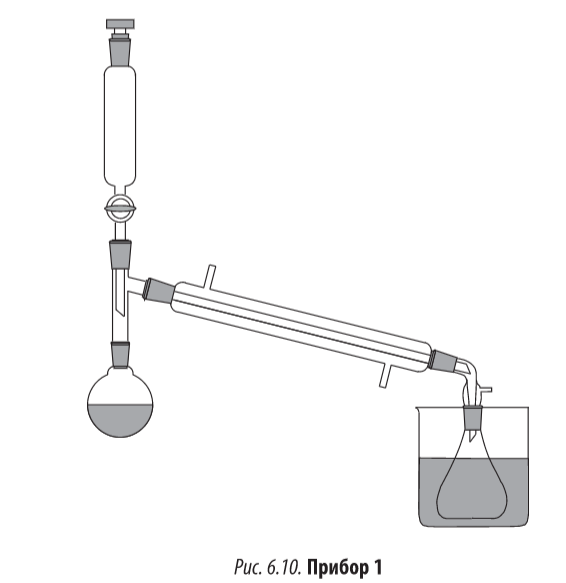
Прибор 1 (рис 6.10)
В круглодонную колбу вставляют насадку Вюрца, в верхнее отверстие которой устанавливают капельную воронку, а в боковой отвод – прямой холодильник, снабженный аллонжем. К аллонжу присоединяют приемную коническую колбу.
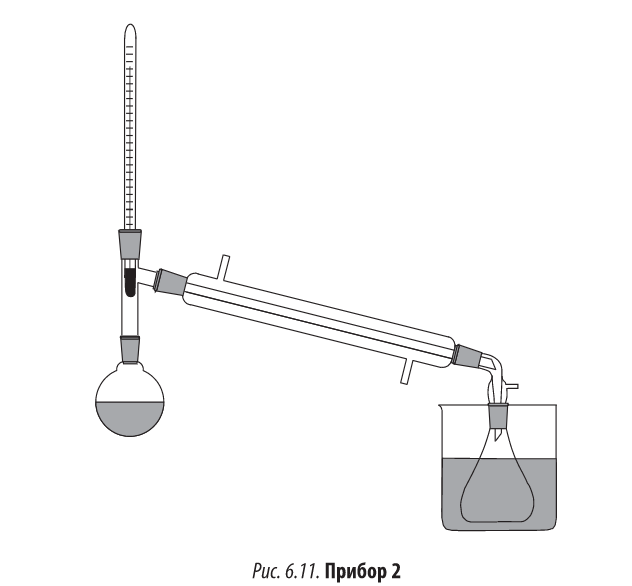
Прибор 2 (рис. 6.11)
В круглодонную колбу, снабженную насадкой Вюрца, вставляют термометр, прямой холодильник с аллонжем и приемной колбой (установка для простой перегонки).
Ходработы:
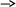 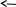 CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O
Побочные реакции:
H2SO4, нагревание
  2CH3CH2OH→CH3CH2 O CH2CH3 + H2O 2CH3CH2OH→CH3CH2 O CH2CH3 + H2O
H2SO4, нагревание
CH3CH2OH→CH2 - CH2 + H2O
В круглодонную колбу (прибор 1) помещают 2,5 мл этилового спирта, 2,5 мл серной кислоты и нагревают на масляной бане до 140⁰С. По достижении этой температуры начинают медленно прибавлять из капельной воронки смесь этанола и уксусной кислоты. Прибавление ведут с такой скоростью, с какой отгоняется этилацетат. Вместе с этилацетатом отгоняется некоторое количество спирта (температура кипения этанола 78⁰С), поэтому спирт берут в избытке, а выход продукта рассчитывают на взятое количество уксусной кислоты.
После окончания реакции (примерно через 2 ч), дистиллят, содержащий этилоцетат, избыток спирта и не прореагировавшую кислоту, переносят в делительную воронку и встряхивают с 2 %-ным раствором соды для удаления остатков кислоты до тех пор, пока верхний слой не будет показывать нейтральную или слабощелочную реакцию по универсальной индикаторной бумажке (примечание 1).
Затем отделяют нижний водный слой, а верхний промывают насыщенным раствором хлорида кальция для удаления остатка этилового спирта (примечание 2). Снова отделяют верхний слой, помещают его в сухую коническую колбу и высушивают безводным сульфатом магния или натрия. После высушивания (через
30 – 40 мин) эфир отфильтровывают от осушителя и перегоняют на водяной бане (прибор 2).
При температуре 71 – 75 ⁰ С отгоняется смесь спирта с этилацетатом, а при 75 – 78 ⁰С отгоняется относительно чистый уксусноэтиловый эфир. Выход его составляет ⁓20 г (55%).
Примечание 1. Раствор карбоната натрия следует прибавлять медленно, чтобы избежать вспенивания жидкости из-за выделяющегося диоксида углерода.
Примечание 2. Хлорид кальция дает с этиловым спиртом комплексное соединение CaCl2∙2C2H5OH, которое не растворимо в этилацетате, но хорошо растворяется в воде.
Уксусноэтиловый эфир (этилацетат) – это бесцветная жидкость с характерным карамельным запахом. Он хорошо растворяется в воде, спирте, хлороформе, бензоле и др. Применяется как растворитель нитроцеллюлозы, целлулоида, жиров, воска, лаков, смол. Используется как компонент фруктовых эссенций. В лаборатории из него получают ацетоуксусный эфир и ацетлацетон. В больших количествах токсичен, вызывает раздражение слизистых оболочек.
Лабораторная работа №5
«Синтез уксусноизоамилового эфира»
Реактивы: изоамиловый спирт, уксусная кислота ледяная, серная кислота, карбонат натрия, хлористый кальций, сернокислый магний
Приборы и посуда: круглодонная колба,насадка дина-старка, обратный холодильник, прямой холодильник либиха, насадка вюрца, аллонж, делительная воронка, дефлегматор, конические плоскодонные колбы, термометр, колбонагреватель
Прибор 1
Круглодонную колбу соединяем с насадкой дина-старк, в которую вставлен обратный холодильник. Колбу устанавливаем в колбонагреватель
Прибор 2
В круглодонную колбу устанавливают дефлегматор с насадкой вюрца. В верхнее отверстие вставляют термометр, а боковые отверстия соединяем с прямым холодильником, аллонжем и приемной колбой
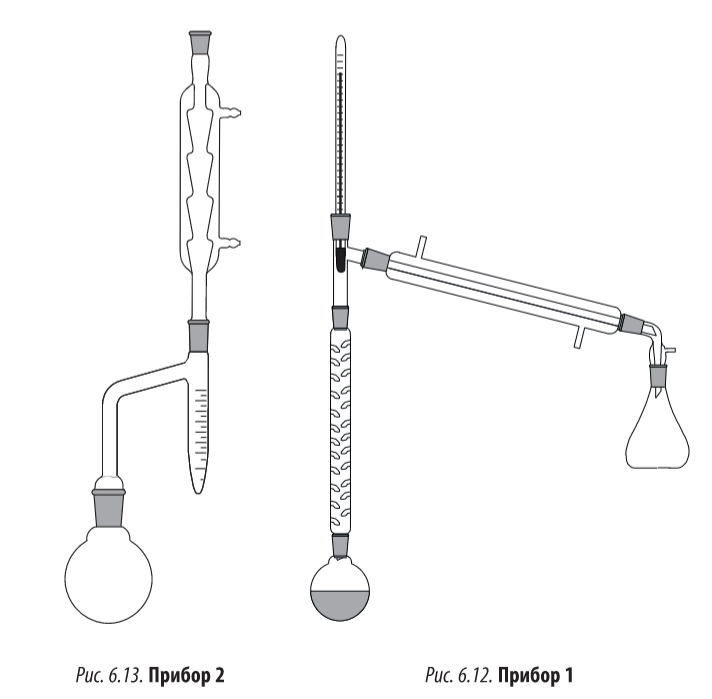
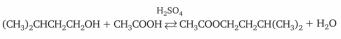
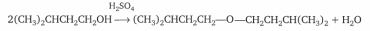
Выполнение синтеза:
В круглодонную колбу прибора 1 помещают 20 мл изоамилового спирта, 17 мл ледяной уксусной кислоты и 0,5 мл серной кислоты. Колбу нагревают на песчаной бане или колбонагревателе до тех пор, пока в насадке Дина — Старка не образуются два слоя: нижний (водный) и верхний (образовавшийся эфир, уксусная кислота и спирт), который стекает обратно в реакционную колбу. Окончание реакции определяют по количеству выделившейся воды (—4,5 мл) или пока в «ловушке» не перестанет увеличиваться слой воды. Смесь переносят в делительную воронку и отделяют эфирный слой от водного, затем эфирный раствор промывают водой, 5 %ным раствором карбоната натрия и вновь водой до нейтрального РН (проверять универсальной индикаторной бумажкой). Эфирный раствор переносят в коническую колбу, добавляют осушитель CaC12 или MgS04 и оставляют для высушивания —на 30—40 мин. Затем переносят высушенный продукт в прибор 2 и перегоняют, собирая фракцию, кипящую в интервале температур
136—1420С. Выход изоамилацетата составляет —27 г (80 И).
Уксусноизоамиловый эфир (изоамилацетат) — это бесцветная жидкость с фруктовым запахом. Растворимость в 100 г воды составляет 0,31 г, хорошо смешивается с этиловым спиртом. диэтиловым эфиром, хлороформом. Применяется как растворитель нитроцеллюлозы, а также в пищевой промышленности под названием грушевой эссенции. Кроме того, используется в парфюмерно-косметической, лакокрасочной, кожевенной промышленности. В больших количествах изоамилацетат токсичен, пары его раздражает слизистые оболочки глаз, носа, верхних дыхательных путей и обладают наркотическим действием.
m(C (CH3)2CHCH2CH2OH)=88г/м*0,25м=22г
m (стакан) =42,58
m(C СH₃СH₂Br + стакан) = 46,35 г
m(СH₃СH₂Br) = 55,90-44,34 = 3,5 г
Выход=3,5/22*100=16%
Вывод: Получили уксусноизоамиловый эфир (изоамилацетат) лабораторным путем с выходом 16%.
|
 Скачать 407.33 Kb.
Скачать 407.33 Kb.
 Часто используют резиновое уплотнение. В пробку вставляют направляющую трубку, имеющую диаметр на 2—3 мм больше, чем диаметр стержня мешалки, на эту трубку надевают кусочек резинового вакуумного шланга, который, с одной стороны, плотно облегает стержень, а с другой стороны, при наличии смазки (глицерин, вазелин) не препятствует свободному вращению стержня. Работу мешалки необходимо проверить до загрузки в прибор веществ. Перед включением мешалки ее предварительно прокручивают рукой, чтобы убедиться в свободном вращении и в том, что она не касается стенок сосуда или термометра. Включение электродвигателя производят плавно, придерживая вначале стержень рукой. Перемешивание должно быть достаточно энергичным, но без разбрызгивания жидкости.
Часто используют резиновое уплотнение. В пробку вставляют направляющую трубку, имеющую диаметр на 2—3 мм больше, чем диаметр стержня мешалки, на эту трубку надевают кусочек резинового вакуумного шланга, который, с одной стороны, плотно облегает стержень, а с другой стороны, при наличии смазки (глицерин, вазелин) не препятствует свободному вращению стержня. Работу мешалки необходимо проверить до загрузки в прибор веществ. Перед включением мешалки ее предварительно прокручивают рукой, чтобы убедиться в свободном вращении и в том, что она не касается стенок сосуда или термометра. Включение электродвигателя производят плавно, придерживая вначале стержень рукой. Перемешивание должно быть достаточно энергичным, но без разбрызгивания жидкости.

 од работы: В реакционную колбу помещают 28 мл. этанола и 20 мл. холодной воды. (Вода добавляется для уменьшения образования побочного продукта – диэтилового эфира; сокращение потерь бромистоводородной кислоты которая обладает высокой летучестью и для частичного разбавления серной кислоты, чтобы исключить окислительно-восстановительную реакцию образования брома. Этиловый спирт берется в избытке, чтобы полнее использовать бромистоводородную кислоту.) Колбу охлаждают и при постоянном перемешивании осторожно приливают серную кислоту, а затем бромид калия.
од работы: В реакционную колбу помещают 28 мл. этанола и 20 мл. холодной воды. (Вода добавляется для уменьшения образования побочного продукта – диэтилового эфира; сокращение потерь бромистоводородной кислоты которая обладает высокой летучестью и для частичного разбавления серной кислоты, чтобы исключить окислительно-восстановительную реакцию образования брома. Этиловый спирт берется в избытке, чтобы полнее использовать бромистоводородную кислоту.) Колбу охлаждают и при постоянном перемешивании осторожно приливают серную кислоту, а затем бромид калия.  ерез 30-40 мин. высушенный бромэтан переносят в перегонную установку и перегоняют собирая фракцию, кипящую при температуре 36-40оС.
ерез 30-40 мин. высушенный бромэтан переносят в перегонную установку и перегоняют собирая фракцию, кипящую при температуре 36-40оС. 

 CH3
CH3
 + HOSO3H
+ HOSO3H 
 олбу Бюнзена с установленной в ней воронкой Бюхнера присоединяют к вакуумному насосу.
олбу Бюнзена с установленной в ней воронкой Бюхнера присоединяют к вакуумному насосу. 


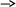
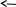 CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O
CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O