Министерство науки и образования Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Пермский национальный исследовательский
политехнический университет»
Аэрокосмический факультет
Кафедра «Ракетно-космической техники и энергетических систем»
Специальность: 24.05.02 «Проектирование авиационных и ракетных двигателей»
Дисциплина:
«Моделирование рабочих процессов в ракетных двигателях»
Расчетная работа
«Термодинамический расчет параметров продуктов сгорания в камере сгорания при горении баллиститного ракетного топлива»
Выполнил студент гр.РД-15-1с
Ерохина Марина Александровна
(Фамилия, имя, отчество)
(подпись)
Проверил:
Доцент кафедры РКТЭС____________
Бачев Николай Леонидович_________
(должность, Ф.И.О. руководителя от кафедры)
(оценка) (подпись)
(дата)
Пермь 2018
Оглавление
Реферат 3
Введение 4
1.Исходные данные 5
2.Условная химическая формула (УХФ). Элементарный состав. 6
3. Первое приближение Тк(1) =1600К 8
4. Второе приближение Тк(2) =1300К 11
5. Определение действительной температуры в КС 14
6. Определение параметров горения при действительной ТК 15
Заключение 19
Список источников 20
-
Реферат
Ракетные двигатели, работающие на твердом топливе (РДТТ), несмотря на простоту конструкции, характеризуются сложными физико-химическими и газодинамическими процессами, протекающими в камере сгорания (КС) и сопле.
Расчет преобразования химической энергии в тепловую, а затем в кинетическую сложный процесс его называют термодинамическим. Он позволяет расчетным путем определить энергетические параметры двигателя. При термодинамическом расчете двигателя химический состав топлива и теплоты образования компонентов задаются, как и давление в КС.
Природу топлива характеризуют энтальпией и элементным химическим составом. Последний определяет возможный состав индивидуальных веществ, составляющих продукты сгорания (ПС). Совокупность параметров, определяющих природу топлива, процессы в камере и термодинамические свойства индивидуальных веществ, составляющих ПС, образуют исходные данные для термодинамического расчёта.
Зная состав топлива и значение давления в КС, можно определить действительную температуру в КС и параметры горения с помощью метода приближений температур и нахождения параметров продуктов сгорания. При нахождении действительной температуры и констант химического равновесия используется метод линейной интерполяции.
Введение
Термодинамические характеристики определяют, рассчитывая идеальные процессы, имеющие место в идеальных ракетных двигателях, т.е. без учёта особенностей конкретной камеры реального двигателя, таких как схема смесеобразования, форма камеры сгорания и т.п. Тогда термодинамические характеристики зависят лишь от природы топлива и основных параметров процессов в камере.
Цель данной расчетной работы – нахождение действительной температуры в камере сгорания и параметров продуктов сгорания, при заданных давлении в камере сгорания и составе баллиститного ракетного топлива (БТТ).
Для достижения цели нужно решать следующие задачи:
определить энтальпию БТТ заданного состава;
определить элементарный состав топлива, получить условную химическую формулу;
провести первое приближение ТК(1), определить энтальпию ПС при заданной температуре сравнить её с энтальпией топлива;
провести второе приближение ТК(2), определить энтальпию ПС при заданной температуре сравнить её с энтальпией топлива;
построить график зависимости энтальпии от температуры в камере сгорания, определить по графику действительную температуру в КС;
определить параметры горения ПС при действительной ТК.
Исходные данные
Давление в камере сгорания (КС) Pk=116атм, степень нитрации N=14,0%.
Состав баллиститного твердого топлива (БТТ) представлен в таблице 1.
Таблица 1 – Состав БТТ.
№
|
Название
|
σmj, %
|
Формула
|
ΔH0, кДж/моль
|
Мj, кг/моль
|
ΔH0, кДж/кг
|
1
|
Нитроцеллюлоза
|
55
|
C6H7O2(ONO2)3
|
-1894,4
|
0,297
|
-6378,40
|
2
|
Нитроглицерин
|
19,8
|
C3H5(ONO2)3
|
-379,7
|
0,227
|
-1672,69
|
3
|
Динитротоулол
|
20
|
C7H6(NO2)2
|
64,85
|
0,182
|
356,32
|
4
|
Дифениламин
|
1,3
|
C12H11N
|
-130
|
0,169
|
-769,23
|
5
|
Диэтлфталат
|
2,1
|
C6H4(COOC2H5)2
|
-792,9
|
0,222
|
-3571,62
|
6
|
Вазелин
|
1,8
|
C20H42
|
-477,9
|
0,282
|
-1691,49
|
|
|
|
|
|
|
|
1.1 Определение энтальпии образования нитроцеллюлозы:
Молярная масса:
М1=12*6+1*7+(3-х)+16*2+16*(3-х)+16*3х+14х=162+45х
Элементарный состав:
gN = 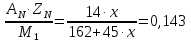 ; ;
Решив уравнение получим: x=2,95 >xmax =3 ;
Принимаем x=3, тогда
M1=12*6+7*1+16*(2+3*3)+14*3=297 г/моль =
= 0,297кг/моль;
gN = 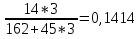
значит степень нитрации: N=14,14%;
Энтальпия образования нитроцеллюлозы:
ΔH0 = -5831,8+277,14*14,14+0,0933*14,142 = -1894,4 кДж/моль.
1.2 Молярные массы компонентов:
М2=12*3+1*5+16*9+14*3=227 г/моль = 0,227 кг/моль;
M3=12*7+1*6+16*4+14*2=182 г/моль = 0,182 кг/моль;
M4=12*12+1*11+14 = 169 г/моль = 0,169 кг/моль;
M5=12*(6+3*2)+1*(2+10)+16*2*2 = 222 г/моль = 0,222 кг/моль;
M6=12*20+1*42 = 282 г/моль = 0,282кг/моль.
1.3 Энтальпия образования БТТ заданного состава:
ΔH0=-6378,40*0,57-1672,69*0,139+356,32*0,20-769,23*0,055-3571,62*0,026-1691,49*0,010= -3949 кДж/кг.
Условная химическая формула (УХФ). Элементарный состав.
2.1 Количество атомов i-го элемента в j-ом компоненте:
ZC=6*0,57+3*0,139+7*0,20+12*0,055+12*0,026+20*0,010=6,409;
ZH=7*0,57+5*0,139+6*0,20+11*0,055+14*0,026+42*0,010=7,274;
ZO=11*0,57+9*0,139+4*0,20+4*0,026=8,425;
ZN=3*0,57+3*0,139+2*0,20+1*0,055=2,582.
2.2 Молярная масса топлива:
М=12*6,409+1*7,274+16*8,425+14*2,582=255,13 г/моль = =0,255кг/моль.
2.3 Элементарный состав:
gN = 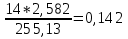
gС = 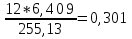
gН = 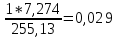
g0 = 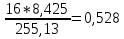
2.4 УХФ принимает вид:
C6,409H7,274O8,425N2,582
|
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10)
(11)
(12)
(13)
(14)
(15)
(16)
(17)
(18)
(19)
(20)
|
3. Первое приближение Тк(1) =1600К
3.1 Константы химического равновесия:
Таблица 2 – Константы химического равновесия для Тк(1).
Обозначение
|
Формула
|
Значение
|
К1
|
Pco*Po21/2/Рсо2
|
0,2074*10-4
|
К2
|
PН2*Po21/2/Рн2o
|
0,6615*10-4
|
К2а
|
Pco* Рн2o/(Рсо2* PН2)
|
3,1350
|
К3
|
PoH*PH21/2/РH20
|
0,1726*10-5
|
К4
|
P2NO/(PN2*Po2)
|
0,2575*10-4
|
К5
|
P2H/ PН2
|
0,2944*10-8
|
К6
|
P2O/ PO2
|
0,2657*10-9
|
К7
|
P2N/ PN2
|
0, 1354*10-16
|
|
|
|
3.2 Вспомогательные величины:
Q=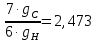 ; ;
R=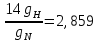 ; ;
S=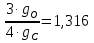 . .
3.3 Парциальные давления:
Принимаем:
Po2= PoH= PNO= PН= PO= PN=0;
Парциальное давление N2:
PN2=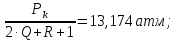
Константа хим. равновесия K2a:
К2а=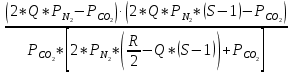
Подставив известные величины получим:
(К2а – 1) Р2со2+139Рсо2 –1365=0;
При К2а=3,135, решение квадратного уравнения: Рсо2=8,52 атм.
Парциальные давления CO, H2O, H2:
Pco =2*Q* PN2 – Рсо2 =56,64атм;
Рн2o =2*Q* PN2*(S-1) – Рсо2 = 12,07атм;
PH2 =2* PN2 (R/2 – Q*(S-1)) + Рсо2 = 25,59атм.
Константа хим.равновесия K2a по найденным парциальным давлениям:
K2a = 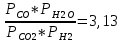
Проверка константы химического равновесия K2a и парциальных давлений по погрешности:
ΔK2a = 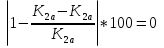
ΔP = 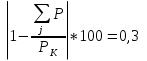
3.4 Молярная масса ПС в камере:
Молярная масса компонента рассчитывается по формуле:
Mi=Ai* Zi,
где Ai – атомная масса, Zi – количество атомов.
|
(21)
(22)
(23)
(24)
(25)
(26)
(27)
(28)
(29)
(30)
(31)
(32)
(33)
(34)
|
Таблица 3 – Молярные массы компонентов.
Компонент
|
Mj , кг/моль
|
CO2
|
0,044
|
H2O
|
0,018
|
CO
|
0,028
|
OH
|
0,017
|
NO
|
0,030
|
H2
|
0,002
|
O2
|
0,032
|
N2
|
0,028
|
H
|
0,001
|
O
|
0,016
|
N
|
0,014
|
Молярная масса ПС:
M=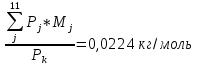
3.5 Массовый состав ПС: gj = 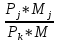
Массовый состав CO2, CO, H2O, H2, N2:
gСO2 = 0,144; gСO = 0,610; gН2O = 0,084; gH2 = 0,020; gN2 = 0,142.
Проверка 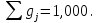
3.6 Энтальпия компонентов ПС:
Формула перевода энтальпии из кал/моль в кДж/кг:
Hj=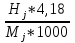
|
(35)
(36)
(37)
|
Таблица 4 – Энтальпии компонентов ПС.
Компонент
|
Hj, кал/моль
|
Hj, кДж/кг
|
CO2
|
–77840,4
|
–7394,838
|
H2O
|
–45118,3
|
–10477,472
|
CO
|
–16257,6
|
–2427,027
|
OH
|
19686,8
|
4840,637
|
NO
|
31988,3
|
4457,036
|
H2
|
9484,4
|
19822,396
|
O2
|
10616,5
|
1386,780
|
N2
|
10051,6
|
1500,560
|
H
|
58574,0
|
244839,320
|
O
|
65717,4
|
17168,671
|
N
|
92050
|
27483,500
|
Формула энтальпии ПС в первом приближении:
Hпс=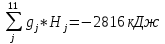
HТ= - 3949 кДж/кг.
HТ> Hпс, тогда Тк(2) = Тк(1) – ΔT
Принимаем Тк(2)=1300К.
|
(38)
(39)
|
4. Второе приближение Тк(2) =1300К
4.1 Константы химического равновесия:
Таблица 5 – Константы химического равновесия для Тк(2).
Обозначение
|
Формула
|
Значение
|
К1
|
Pco*Po21/2/Рсо2
|
0,1591*10-6
|
К2
|
PН2*Po21/2/Рн2o
|
0,8648*10-7
|
К2а
|
Pco* Рн2o/(Рсо2* PН2)
|
1,8400
|
К3
|
PoH*PH21/2/РH20
|
0,1116*10-7
|
К4
|
P2NO/(PN2*Po2)
|
0,1112*10-5
|
К5
|
P2H/ PН2
|
0,1220*10-11
|
К6
|
P2O/ PO2
|
0,4191*10-13
|
К7
|
P2N/ PN2
|
0,4503*10-22
|
4.2 Парциальные давления:
Используя квадратное уравнение (27) при К2а=1,8400, находим:
Pco2= 10,6атм.
Из уравнений (28)-(30) получили:
Pco = 54,56атм,
Рн2o =9,9атм ,
PH2 =27,674 атм.
Константа хим.равновесия K2a по найденным парциальным давлениям по формуле (31): K2a =1,841.
Погрешность K2a и парциальных давлений по формулам (32), (33):
ΔK2a =0,01%, ΔP=0,04%.
4.3 Молярная масса ПС в камере:
Молярная масса ПС с использованием таблицы 3 по формуле (35):
M=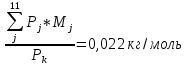
4.4 Массовый состав ПС:
Массовый состав CO2, CO, H2O, H2, N2 по формуле (36):
gСO2 = 0,18; gСO = 0,59; gН2O = 0,069; gH2 = 0,021; gN2 = 0,142.
Проверка 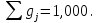
4.5 Энтальпия компонентов ПС:
Перевод кал/моль в кДж/кг по формуле (37).
Таблица 6 – Энтальпии компонентов ПС.
Компонент
|
Hj, кал/моль
|
Hj, кДж/кг
|
CO2
|
–82013,4
|
–7791,273
|
H2O
|
–48423,2
|
–11244,94
|
CO
|
–18771,7
|
–2802,347
|
OH
|
17340,3
|
4263,674
|
NO
|
29430,5
|
4100,650
|
H2
|
7184,3
|
15015,187
|
O2
|
8005,1
|
1045,666
|
N2
|
7565,1
|
1129,361
|
H
|
57083,6
|
238609,448
|
O
|
64222,5
|
16778,128
|
N
|
90559,6
|
27038,509
|
Энтальпия ПС во втором приближении:
Hпс=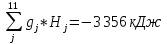
|
(40)
|
5. Определение действительной температуры в КС
Из графика на рисунке 1 получено, что ТК=1254,086 К.
Рисунок 1 – График зависимости энтальпии ПС от Т и график энтальпии топлива.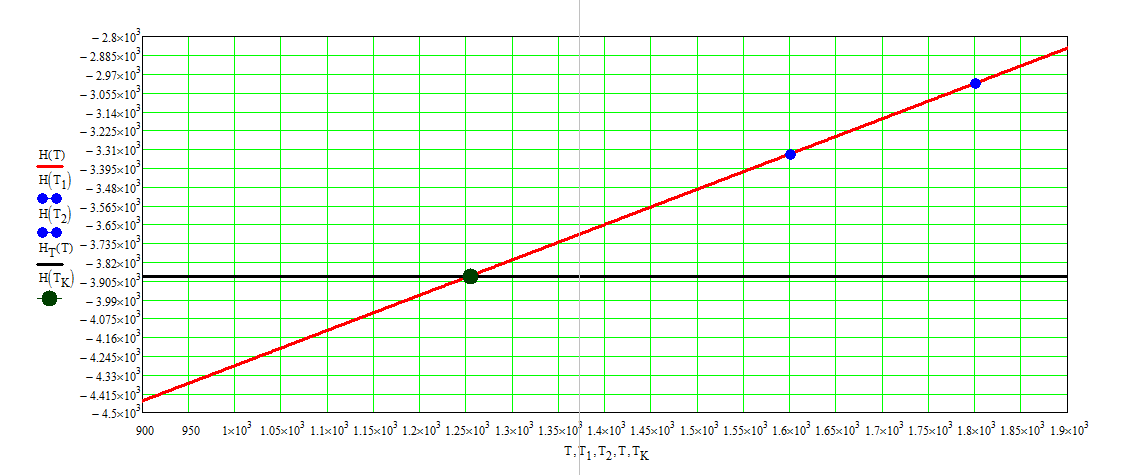
6. Определение параметров горения при действительной ТК
4.1 Константы химического равновесия:
Так как значение действительной ТК не табличное, то константы находим с помощью линейной интерполяции.
Таблица 7 – Константы химического равновесия для ТК.
Обозначение
|
Формула
|
Значение
|
К1
|
Pco*Po21/2/Рсо2
|
0, 9192*10-6
|
К2
|
PН2*Po21/2/Рн2o
|
0, 5258*10-7
|
К2а
|
Pco* Рн2o/(Рсо2* PН2)
|
1,6526
|
К3
|
PoH*PH21/2/РH20
|
0, 6083*10-7
|
К4
|
P2NO/(PN2*Po2)
|
0, 1324*10-6
|
К5
|
P2H/ PН2
|
0, 1792*10-13
|
К6
|
P2O/ PO2
|
0, 6229*10-15
|
К7
|
P2N/ PN2
|
0,2426*10-22
|
6.2 Вспомогательные величины из формул (21) – (23):
Q=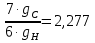 ; R= ; R=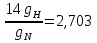 ; S= ; S=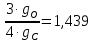 . .
6.3 Парциальные давления в первом приближении:
Принимаем: Po2= PoH= PNO= PН= PO= PN=0.
Парциальное давление N2 , полученное по формуле (25): PN2=10,290 атм.
Используя квадратное уравнение (27) при К2а=1,6526, находим:
Pco2= 11,124 атм.
Парциальные давления CO, H2O, H2 из уравнений (28)-(30) получили:
Pco = 35,737 атм,
Рн2o =9,448 атм ,
PH2 =18,366 атм.
Константа хим.равновесия K2a по найденным парциальным давлениям по формуле (31): К2а=1,6526.
Погрешность K2a и парциальных давлений по формулам (32), (33):
ΔK2a =0%.
6.3 Парциальные давления во втором приближении:
Po2= K2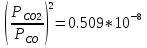 атм; атм;
PoH= K3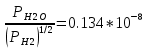 атм; атм;
PNO= 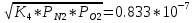 атм; атм;
PН= 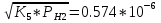 атм; атм;
PO= 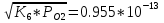 атм; атм;
PN=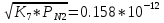 атм. атм.
Проверка погрешностей давлений по формуле (33):
ΔP = 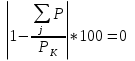
5. Молярная масса ПС при ТК по формуле (35):
M=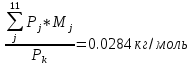 . .
6. Массовый состав ПС согласно формуле (36):
gj = 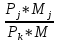
gСO2 =0,203; gСO = 0,415; gН2O = 0,070; gOH = 9,434*10-12 ;gNO =1,104*10-6 gH2 = 0,015; gO2 = 6,747*10-11; gN2 = 0,119; gH =2,378*10-10 ;
gO =6,329*10-16 ; gN =9,163*10-16.
Проверка: 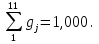
7. Газовая постоянная:
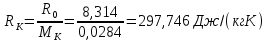
8. Плотность ПС:
Давление Pk=85атм, необходимо перевести в Па,
тогда Pk=85атм =8,613*106Па.
ρK=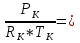 23,066 кг/м3 23,066 кг/м3
9.Удельная изобарная теплоемкость:
Сp=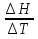
Из рисунка 1 ΔH = 318,985 кДж при ΔT = 200К, тогда по формуле (48):
Cp = 1594,925 Дж/(кгК).
10. Изохорная удельная теплоемкость:
Сv=Cp-RK=1297,179 Дж/(кгК).
11. Показатель адиабаты:
k=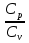 = 1,23 = 1,23
12. Сила топлива:
f=RK*TK =373399 Дж/кг = 373,4 кДж/кг.
13. Удельный импульс давления:
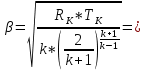 933,930 м/с. 933,930 м/с.
|
(41)
(42)
(43)
(44)
(45)
(46)
(47)
(48)
(49)
(50)
(51)
(53)
|
Заключение
Произведен расчет термодинамических параметров камеры сгорания. Цель данной расчетной работы достигнута – найдена действительная температура в камере сгорания и параметры горения, при заданных условиях. Полученная ТК=1254,086 К. Погрешности вычислений не превышают 0,4%.
Термодинамические и теплофизические свойства твердых ракетных топлив и их продуктов сгорания. Под ред. В. Е. Алемасова. М.: Изд-во МО СССР, 1977. – 318 с.
Шевелюк М. И. Теоретические основы проектирования жидкостных ракетных двигателей. – Гос. научно-техн. изд-во, 1960.
|
 Скачать 75.25 Kb.
Скачать 75.25 Kb.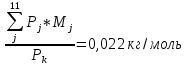

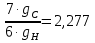 ; R=
; R=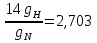 ; S=
; S=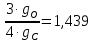 .
.
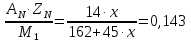 ;
;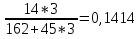
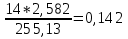
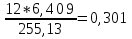
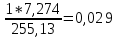
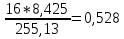
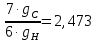 ;
;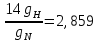 ;
;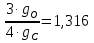 .
.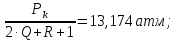
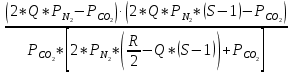
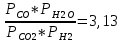
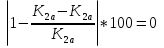
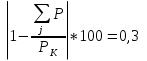
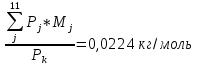
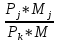
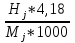
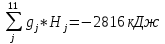
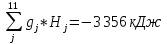
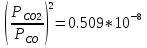 атм;
атм;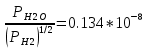 атм;
атм;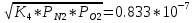 атм;
атм;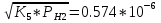 атм;
атм;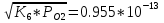 атм;
атм;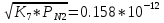 атм.
атм.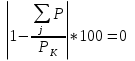
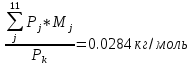 .
.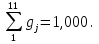
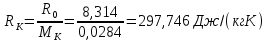
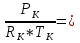 23,066 кг/м3
23,066 кг/м3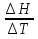
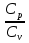 = 1,23
= 1,23 933,930 м/с.
933,930 м/с.