Кинетические закономерности протекания химических реакций. Лабораторные работы № 1, № 2 и № 3 Губина М.А.. Пичугина Анна Игоревна Тверь, 2021 лабораторная работа 1 Кинетические закономерности протекания химических реакций исследование
 Скачать 56.85 Kb. Скачать 56.85 Kb.
|
|
Министерство образования и науки РФ Федеральное ГОСУДАРСТВЕННОЕ бюджетное оБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «ТВЕРСКОЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» (ФГБОУ ВО «ТвГТУ») Кафедра ХТП Лабораторный журнал по дисциплине «Химия» Выполнила: Проверил: доц. каф. ХТП, к.х.н. Пичугина Анна Игоревна Тверь, 2021 Лабораторная работа № 1 «Кинетические закономерности протекания химических реакций» 1. Исследование зависимости скорости протекания реакции от концентрации реагента О скорости протекания реакции (W = kτ –1) Na2S2O3 + H2SO4 = S↓ + SO2 + Na2SO4 + H2O судят по промежутку времени (τ, с) с момента сливания растворов до первых признаков появления в растворе осадка серы (секундомер останавливают в момент появления голубой окраски раствора, обусловленной рассеянием света, образовавшимися в растворе частицами серы). Выполнение опыта. Готовят в пробирках растворы тиосульфата натрия Na2S2O3 различной концентрации. Добавляют в приготовленный раствор одну каплю раствора серной кислоты H2SO4 (Сн = 2 моль/дм3), одновременно включают отсчет времени по секундомеру и измеряют продолжительность взаимодействия до образования осадка (τ, с). Условия и результаты опыта заносят в таблицу 2. По данным таблицы 2 построить график в координатах «W – концентрация Na2S2O3». Сделать вывод о характере полученной зависимости. Влияние концентрации тиосульфата натрия на скорость реакции
Выполнение опыта. Пробирку с раствором перед добавлением кислоты выдерживают 1-2 минуты в стакане с водой, температура, которой соответствует выбранной. Готовят воду нужной температуры, смешивая горячую и холодную воду. Условия и результаты опыта заносят в таблицу. По данным таблицы построить график в координатах «W – t» Сделать вывод о соответствии зависимости скорости реакции от температуры правилу Вант Гоффа. 2. Смещение равновесия обратимой химической реакции О состоянии равновесия обратимой реакции FeCl3 + 3 KSCN = Fe(SCN)3 + 3 KCl судят по интенсивности красной окраски раствора, обусловленной присутствием продукта взаимодействия – тиоцианата железа(III) Fe(SCN)3. Выполнение опыта. В 4 пробирки вносят по 10 капель разбавленных растворов FeCl3 и KSCN. Получают растворы с одинаковой интенсивностью окраски, свидетельствующей о равной концентрации Fe(SCN)3. Одну пробирку оставляют в качестве контрольной, а в другие добавляют одно из веществ, участвующих в равновесии. Результат исследования заносят в таблицу. Составить выражение для константы равновесия исследуемой реакции. Сделать вывод о подчинении наблюдаемых явлений принципу Ле- Шателье. Na2S2O3 + H2SO4 ⟶ Na2SO4 + SO2↑ + S↓ + H2O Вывод: скорость химической реакции зависит от концентрации реагирующих веществ. Смещение равновесия при изменении концентрации вещества в растворе
Лабораторная работа № 2 «Ионные реакции и гидролиз солей» Опыт 1. Гидроксиды магния и алюминия и исследование их свойств Выполнение работы. Налить в две пробирки по 3-4 капли раствора соли магния, в две другие – столько же раствора соли алюминия. В каждую пробирку добавлять по каплям 2н. раствор едкого натра до появления осадков гидроксидов. Испытать отношение полученных гидроксидов к кислотам и щелочам. Запись данных опыта. Отметить цвет полученных осадков. Сделать вывод о свойствах гидроксидов Mg и Al. Написать уравнение реакций в молекулярной и ионной форме. Объяснить различие в свойствах гидроксидов. Гидроксид алюминия проявляет амфотерные свойства: Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O Al(OH)3 + 3H+ + 3Cl- ⟶ Al3+ + 3Cl- + 3H2O Al(OH)3 + 3H+ ⟶ Al3+ + 3H2O Al(OH)3 + NaOH ⟶ Na[Al(OH)4] Al(OH)3 + Na+ + OH- ⟶ Na+ + [Al(OH)4]- Al(OH)3 + OH- ⟶ [Al(OH)4]- Взаимодействие гидроксида магния с кислотой: Mg(OH)2 + 2HCl ⟶ MgCl2 + 2H2O Mg(OH)2 + 2H+ + 2Cl- ⟶ Mg2+ + 2Cl- + 2H2O Mg(OH)2 + 2H+ ⟶ Mg2+ + 2H2O Механизмы реакций нейтрализации гидроксида алюминия и гидроксида магния ничем не отличаются, это видно из кратких ионных уравнений. Опыт 2. Гидролиз ортофосфатов натрия Выполнение работы. В три пробирки внести по 5-6 капель раствора нейтрального лакмуса. Одну пробирку оставить в качестве контрольной, во вторую добавить 3-4 кристалла фосфата натрия, в третью – столько же дигидрофосфата натрия. Содержимое второй и третьей пробирок тщательно перемешать до полного растворения солей. Отметить изменение окраски лакмуса по сравнению с окраской в контрольной пробирке. Запись данных опыта. На увеличение концентрации каких ионов указывает изменение окраски лакмуса при растворении фосфата и дигидрофосфата натрия? Написать уравнение гидролиза фосфата натрия по первой ступени. Объяснить, чем обусловлена кислотность раствора NaH2PO4. Полное ионное уравнение 3Na + + PO4 3- + HOH ⇄ 2Na + + HPO4 2- + Na + + OH — Сокращенное (краткое) ионное уравнение PO4 3- + HOH ⇄ HPO4 2- + OH — Да, этот раствор имеет слабокислую среду, рН которой равна 4,6. Объясняется это тем, что наряду с гидролизом: NaH2PO4 + H2O<-->NaOH + H3PO4 в растворе происходит диссоциация дигидрофосфат аниона: H2PO4(-)<--> H(+) + HPO4(2-), которая преобладает над процессом гидролиза. Опыт 3. Гидролиз силиката натрия Выполнение работы. В две пробирки внести по 5-6 капель раствора силиката натрия, в одну из них добавить каплю раствора фенолфталеина. Отметить появление красной окраски. На избыток какого иона это указывает? Во вторую пробирку добавить 4-5 капель раствора хлорида аммония. Запись данных опыта. Отметить наблюдаемые явления и объяснить различие в степени гидролиза силиката натрия в чистой воде и в присутствии хлорида аммония. Написать молекулярные и ионно-молекулярные уравнения обоих случаев гидролиза. Присутствие каких ионов увеличило степень гидролиза во втором случае? Как уменьшить гидролиз силиката натрия? Na2SiO3 -> 2Na(+) + SiO3(2-) SiO3(2-) +HOH<=> HSiO3(-) +OH(-) Наличием иона OH(-) объясняется окрас фенолфталеина Гидролиз по аниону (образовано соединение слабой кислотой и сильный основанием) Среда щелочная Уравнение гидролиза Na2SiO3+H2O<=> NaHSiO3 +NaOH 2) пробирка Na2SiO3+ HOH = NaHSiO3+NaOН-гидролиз соли по аниону NH4Cl+HOH=NH3+H2O+HCl - гидролиз соли по катиону. NaOH+HCl=NaCl+H2O - взаимодействие продуктов гидролиза Na2SiO3+NH4Cl=NaHSiO3+NH3+NaCl итоговое уравнение получено сложением 3-х уравнений. Реакции идут в водном растворе. Опыт 4. Получение малорастворимых солей свинца(II) Выполнение работы. В четыре пробирки раздельно внести по 2-4 капли 2 н. Растворов серной и хлороводородной кислот, раствора иодида калия. В каждую пробирку добавить по 2-3 капли раствора соли свинца. Отметить образование осадков и их цвет. Написать уравнения протекающих реакций. 8KI + 5H2SO4 Лабораторная работа № 3 «Определение общей жесткости воды» Цель работы: Определение общей жесткости воды Экспериментальная часть Определение проводится методом комплексонометрического титрования. Он основан на аналитическом использовании реакций комплексообразования ионов металла с полидентантными хелатообразующими органическими реагентами – комплексонами. Наиболее часто применяют комплексон (III) – двунатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА) Na2H2Y. Для краткости обозначим анион ЭДТА как Y4–, тогда уравнение реакции комплексообразования, например, с двухзарядными ионами металлов, будет иметь вид: M+ + HY2- = [MY]2- + 2H+ Вне зависимости от заряда иона металла комплексообразователя всегда образуются комплексы состава 1:1. Жесткость воды – это совокупность свойств, обусловленная наличием в ней катионов кальция Са2+ и магния Mg2+. Сумму концентраций Са2+ и Mg2+ называют общей жесткостью (Нобщ, моль.экв/дм3 или моль.экв/м3). Обычно общую жесткость определяют титрованием стандартным раствором ЭДТА. В этом случае жесткость рассчитывают по уравнению: 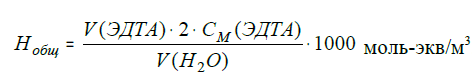 Реактивы и оборудование: титрант – стандартный раствор ЭДТА c концентрацией 0,025 моль/дм3; коническая колба для титрования объемом 250 см3; пипетка на 10,00 см3; бюретка объемом 25 см3; индикатор эриохромовый черный Т; аммиачный буфер рН = 10. Выполнение работы Определяют общую жесткость водопроводной воды. Готовят бюретку для титрования и заполняют ее стандартным раствором ЭДТА. Мерным цилиндром отбирают 50,0 см3 водопроводной воды, переносят ее в колбу для титрования и приливают 1 см3 аммиачного буфера рН = 10. Добавляют на кончике шпателя кристаллы индикатора и начинают титрование. Последние порции ЭДТА приливают по каплям. Титрование останавливают в тот момент, когда произойдет резкий переход окраски от фиолетовой к синей. Записывают объем раствора ЭДТА, пошедший на титрование. Повторяют титрование еще три раза. Перед каждым титрованием коническую колбу моют и ополаскивают дистиллированной водой. Примечания: 1) буферный раствор приливают обязательно перед добавлением индикатора; 2) индикатора не следует добавлять слишком много, иначе окраска изменяется медленно и раствор оказывается перетитрованным. Запись данных опыта и расчеты Данные записать по приведенной ниже форме. Концентрация титранта CМ(ЭДТА) = 0,025 моль/дм3. Индикатор – эриохромовый черный Т. По результатам титрования найти средний объем титранта V(ЭДТА) и рассчитать общую жесткость воды по приведенной выше формуле. 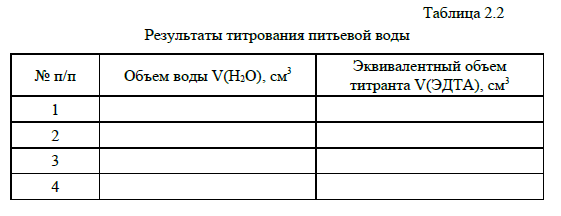 Ca(HCO3)2 ⇔ CaCO3↓ + CO2↑ + H2O Mg(HCO3)2 ⇔ MgCO3 + CO2↑ + H2O 2MgCO3 + H2O ⇔ (MgOH)2CO3↓ + CO2↑ или (MgOH)2CO3 + H2O ⇔ 2Mg(OH)2↓ + CO2↑ Лабораторная работа № 4 «Окислительно-восстановительные реакции» Опыт 1. Взаимодействие металлов с кислотами Выполнение опыта. В три пробирки поместить по небольшому кусочку магния и добавить в каждую пробирку соответственно 2н растворы кислот - хлорводородной, серной и азотной. Запись данных опыта. Составить уравнения реакций. Укажите окислительно-восстановительные свойства магния, кислот. Опыт 2. Влияние рН среды на характер восстановления перманганата. Выполнение работы. В три пробирки внести по 3-4 капли раствора перманганата калия. В одну пробирку добавить 2 капли 2н. раствора серной кислоты, в другую – столько же воды, в третью – 3-4 капли 2н. раствора щелочи. Во все три пробирки прибавить по 1 микрошпателю кристаллического сульфита натрия. Отметить различное изменение первоначальной окраски раствора перманганата в каждом случае. Чем это вызвано? Запись данных опыта. Написать электронные и молекулярные уравнения реакций, расставьте коэффициенты, учитывая, что ион: при рН <7 Na2SO3 + KMnO4 + H2SO4 = MnSO4 + Na2SO4 + H20 при рН>7 Na2SO3 + KMnO4 + NaOH = K2Mn04 + Na2SO4 + H2O при рН=7 Na2SO3 + KMnO4 + H2O = Na2S04 + MnО2 + KOH Лабораторная работа № 5 «Электрохимические процессы» Опыт 1. Электролиз растворов солейРеактивы и оборудование. Электролизер (U-образная стеклянная трубка); источник постоянного тока; графитовые электроды, электрические провода, раствор ZnSO4 0,5 н; раствор CuSO4 0,5 н; раствор Na2SO4 0,5 н, раствор KI 0,1 н. 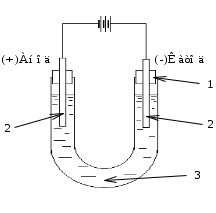 Рис. 2. Схема лабораторного электролизера. 1 – пробки; 2 – графитовые электроды; 3 – электролит. а) Электролиз водного раствора сульфата натрия Выполнение работы. Собрать электролизер в соответствии со схемой, приведенной на рис. 2. Заполнить электролизер раствором Na2SO4, подключить источник питания. Наблюдать изменения, происходящие на электродах и в растворах в обоих коленах электролизера. б) Электролиз водного раствора иодида калия Выполнение работы. Собрать электролизер в соответствии со схемой, приведенной на рис. 2. Заполнить электролизер раствором КI, подключить источник питания. Наблюдать изменения, происходящие на электродах и в растворах в обоих коленах электролизера. в) Электролиз водного раствора сульфата меди Выполнение работы. Собрать электролизер в соответствии со схемой, приведенной на рис. 2. Заполнить электролизер раствором CuSO4, подключить источник питания. Наблюдать изменения, происходящие на электродах и в растворах в обоих коленах электролизера. Запись данных опыта. Зарисовать прибор, записать результаты наблюдений за изменениями, происходящими на электродах и в растворах в обоих коленах электролизера. |
