Теория Бутлирова. План работы Определить предпосылки возникновения теории А. М. Бутлерова
 Скачать 483.67 Kb. Скачать 483.67 Kb.
|
|
Цель исследования – раскрыть основные положения теории химического строения Александра Михайловича Бутлерова. План работы 1. Определить предпосылки возникновения теории А.М. Бутлерова 2. Рассмотреть биографию Александра Михайловича Бутлерова. 3. Изучить основные положения теории строения А.М. Бутлерова. 4. Выявить значение теории А.М. Бутлерова. Введение Алекса́ндр Миха́йлович Бу́тлеров (3 сентября 1828, Чистополь — 5 августа 1886, деревня Бутлеровка, ныне Алексеевский район Татарстана) — русский химик, создатель теории химического строения органических веществ, родоначальник «бутлеровской школы» русских химиков, учёный-пчеловод и лепидоптеролог, общественный деятель, представитель Казанской химической школы, ректор Императорского Казанского университета в 1860—1863 годах. Теория химического строения — теория, описывающая строение органических соединений, т. е. последовательность (порядок) расположения атомов и связей в молекуле, взаимное влияние атомов, а также связь строения с физическими и химическими свойствами веществ. Впервые основные положения Х. с. т. были высказаны А. М. Бутлеровым в докладе "О химическом строении веществ" (съезд немецких естествоиспытателей, г. Шпейер, 1861); он писал: "Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определенным количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу" (Избранные работы по органической химии, 1951, с. 71—72). Впоследствии эти положения были развиты им в ряде статей и книге "Введение к полному изучению органической химии" — первом руководстве по органической химии, в котором весь материал систематизирован с позиций теории химического строения. Созданию теории химического строения предшествовали установление таких важных понятий, как атом и молекула (1-й Международный конгресс химиков, Карлсруэ, 1860), а также постулирование Ф. А. Кекуле и А. С. Купером четырёхвалентности углерода (1857—58). Графические формулы органических соединений, близкие формулам, вытекающим из теории химического строения, были предложены в 1858 Купером. Правильность своей теории Бутлеров подтвердил синтезом ряда органических соединений. Теория химического строения обладала огромной предсказательной способностью в направлении синтеза органических соединений и установлении строения уже известных веществ. Поэтому теория Бутлерова способствовала бурному развитию химической науки, в том числе синтетической органической химии и химической промышленности. Теория химического строения — комплекс тезисов о строении молекул, их характеристик и поведения. Ее создателем является химик Александр Михайлович Бутлеров. С помощью теории описываются валентные состояния и природа атомов, их местоположение в пространстве, распределение плотности электронов и особенности электронной поляризуемости. 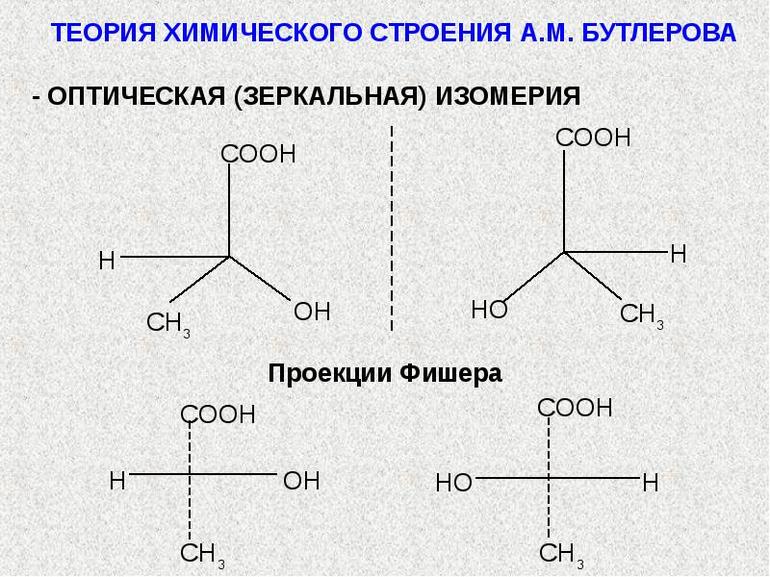 Процесс формирования и развития теории Первые химические опыты Бутлеров проводил во время обучения в пансионе. Он изготавливал бенгальские огни и порох. Во время преподавания в Казанском и Московском университетах Александр Михайлович написал 2 диссертации: «Об окислении органических соединений» и «Об эфирных маслах». В середине 1850-х гг. он участвовал в заседаниях Парижского химического общества и первым синтезировал сахаристое вещество — метиленитана. Это событие стало предпосылкой создания теории Бутлерова.  Во середине XIX столетия Бутлеров занимался изучением явлений валентности и изомерии. В этот исторический период концепции химического строения сложных веществ основывались на исследованиях химика Йенса Берцелиуса. Ученый предполагал, что все химические соединения являются производными воды, аммиака, водорода и иных неорганических веществ. Учение Берцелиуса легло в основу теории радикалов. Александр Михайлович был несогласен с автором этой концепции и считал, что все формулы должны показывать строение химического вещества. В феврале 1858 г. Бутлеров презентовал результаты своих исследований на заседании Парижского химического общества. Во время выступления он кратко озвучил главные положения будущей теории химического строения. Предметом исследования являлось строение органических веществ. Александр Михайлович ввел понятие структуры соединений и предложил классификацию сложных веществ, исходя из их химического строения. Он заявил, что для объяснения разных свойств химических соединений важно выделить особенности их главных элементов — атомов. Вскоре стало понятно, что бутлеровская теория является временной. Она не могла полностью объяснить характеристики и реакционные способности молекул химических веществ. Существует 2 основных направления развития теории Бутлерова: Стереохимия. Она исследует пространственное строение молекул химических соединений. Дисциплины, посвященные электронному строению атомов. Они описывают причины проявления разных химических свойств. Теория Бутлерова стала основой для современных исследований сущности взаимного влияния атомов. Она активно применяется не только в химии, но и в физических дисциплинах (при изучении электронного строения мельчайших частиц). Учения Александра Михайловича использовались при создании первой модели атома физиком Джозефом Томсоном. Главные тезисы теории Основные положения теории Бутлерова:  органические вещества имеют одинаковый качественный и количественный состав, вне зависимости от способа их образования; валентность углерода, входящего в состав органических веществ, равняется 4; существует несколько вариантов соединения атомов в молекуле сложных химических элементов; атомы соединены друг с другом в строгой последовательности; узнать свойство органического соединения можно при помощи его строения (это правило работает и в обратном направлении); атомы, образующие молекулу вещества, взаимно влияют друг на друга (интенсивность влияния зависит от порядка и прочности соединения). На основе этих тезисов было открыто явление изомерии. Вещества, имеющие идентичный состав и разное химическое строение, были названы изомерами. Примеры изомеров: бутан и изобутан. Они имеют идентичный атомный состав и одинаковую молекулярную массу, но обладают отличительными свойствами. Методы изображения строения молекул Для отображения порядка соединения атомов Бутлеров разработал структурную формулу. Связь между мельчайшими частицами изображается в виде черточек. Их количество определяет число общих электронных пар. Валентность углерода равна 4, поэтому он всегда образует 4 связи. С помощью этой формулы было подтверждено существование вторичных и третичных спиртов. По числу углеродных атомов частицы подразделяются на следующие виды: первичные: соседствуют с 1 атомом углерода; вторичные: имеют 2 соседних углеродных атома; третичные: соседствуют с 3 атомами углерода; четвертичные: имеют 4 соседних углеродных атома. Отображение молекул органических веществ осуществляется при помощи брутто-формул. Они представляют собой запись количественного и качественного состава вещества в сокращенном виде. Всем классам органических соединений соответствует общая формула гомологического ряда. Она показывает количественный состав гомологов, отличающихся на 1 группу CH2. Примеры гомологов: этан (С2H6) и пропан (C3H8). Синтез веществ: 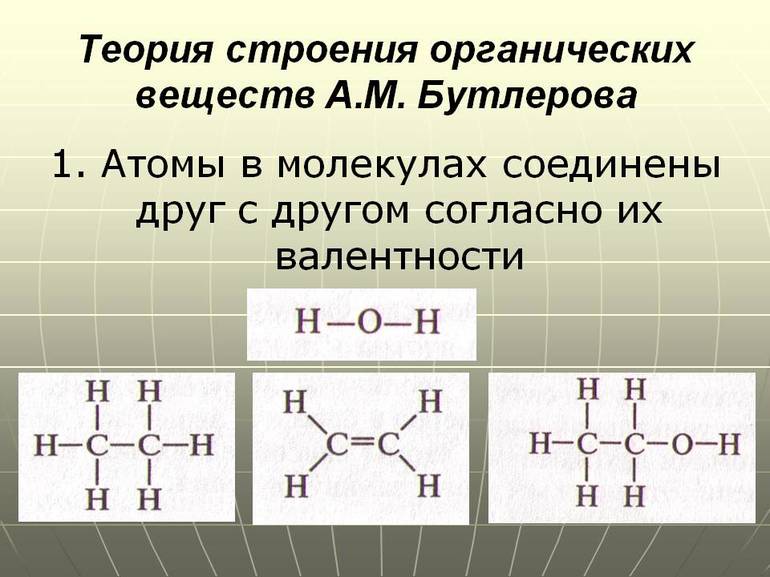 На основе бутлеровской теории производится синтез органических соединений. Ученый доказал, что при помощи контролируемых реакций возможно создать новые вещества. Спустя несколько лет после публикации учения Бутлерова было проведено множество экспериментов. В их результате получилось синтезировать изобутилен, изомеры пентана и соединения, относящие к спиртам. Современные технологии позволяют производить синтез веществ из нескольких сложных элементов, что позволяет улучшить их химические свойства. Для синтезирования применяются металлоорганические соединения, богатые электронами. Они используются при массовом производстве насыщенных углеводородов и сверхтонких волокон. Бутлеровская теория позволила систематизировать знания о веществах и объяснить основные химические явления с точки зрения математической логики. Ученый первым в истории доказал наличие упорядоченной структуры атомов. При помощи использования элементов геометрии и комбинаторики создатель теории химического строения смог разработать классификацию атомных соединений, что позволило ученым выявлять свойства и характер сложных веществ без проведения комплексных исследований. Влияние на науку Теория имеет огромное значение для развития химического моделирования и представления общенаучной картины мира. Она позволила: классифицировать органические соединения по свойствам и строению атомов; использовать формулы для отражения строения молекул и химической связи между атомами сложных веществ; предсказывать свойства неоткрытых элементов и разрабатывать способы их синтеза в лабораторных условиях; изучить явление изомерии и выявить отличия в качественном и количественном составе органических соединений. На основе бутлеровской теории была создана классификация углеводородов, являющихся объектом изучения органической химии. Она включает в себя 8 основных подклассов: 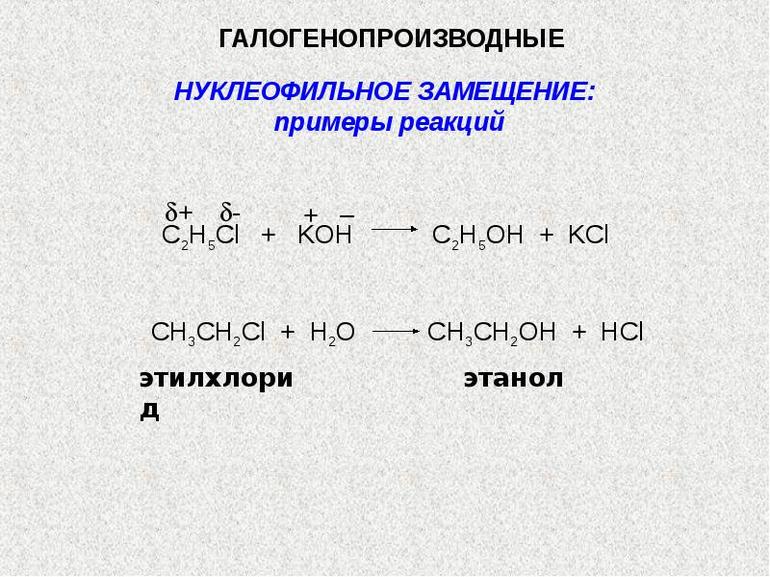 Галогенопроизводные: образованы от галогенов (химических элементов, находящихся в 17 группе периодической системы Д. И. Менделеева). Спирты: включают в себя несколько гидроксильных групп. Простые и сложные эфиры: имеют 2 углеводородных радикала. Являются производными карбоновых кислот. Карбонильные соединения (альдегиды и кетоны): их молекулы содержат карбонильную группу. Карбоновые кислоты: в молекулах содержатся карбоксильные группы. Амины: являются производными аммиака. В их молекулах атомы водорода замещаются углеводородными радикалами. Нитросоединения: в молекулах содержится несколько нитрогрупп, состоящих из азота и кислорода. Сульфокислоты: содержат в себе сульфогруппы, состоящие из серы, кислорода и водорода. Выделяются ароматические, гетероциклические сульфокислоты и алкансульфокислоты. Основные наименования представителей этих групп содержатся в общей номенклатуре ИЮПАК, созданной Международным союзом теоретической и прикладной химии. Переход между классами осуществляется посредством ряда последовательных химических реакций, при этом углеродная основа соединений не изменяется. Это явление называется органическим синтезом и используется во время производства лекарственных препаратов, косметических средств, растительных удобрений, бытовых товаров и топливных жидкостей для транспортных средств. Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них. ЗАКЛЮЧЕНИЕ Формула строения (структурная формула) описывает порядок соединения атомов в молекуле, т.е. ее химическое строение. Различие веществ обусловлено не только разным качественным и количественным элементным составом, но и разным химическим строением, которое можно отразить лишь структурными формулами. В основе изомерии, как показал А.М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов. Таким образом, изомерия - это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства. Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е. химическим строением. Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле. Применение электронной теории строения атома и химической связи в органической химии явилось одним из важнейших этапов развития теории строения органических соединений. Понятие о химическом строении как последовательности связей между атомами (А.М. Бутлеров) электронная теория дополнила представлениями об электронном и пространственном строении и их влиянии на свойства органических соединений. Электрон имеет двойственную природу. В разных экспериментах он может проявлять свойства как частицы, так и волны. Электрон может находиться в любой точке пространства, но с разной вероятностью. Часть пространства, в котором велика вероятность нахождения электрона, называют орбиталью или электронным облаком. Атомная орбиталь - область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома. Для элементов 1-го периода (Н, He) характерна одна АО - 1s. В элементах 2-го периода электроны занимают пять АО на двух энергетических уровнях. Принцип Паули. На одной АО могут находиться не более двух электронов с противоположными спинами. Правило Хунда. На АО с одинаковой энергией, так называемых вырожденных орбиталях, электроны располагаются по одному с параллельными спинами. Атомные орбитали (АО) разных типов отличаются друг от друга формой и энергией и обозначаются символами: s, p, d, f и т.д. Атомные орбитали s-типа имеют форму сферы. р-АО имеют форму объемной восьмерки (гантели), направленной по оси x, y или z. При заполнении атомных орбиталей электронами соблюдаются три основные правила: 1) Принцип устойчивости. АО заполняются электронами в порядке повышения их энергетических уровней Принцип Паули. На одной АО могут находиться не более двух электронов с противоположными спинами. Правило Хунда. На АО с одинаковой энергией, так называемых вырожденных орбиталях, электроны располагаются по одному с параллельными спинами. Также дала возможность предвидеть свойства органических соединений на основании строения, синтезировать новые вещества, придерживаясь плана. Теория химического строения позволила объяснить многие факты, накопившиеся в органической химии в начале второй половины ХIХ в., доказала, что с помощью химических методов (синтеза, разложения и других реакций) можно установить порядок соединения атомов в молекулах. СПИСОК ЛИТЕРАТУРЫ 1. А. М. Бутлеров. 1828-1928. Сб. статей, Л., 1929. 2. Марковников В. В. "Московская речь о Бутлерове", "Труды института истории естествознания и техники", 1956, т. 12, с. 135-81. 3. Быков Г. В. "История классической теории химического строения", М., 1960. 4. Быков Г. В. "Александр Михайлович Бутлеров", М., 1961. 5. "Письма русских химиков к А. М. Бутлерову" в книге: Научное наследство, т. 4, М., 1961. |
