Трансгенные животные. Почти все гены зигот имеют хорошие шансы быть представленными в большинстве соматических клеток организма и принять участие в формировании их генотипа и фенотипа
 Скачать 2.03 Mb. Скачать 2.03 Mb.
|
1 2 ВВЕДЕНИЕ Многоклеточный организм высших животных и растений является продуктом онтогенетического развития, при котором из одной клетки (зиготы), образовавшейся в результате слияния двух половых клеток родителей (гамет), путем большого числа дроблений образуется вся совокупность высокодифференцированных клеток органов и тканей организма. Поскольку любая соматическая клетка или клетка зародышевого пути, в конечном счете, берет свое начало от двух объединившихся родительских клеток, она, как правило, заключает в себе всю (или большую часть) генетическую информацию родительских организмов. Несмотря на то что эта схема является упрощенной и по мере развития дифференцированного состояния соматических клеток их генетический материал часто претерпевает необратимые перестройки (например эритроциты человека вообще лишены ядер), такая картина подчеркивает преемственность генетического материала в рядах клеточных поколений соматических клеток организмов. Почти все гены зигот имеют хорошие шансы быть представленными в большинстве соматических клеток организма и принять участие в формировании их генотипа и фенотипа. Предпосылки такого рода привели к мысли о возможности изменения фенотипа многоклеточных организмов путем введения новых рекомбинантных генов в геном зигот, еще не претерпевших дробления в раннем эмбриональном развитии. В случае объединения с геномом зиготы новые гены должны распространиться в ряду клеточных поколений соматических клеток и экспрессироваться в большинстве этих клеток. Поскольку, с известными ограничениями, весь многоклеточный организм можно рассматривать как клон соматических клеток, произошедших от единственной клетки, распространение рекомбинантных генов, введенных в зиготу, в соматических клетках организма допустимо рассматривать как разновидность молекулярного клонирования последовательностей ДНК. Такой молекулярно-генетический подход к изменению генотипа и фенотипа многоклеточных организмов был реализован экспериментально в середине 1970-х годов. Заражение мышиных эмбрионов на предимплантационной стадии развития вирусом лейкоза мышей (MuLV) приводило к образованию взрослых особей, содержащих вирусную ДНК, интегрированную в геном как соматических клеток, так и клеток зародышевого пути, и эта ДНК передавалась из поколения в поколение. Гены, искусственно введенные в геном многоклеточных организмов и передающиеся от родителей потомству, получили название трансгенов, процесс такого введения и передачи генов обозначили трансгенозом, а животные или растения, содержащие трансгены в геноме своих клеток, стали называть трансгенными. Развитие техники создания трансгенных животных и растений привело к возникновению нового быстро развивающегося направления молекулярной генетики. Были получены уникальные знания об особенностях экспрессии генов и биосинтезе белков в онтогенезе многоклеточных организмов, а также о возможности изменения фенотипа трансгенных организмов, в том числе и коррекции мутантного фенотипа, и использования трансгенных организмов для решения задач биотехнологии, связанных с биосинтезом рекомбинантных белков. Для выведения улучшенных пород домашних животных и птиц (коров с более высокой удойностью, овец с качественной шерстью, кур с более высокой яйценоскостью и т. д.) в основном проводят множество раундов скрещиваний и отбора, каждый раз используя в качестве производителей животных с наилучшими характеристиками. В результате со временем можно получать более или менее чистые линии высокопродуктивных пород животных. Стратегия скрещивания и отбора, требующая больших временных и материальных затрат, оказалась тем не менее исключительно успешной, и сегодня почти все аспекты биологических основ выведения новых пород домашнего скота могут быть к ней сведены. Однако после того как эффективная генетическая линия получена, вводить новые признаки методом скрещивания и отбора становится все труднее. Так, линия с новым «ценным» геном может нести также и «вредные» гены, вследствие чего потомки могут оказаться менее продуктивными. Чтобы быть уверенными в том, что новая, улучшенная линия сохранит исходные полезные признаки и приобретет новые, необходимо разработать абсолютно новую стратегию. Успешные эксперименты по введению чужеродных генов в клетки млекопитающих и возможность создания генетически идентичных животных путем переноса ядра из эмбриональной клетки в яйцеклетку с удаленным ядром (перенос ядра, клонирование) позволили включать в хромосомную ДНК высших животных отдельные функциональные гены или целые их кластеры. Используемая стратегия состоит в следующем. • Клонированный ген вводят в ядро оплодотворенной яйцеклетки. • Инокулированные оплодотворенные яйцеклетки имплантируют в реципиентную женскую особь (поскольку успешное завершение развития эмбриона млекопитающих в иных условиях невозможно). • Отбирают потомков, развившихся из имплантированных яйцеклеток, которые содержат клонированный ген во всех клетках. • Скрещивают животных, которые несут клонированный ген в клетках зародышевой линии, и получают новую генетическую линию. Такой подход имеет много практических приложений. Например, если продукт вводимого гена стимулирует рост, то трансфицированные животные будут расти быстрее при меньшем количестве пищи. Повышение эффективности усвоения пищи всего на несколько процентов может существенно снизить стоимость конечного продукта (говядины, свинины и т. д.). Идея генетического изменения животных путем введения генов в оплодотворенные яйцеклетки была реализована на практике в 1980-х гг. Эксперименты по генетической модификации многоклеточных организмов путем введения в них трансгенов требуют много времени. Тем не менее трансгеноз стал мощным инструментом для исследования молекулярных основ экспрессии генов млекопитающих и их развития, для создания модельных систем, позволяющих изучать болезни человека, а также для генетической модификации клеток молочных желез животных с целью получения с молоком важных для медицины белков. Был даже предложен новый термин «фарминг», относящийся к процессу получения из молока трансгенных домашних животных аутентичных белков человека или фармацевтических препаратов. Использование молока целесообразно потому, что оно образуется в организме животного в большом количестве и его можно надаивать по мере надобности без вреда для животного. Вырабатываемый молочной железой и секретируемый в молоко новый белок не должен при этом оказывать никаких побочных эффектов на нормальные физиологические процессы, протекающие в организме трансгенного животного, и подвергаться посттрансляционным изменениям, которые по крайней мере близки к таковым в клетках человека. Кроме того, его выделение из молока, которое содержит и другие белки, не должно составлять большого труда. Трансгенные мыши: методология Трансгенные технологии разрабатывались и совершенствовались на лабораторных мышах. С начала 1980-х гг. в различные линии мышей были введены сотни генов. Эти исследования в значительной мере способствовали установлению механизмов генной регуляции и развития опухолей, природы иммунологической специфичности, молекулярной генетики роста и развития, других фундаментальных биологических процессов. Трансгенные мыши сыграли свою роль в исследовании возможности крупномасштабного синтеза лекарственных веществ, а также в создании трансгенных линий, позволяющих моделировать различные генетические болезни человека. Введение чужеродной ДНК мышам можно осуществить разными методами: 1) с помощью ретровирусных векторов, инфицирующих клетки эмбриона на ранних стадиях развития перед имплантацией эмбриона в самку-реципиента; 2) микроинъекцией в увеличенное ядро спермия (мужской пронуклеус) оплодотворенной яйцеклетки; 3) введением генетически модифицированных эмбриональных стволовых клеток в предимплантированный эмбрион на ранних стадиях развития. Использование ретровирусных векторов Более простым способом доставки чужеродных генов в геном животного-реципиента является использование векторов на основе вирусов (рис. 1). В этом случае эмбрионы на ранней (восьмиклеточной) стадии развития инкубируют в культуральной среде в присутствии фибробластов, в которых образуются рекомбинантные ретровирусы, и после заражения такими вирусами эмбрионы пересаживают псевдобеременным самкам мышей, где они продолжают свое развитие. Кроме простоты одним из преимуществ данного способа введения ДНК является то, что в геном клеток зародышей интегрируется, как правило, одна копия исследуемого гена, фланкированного длинными концевыми повторами вирусной хромосомы, что может способствовать эффективной экспрессии гена. Однако к недостаткам метода следует отнести необходимость проведения дополнительных генно-инженерных манипуляций при подготовке ретровирусного вектора, ограниченную емкость вектора (размер вставки – до 10 т.п.о.), вследствие чего трансген может оказаться лишенным прилегающих регуляторных последовательностей, необходимых для его экспрессии, и мозаицизм образующихся трансгенных животных, которые состоят из клеток как содержащих, так и не содержащих трансгены. Использование ретровирусных векторов имеет и еще один большой недостаток. Хотя эти векторы создаются так, чтобы они были дефектными по репликации, геном штамма ретровируса (вируса-помощника), который необходим для получения большого количества векторной ДНК, может попасть в то же ядро, что и трансген. Несмотря на все принимаемые меры, ретровирусы-помощники могут реплицироваться в организме трансгенного животного, что совершенно недопустимо, если этих животных предполагается использовать в пищу или как инструмент для получения коммерческого продукта. И поскольку существуют альтернативные методы трансгеноза, ретровирусные векторы редко используются для создания трансгенных животных, имеющих коммерческую ценность. 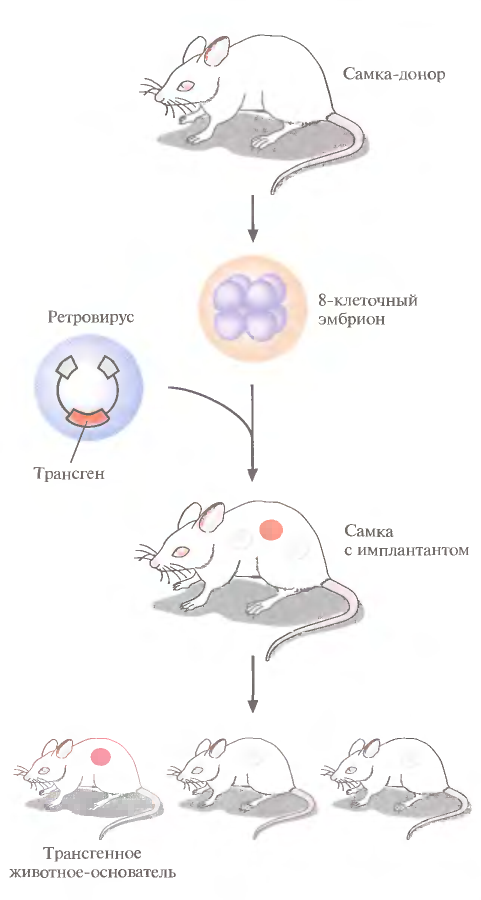 Рис. 1. Получение трансгенных мышей с использованием ретровирусных векторов. Метод микроинъекций ДНК В настоящее время для создания трансгенных мышей чаще всего используют метод микроинъекций ДНК. Он заключается в следуюшем (рис. 2). 1. Увеличение числа яйцеклеток, в которых будет инъецирована чужеродная ДНК, путем стимуляции гиперовуляции у самок-доноров. Сначала самкам вводят сыворотку беременной кобылы, а спустя примерно 48 ч — хорионический гонадотропин человека. В результате гиперовуляции образуется примерно 35 яйцеклеток вместо обычных 5—10. 2. Скрещивание с самцами самок с гиперовуляцией и их умерщвление. Вымывание из яйцеводов оплодотворенных яйцеклеток. 3. Микроинъекция ДНК в оплодотворенные яйцеклетки — как правило, сразу после выделения. Часто вводимая трансгенная конструкция находится в линейной форме и не содержит прокариотических векторных последовательностей. У млекопитающих после проникновения сперматозоида в яйцеклетку ядро спермия (мужской пронуклеус) и ядро яйцеклетки существуют раздельно. После того как последнее заканчивает митотическое деление и становится женским пронуклеусом, может произойти слияние ядер (кариогамия). Мужской пронуклеус обычно гораздо больше женского, его легко локализовать с помощью секционного микроскопа и ввести в него чужеродную ДНК. При этом яйцеклетку на время проведения микроинъекции можно перемещать, ориентировать нужным образом и фиксировать. Опытный экспериментатор за день может инокулиронать несколько сотен яйцеклеток. После введения ДНК от 25 до 40 яйцеклеток имплантируют микрохирургическим путем в «суррогатную» мать, у которой вызывают ложную беременность скрещиванием с вазэктомированным самцом. У мышей спаривание – это единственный известный способ подготовки матки к имплантации. Поскольку вазэктомированный самец сперматозоидов не продуцирует, ни одна из яйцеклеток «суррогатной» матери не оплодотворяется. Эмбрионы развиваются только из введенных яйцеклеток, и мышата рождаются спустя примерно 3 нед после имплантации. Для идентификации трансгенных животных выделяют ДНК из маленького кусочка хвоста и тестируют ее на наличие трансгена с помощью блот-гибридизации по Саузерну методом поли-меразной цепной реакции (ПЦР). Чтобы определить, находится ли трансген в клетках зародышевой линии животного, трансгенную мышь скрещивают с другой мышью. Далее можно проводить скрещивание потомков для получения чистых (гомозиготных) трансгенных линий. Описанный подход кажется на первый взгляд относительно простым, однако он требует четкой координации разных этапов. Даже высококвалифицированному специалисту удается получить жизнеспособных трансгенных животных в лучшем случае лишь из 5% инокулированных яйцеклеток (рис. 3). Ни один из этапов эксперимента не эффективен на все 100%, поэтому для микроинъекций необходимо использовать большое число оплодотворенных яйцеклеток. Например, при получении трансгенных мышей после инъекции ДНК выживают только 66% оплодотворенных яйцеклеток; мышата развиваются примерно из 25% имплантированных яйцеклеток, причем трансгенными из них оказываются лишь 25%. Таким образом, из 1000 имплантированных оплодотворенных яйцеклеток развивается от 30 до 50 трансгенных мышат. Кроме того, введенная ДНК может интегрировать в любое место в геноме, и зачастую множество ее копий включаются в один сайт. И наконец, не все трансгенные мышата будут обладать нужными свойствами. В организме некоторых особей трансген может не экспрессироваться из-за неподходящего окружения сайта интеграции, а в организме других число копий чужеродного гена может оказаться слишком большим, что может привести к гиперпродукции белка и нарушению нормальных физиологических процессов. И все же, несмотря на все это, метод микроинъекций используют для получения линий мышей, несущих функциональные трансгены, довольно часто. 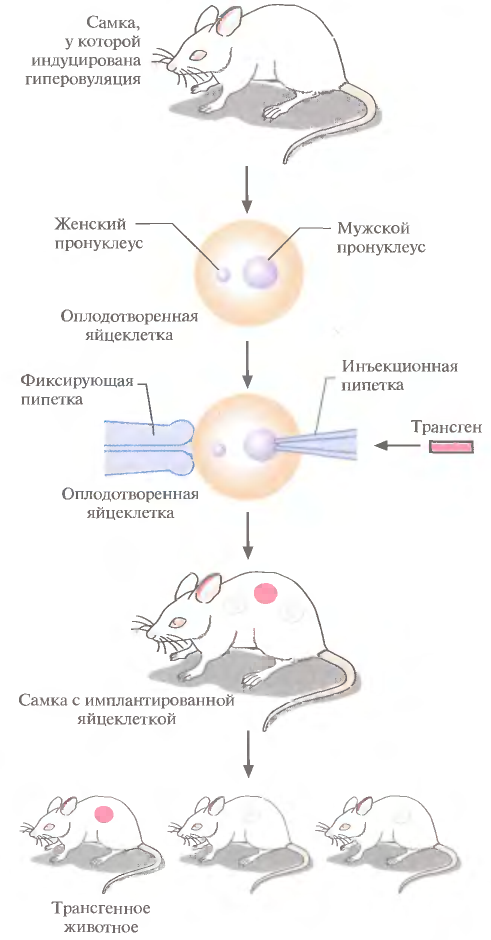 Рис. 2. Получение линий трансгенных мышей методом микроинъекций. 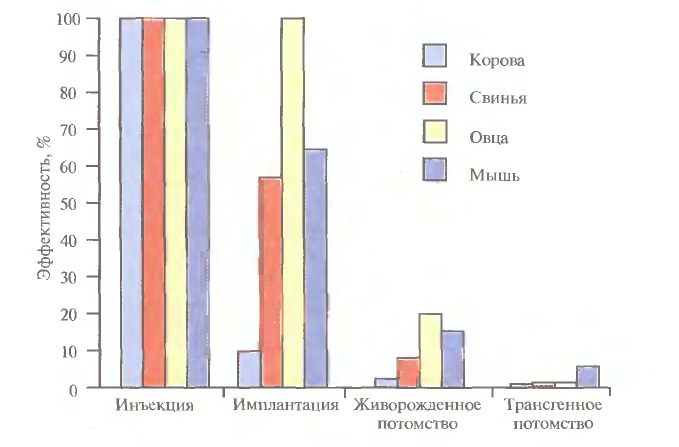 Рис. 3. Суммарная эффективность трансгеноза после микроинъекций. Все оплодотворенные яйцеклетки (100 %) коровы, свиньи, овцы и мыши инокулировали трансгеном, однако успешная имплантация и появление потомства были редкими событиями: трансгенное потомство давали менее 5% обработанных яйцеклеток. Использование модифицированных эмбриональных стволовых клеток Клетки, выделенные из мышиных эмбрионов на стадии бластоцисты, могут пролиферировать в культуре, сохраняя способность к дифференцировке в любые типы клеток, в том числе и в клетки зародышевой линии, при введении в другой эмбрион на стадии бластоцисты. Такие клетки называются плюрипотентными эмбриональными стволовыми клетками (ЕS). ЕS-клетки в культуре легко модифицировать методами генной инженерии без нарушения их плюрипотентности. Например, в определенный сайт несущественного гена в их геноме можно встроить функциональный трансген. Затем можно отобрать измененные клетки, культивировать их и использовать для получения трансгенных животных (рис. 4). Это позволяет избежать случайного встраивания, характерного для метода микроинъекций и ретровирусных векторных систем. Рекомбинантные гены вводят в такие клетки любым из вышеупомянутых способов, а кроме того, электропорацией или другими стандартными методами, применяемыми для доставки генов в культивируемые соматические клетки. При этом вместе с исследуемыми генами возможно введение селектируемых маркеров, которые позволяют проводить отбор клеток, экспрессирующих данные маркеры и, следовательно, гарантированно содержащих сцепленные с ними исследуемые гены. Отобранные таким образом клетки переносят в бластоцисты развивающихся эмбрионов или используют для получения агрегационных химер объединением их с клетками восьмиклеточных эмбрионов с последующей пересадкой эмбрионов псевдобеременным самкам. При трансфекиии ЕS-клеток в культуре вектором, предназначенным для интеграции в специфический хромосомный сайт, в некоторых клетках ДНК встраивается случайным образом, в других встраивание происходит в нужный сайт, в большинстве же ЕS-клеток интеграции вообще не происходит. Для увеличения числа клеток первого типа используют так называемую позитивно-негативную селекцию. Эта стратегия состоит в позитивной селекции клеток, несущих векторную ДНК, встроившуюся в нужный сайт, и негативной селекции клеток с векторной ДНК, интегрировавшей в случайный сайт. Сайт-мишень должен находиться в такой области геномной ДНК, которая не кодирует важных белков, чтобы интеграция чужеродной ДНК не повлияла на процессы развития или клеточные функции. Кроме того, существенно, чтобы встраивание трансгена не блокировало трансляцию соответствующего участка генома. Поиск подобных сайтов ведется непрерывно. Вектор для позитивно-негативной селекции обычно содержит следующие элементы: I) два блока последовательностей (НВ1 и НВ2), гомологичных отдельным участкам сайта-мишени; 2) трансген (ТG), кодирующий новую функцию реципиента; 3) последовательность, кодирующую устойчивость к соединению G-418 (Nеоr); 4) два разных гена тимидинкиназы (tk1 и tk2)вируса простого герпеса типов 1 и 2(HVS-tk1 и HVS-tk2)(рис. 5, А). Ключевым для позитивно-негативной селекции является взаимное расположение этих элементов. Трансген и ген устойчивости к G-418 (Neоr) должны находиться между двумя участками ДНК, гомологичными сайту-мишени, а гены HVS-tk1 и HVS-tk2 - по бокам этой конструкции. Если встраивание происходит в случайный сайт (не в НВ1 и НВ2), то с высокой вероятностью вместе с другими последовательностями интегрируют один или оба гена НVS-tk (рис. 5, А).Напротив, если интеграция происходит в результате гомологичной рекомбинации путем двойного кроссинговера в нужный сайт, то в геном встроятся только трансген и ген Neоr, а гены НVS-tk — нет (рис. 5, Б).При выращивании трансфицированных клеток в присутствии G-418 клетки, не несущие ген Neоr, расти не будут. Выживут только клетки, в которых произошла интеграция - иными словами, осуществляется позитивная селекция. Если одновременно с G-418 в среду добавить ганцикловир, то рост клеток, синтезирующих тимидинкиназу, будет подавлен, поскольку этот фермент катализирует превращение ганцикловира в токсичное соединение, летальное для клетки, т. е. произойдет негативная селекция. Клетки, прошедшие через такое двойное сито, скорее всего будут содержать последовательность, встроившуюся в нужный сайт. Хоть этот метод не застрахован от ошибок, он позволяет обогатить клеточную популяцию клетками, несущими трансген в специфичном хромосомном сайте. Электропорация Этот метод основан на способности клеточной мембраны, становиться проницаемой для экзогенных молекул ДНК под действием импульсов высокого напряжения. Когда различия в потенциалах на внешней и внутренней поверхности мембраны превысят определенный уровень, формируются временные поры, через которые способны проходить экзогенные молекулы. Изменение количества пор в мембране обратимо при условии, что величина или продолжительность импульсов высокого напряжения не превысит критического предела. Размер пор зависит от длины импульсов, силы электрического поля, а также ионного состава среды. 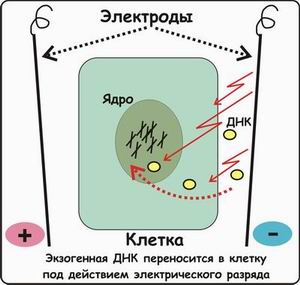 Электропорация. Электропорация была проведена, например, для эмбрионов креветки и моллюсков. Недостатком использования электропорации является постепенная деградация и уменьшение экспрессии трансгена со временем. Биобаллистическая трансформация Суть метода биобаллистической трансформации заключается в том, что на мельчайшие частички вольфрама, платины или золота, диаметром от 0,1 до 3,5 мкм, напыляется векторная ДНК, содержащая необходимую для трансформации генную конструкцию. Вольфрамовые, платиновые или золотые частички, несущие ДНК, на целлофановой подложке помещаются внутрь биобаллистической пушки. Суспензия животных клеток или эмбрионов, на ранней стадии развития, помещается под биобаллистическую пушку на расстоянии 10-25 см. В пушке вакуумным насосом уменьшается давление до 0,1 атм. В момент сбрасывания давления частички металла с огромной скоростью выбрасываются из пушки и, пробивая мембраны, входят в цитоплазму и ядра клеток. Обычно клетки, располагающиеся непосредственно по центру, погибают из-за огромного количества и давления частичек металла, в то время как в зоне 0,6-1 см от центра будут находиться трансформированные клетки (Рис.3). Далее клетки или эмбрионы животных переносят на среду для дальнейшего культивирования и регенерации. Бомбардировка микрочастицами была использована, например, для трансформации оплодотворенных яйцеклеток креветки, морского ежа. Процент выживших клеток после бомбардировки составляет приблизительно 70%, а также была доказана экспрессия трансгена у некоторых разновидностей рыб. Главным преимуществом данного метода является высокая эффективность встройки векторной ДНК, а также то, что можно получить трансгенные клетки в самые кратчайшие сроки. 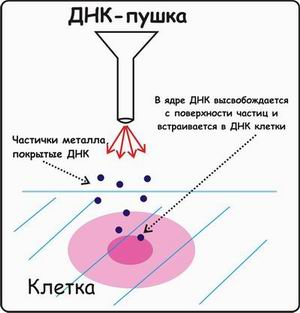 Биобаллистическая трансформация. Существенным недостатком этого метода является то, что эмбрионы, подвергшиеся бомбардировке, довольно редко развиваются в полноценных взрослых особей, большая часть из них рано или поздно гибнет. Липофекция Липосомы - это сферические образования, оболочки которых состоят из фосфолипидов. Их можно получить в результате резкого встряхивания или обработки ультразвуком водных эмульсий фосфолипидов. Метод липофекции основан на взаимодействии между положительно заряженными молекулами фосфолипидов, из которых состоят липосомы, и отрицательно заряженными молекулами ДНК. В настоящее время предложены три модели ассоциаций между ДНК и фосфолипидами . Суть первой модели состоит в том, что положительно заряженные липосомы присоединяются к отрицательно заряженным молекулам ДНК. Число липосом, присоединившихся к ДНК, зависит от размеров молекулы нуклеиновой кислоты. Во втором случае молекулы ДНК "проглатываются" липосомами, то есть ДНК электростатически взаимодействует с внутренней поверхностью липосомы. В третьем случае молекула ДНК окружена несколькими молекулами фосфолипидов, которые формируют своеобразную ленту с нуклеиновой кислотой. 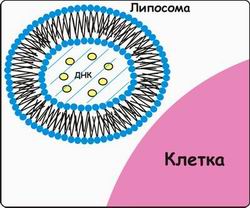 Липофекция (2-я модель). Липосомы, несущие положительный заряд, легко присоединяются к несущей отрицательный заряд плазматической мембране животных клеток, после чего путем эндоцитоза проникают в цитоплазму клеток. Механизмы же, обеспечивающие встраивание в геном и экспрессию ДНК, не достаточно изучены. К преимуществам данного метода можно отнести низкую токсичность липосом по отношению к клеткам, а также то, что экзогенный генетический материал защищен от действия нуклеаз посредством транспортировки в липосомах. Недостатком данного метода является то, что количество личинок, экспрессирующих трансген сокращается с возрастом. Более простой способ идентификации ЕS-клеток, несущих трансген в нужном сайте, основан на использовании ПЦР. В этом случае ДНК-вектор содержит два участка, гомологичных сайту-мишени, по одному со стороны трансгена и со стороны клонированной бактериальной или синтетической (уникальной) последовательности, отсутствующей в геноме мыши (рис. 6). После трансфекции ЕS-клеток этим вектором проводят скрининг трансфицированных клеток методом ПЦР. Один из ПЦР-праймеров (Р1) комплементарен участку клонированной бактериальной или синтетической (уникальной) нуклеотидной последовательности интегрировавшего вектора, а второй (Р2) — участку хромосомной ДНК, прилегающему к одному из гомологичных участков ДНК. При встраивании последовательности-мишени в случайный сайт ожидаемый продукт амплификации образовываться не будет (рис. 6, А),а при сайт-специфической интеграции в результате ПЦР-амплификации образуется фрагмент ДНК известного размера (рис. 6, Б),Таким образом можно идентифицировать пулы ЕS-клеток, содержащих трансген в нужном сайте, а пересевая клетки из этих пулов — получить клеточные линии с сайт-специфической вставкой. ЕS-клетки, в геном которых в нужном сайте встроен трансген, можно культивировать и ввести в эмбрион на стадии бластоцисты, а затем имплантировать такие эмбрионы в матку псевдобеременных «суррогатных» матерей. Мышата, у которых генетически модифицированные ЕS-клетки участвовали в образовании клеток зародышевой линии, могут дать начало трансгенным линиям. Для этого их нужно скрестить с особями той же линии, а затем скрестить их трансгенных потомков. В результате будут получены трансгенные мыши, гомозиготные по трансгену. В специфический хромосомный сайт ЕS-клеток можно не только встроить трансген, кодирующий какую-то новую функцию, но и направленно разрушить этот сайт интеграцией с его кодирующей областью специфической последовательности (обычно селективного маркерного гена) (рис. 7). Одна из задач направленного нарушения («нокаута») гена состоит в исследовании влияния этого процесса на развитие организма и протекающие в нем физиологические процессы. Кроме того, есть надежда, что трансгенных животных с нарушением в определенном гене можно использовать как модель для изучения болезней человека на молекулярном уровне. Например, направленный «нокаут» гена родопсина мыши приводит к инактивации палочек сетчатки, что имитирует такую болезнь человека, как пигментный ретинит. На мышах с «нокаутированным» геном родопсина можно изучать процесс дегенерации сетчатки, а также терапевтический эффект лекарственных средств, замедляющих или вообще останавливающих генетически обусловленный патологический процесс. Уже создано более 250 линий мышей с «нокаутированными» генами, используюшихся в качестве моделей для изучения различных заболеваний человека. В принципе подходы к созданию трансгенных животных с «улучшенными функциями» и с «потерей функций» сходны. К сожалению, плюрипотентные ЕS-клетки, аналогичные таковым у мышей, пока не обнаружены у крупного рогатого скота, овей, свиней и цыплят, но их поиск продолжается. 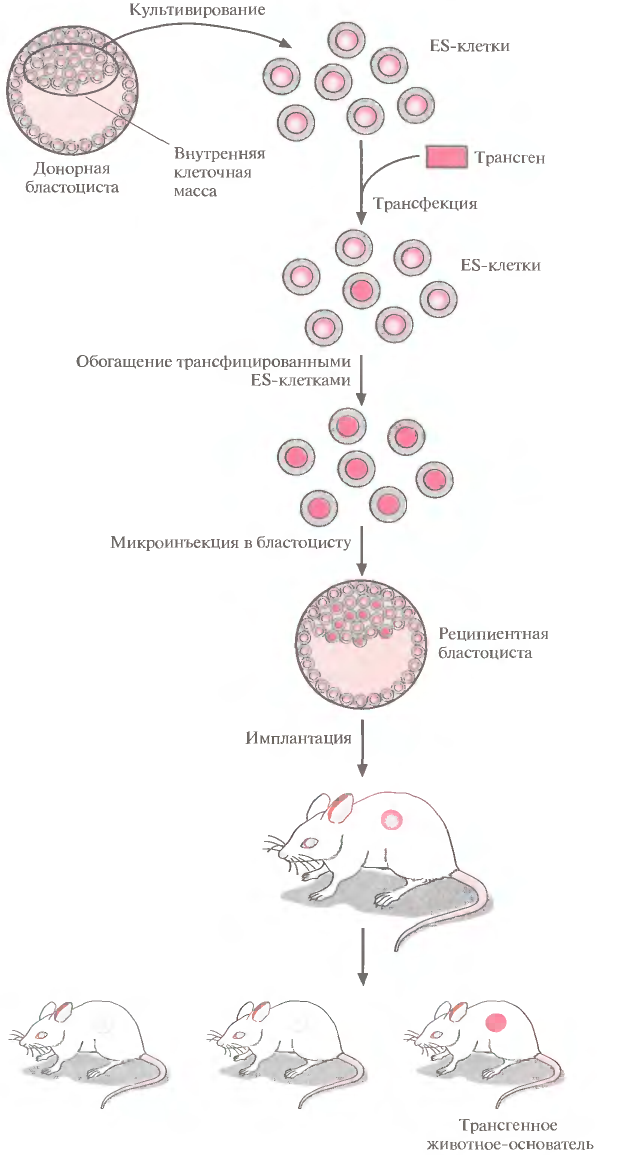 Рис. 4. Получение трансгенных мышей с помощью генетической модификации эмбриональных стволовых клеток. 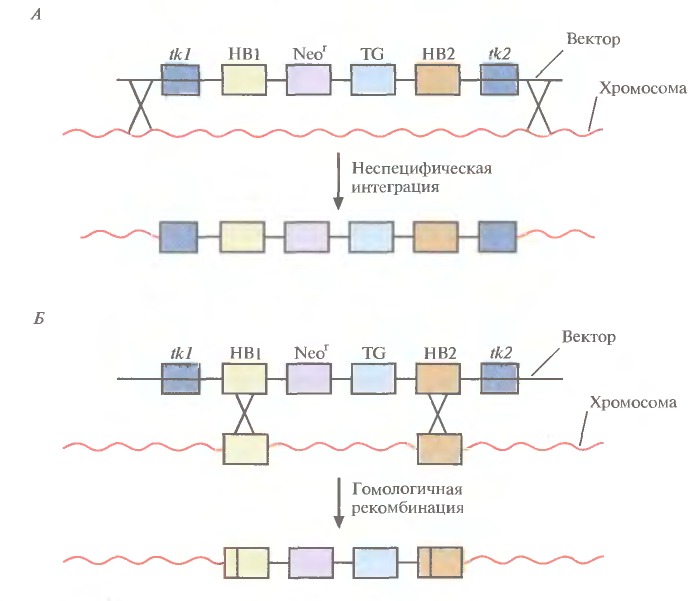 Рис. 5. Позитивно-негативная селекция. А. Неспецифическая интеграция. В хромосому встроились оба гена тимидинкиназы (tk1 и tk2), два участка ДНК, гомологичные специфичным последовательностям хромосомной ДНК реципиентных клеток (НВ1 и НВ2), ген (Neor), обеспечивающий устойчивость к цитотоксическому соединению G-418, и трансген (ТG). После трансфекции проводят тестирование клеток на устойчивость к G-418 и ганцикловиру, который становится цититоксичным для клеток, синтезирующих тимидинкиназу. Интеграция может произойти и по-другому, со встраиванием в хромосому только гена тимидинкиназы. В присутствии G-418 и ганцикловира все такие клетки тоже погибают. Б. Специфическая интеграция с помощью гомологичной рекомбинации. В результате двойного кроссинговера между гомологичными участками (НВ1 и HB2) векторной и хромосомной ДНК в последнюю встраивается фрагмент, не содержащий генов тимидинкиназы (tk1 и tk2). В присутствии G-418 и ганцикловира выживают только клетки, в которых прошла гомологичная рекомбинация. 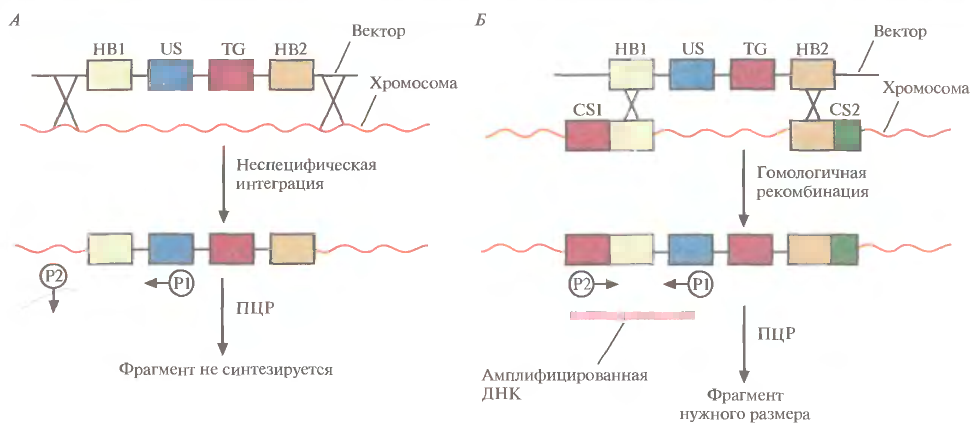 Рис. 6. Идентификация клеток, несущих трансген в специфическом сайте, при помощи ПЦР. А. В результате неспецифического встраивания векторной ДНК один из праймеров (Р2) не сможет гибридизоваться с участком хромосомы, находящимся на определенном расстоянии от места отжига праймера Р1, и фрагмента нужного размера при амплификации не образуется. Р1 гибридизуется с уникальным участком (US) встроенной ДНК, отсутствующим в хромосомной ДНК клетки-реципнента. Б. В результате гомологичной рекомбинации между участками НВ1 и НВ2 встраиваемой ДНК, с одной стороны, и комплементарными участками хромосомы СS1 и СS2, с другой, образуются участки, с которыми могут гибридизоваться оба праймера, Р1 и Р2, и которые находятся на определенном расстоянии друг от друга. В ходе ПЦР-амплификации синтезируются фрагменты одного размера, которые можно идентифицировать при помощи гель-электрофореза. Если ПЦР-продукт нужной длины образовался, значит трансген (ТG), находящийся между гомологичными участками (НВ1 и НВ2), встроился в определенный сайт хромосомы. 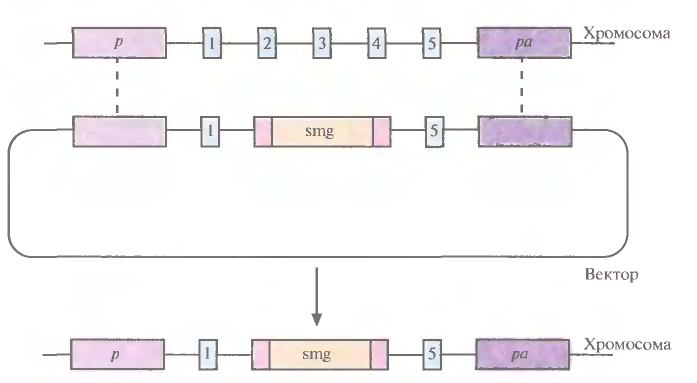 Рис. 7. «Нокаут» гена с помощью направленной гомологичной рекомбинации. Вектор несет селективный маркерный ген (smg) и фланкирующие его последовательности, гомологичные соответствующим участкам гена-мишени. Последний содержит пять экзонов (1 – 5). В результате гомологичной рекомбинации (штриховые линии) ген-мишень прерывается («нокаутируется»). Клонирование с помощью переноса ядра Плюрипотентность можно выявить, если перенести ядро тестируемой клетки в яйцеклетку с удаленным ядром и затем исследовать способность последней к развитию и образованию жизнеспособного потомства. В нескольких лабораториях с переменным успехом исследовали плюрипотентность линий эмбриональных клеток, клеток плода и взрослой особи. Было показано, что ядра эмбриональных клеток способны - хотя и с низкой эффективностью — обеспечивать развитие. Например, с помощью переноса ядер эмбриональных клеток крупного рогатого скота, культивированных непродолжительное время, были получены жизнеспособные особи. Всем известная овца по имени Долли была клонирована с помощью переноса ядра клетки молочной железы (вымени) взрослого животного (рис. 8). Так впервые была доказана плюрипотентность ядра дифференцированной взрослой клетки. Впрочем, нельзя исключить, что на самом деле донорское ядро было взято из недифференцированной клетки, присутствовавшей в эпителии молочной железы организма-донора. Клонирование Долли из ядра дифференцированной клетки и трех других овец из ядер эмбриональных клеток удалось осуществить благодаря переносу ядер из клеток, находящихся в стадии покоя (G0), и, возможно, особенностям эмбриогенеза этого животного. Дело в том, что в течение первых трех делений зиготы овцы, занимающих несколько суток, происходит только репликация ДНК, ни один из генов не экспрессируется. Предполагается, что за это время введенная ДНК освобождается от специфичных для клетки регуляторных белков, а соответствующие гены эмбрионального развития связываются с инициаторными эмбриональными белковыми факторами из цитоплазмы яйцеклетки. Основная проблема, которую нужно решить для того, чтобы создание трансгенных животных с помощью метода переноса ядер стало реальным, — это сохранение плюрипотентности клеток в непрерывной культуре. Если это удастся, то генетическое изменение таких клеток и создание трансгенных организмов станет почти рутинной процедурой. Однако вследствие видовых различий во времени процесса деления клетки на ранних стадиях эмбриогенеза и инициации транскрипции в этот период пока не ясно, удастся ли осуществить перенос ядра в случае каких-либо других домашних животных, кроме овец, если донорское ядро будет находится на той же стадии, что и яйцеклетка. 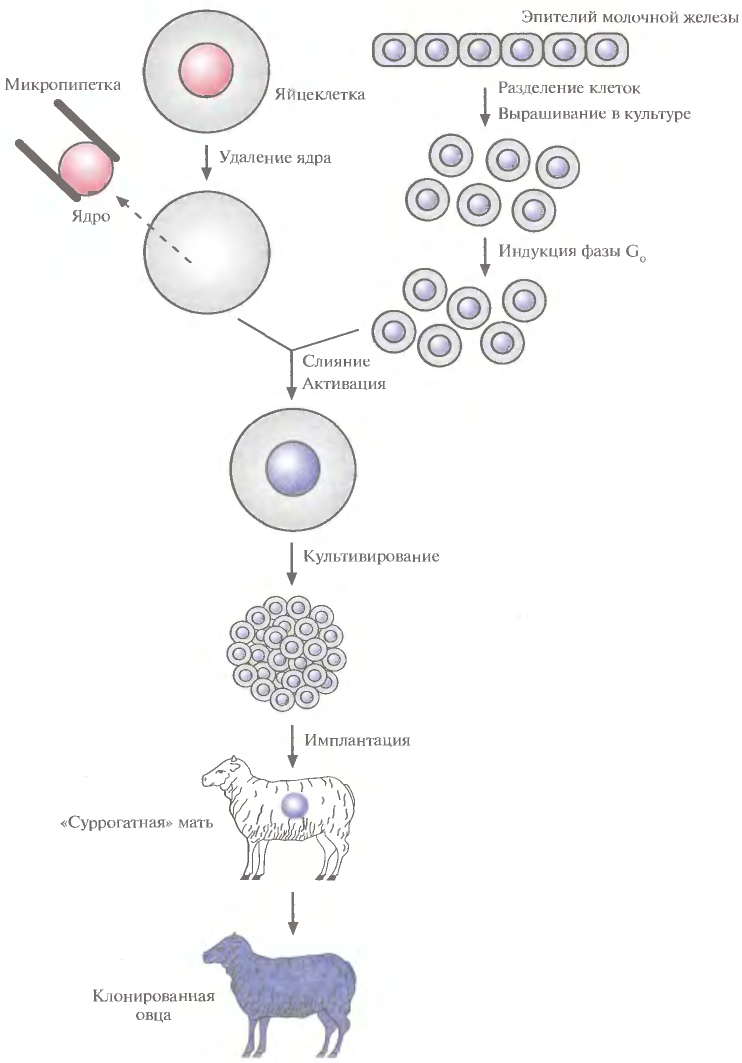 Рис. 8. Клонирование овцы методом переноса ядра. Ядро яйцеклетки удаляют с помощью микропипетки. Культивируют эпителиальные клетки молочной железы взрослой особи и индуцируют их переход в фазу Gо. Осуществляют слияние клетки в Go-фазе и яйцеклеток, лишенных ядра, и выращивают восстановленные яйцеклетки в культуре или в яйцеводе с наложенной лигатурой до ранних стадий эмбриогенеза, а затем имплантируют их в матку «суррогатной» матери, где и происходит дальнейшее развитие. В эксперименте, описанном Уилмутом и др., было проведено слияние 277 яйцеклеток с удаленными ядрами с клетками молочной железы в фазе Gо; из 29 эмбрионов только один развился до жизнеспособного плода. Перенос генов с помощью искусственных дрожжевых хромосом Хромосомы высших организмов содержат в своем составе протяженные молекулы ДНК. Например, длина ДНК одной из типичных хромосом человека составляет 100–200 миллионов пар оснований (м.п.о.). Исследование генов в хромосомах высших растений, животных и человека потребовало создания векторов для клонирования фрагментов ДНК длиной в несколько сотен тысяч пар оснований. Этим задачам отвечает недавно созданная система для клонирования сверхдлинных молекул ДНК на основе искусственно полученной мини-хромосомы дрожжей YAC (yeast artificial chromosome). YAC-вектор представляет собой кольцевую молекулу ДНК, содержащую ряд генетических элементов, которые позволяют ей существовать во внехромосомном состоянии в клетках дрожжей (рис. 9). Вектор заключает в себе две теломерные последовательности нуклеотидов TEL, необходимые для репликации концов мини-хромосомы, и область начала репликации ARS1, соединенную с последовательностью центромеры. Все эти функциональные элементы требуются для репликации YAC-вектора и его правильной передачи в дочерние ядра во время митоза. Кроме того, вектор содержит два селектируемых маркера TRP, восстанавливающих способность к росту ауксотрофных по триптофану клеток дрожжей в отсутствие экзогенного триптофана, а также маркер URA3, компенсирующий генетический дефект клеток дрожжей, который нарушает биосинтез урацила. В векторе имеется также ген супрессорной тРНК sup4, являющийся селектируемым маркером для поддержания вектора в мутантных бактериальных клетках, содержащих амбер-мутации в жизненно важных генах. Помимо этого, он обладает последовательностями нуклеотидов, необходимыми для его репликации в бактериальных клетках. При подготовке к клонированию YAC-вектор, выделенный в виде плазмиды, расщепляют рестриктазой BamHI и отделяют от образовавшегося короткого фрагмента ДНК, который не требуется для репликации YAC-вектора в дрожжах (этап 1). После этого проводят второе расщепление вектора рестриктазой EcoRI, сопровождающееся образованием двух его "плеч", каждое из которых на одном из концов содержит теломерные последовательности хромосомы дрожжей (этап 2). На заключительном этапе (3) полученные "плечи" лигируют с крупными EcoRI-фрагментами клонируемой ДНК, которые получают путем частичного расщепления высокомолекулярной хромосомной ДНК, предназначенной для клонирования. Полученными таким образом рекомбинантными ДНК трансформируют протопласты клеток дрожжей, и образовавшиеся трансформанты отбирают на селективной твердой питательной среде. В таком векторе удавалось осуществлять клонирование фрагментов ДНК длиной до 700 т.п.о. При всех своих достоинствах системы клонирования, основанные на векторах семейства YAC, обладают рядом существенных недостатков. В рекомбинантных ДНК, поддерживаемых в таких системах, часто возникают внутренние делеции. Кроме того, при введении рекомбинантных ДНК в клетки дрожжей иногда имеет место проникновение в одну клетку нескольких молекул вектора со вставками. В итоге отдельные клоны дрожжевых клеток могут содержать несколько несцепленных друг с другом молекул рекомбинантных ДНК, а рекомбинация между ними вообще может приводить к образованию химерных молекул. Все это очень затрудняет физическое картирование генов в хромосомах исследуемых объектов. 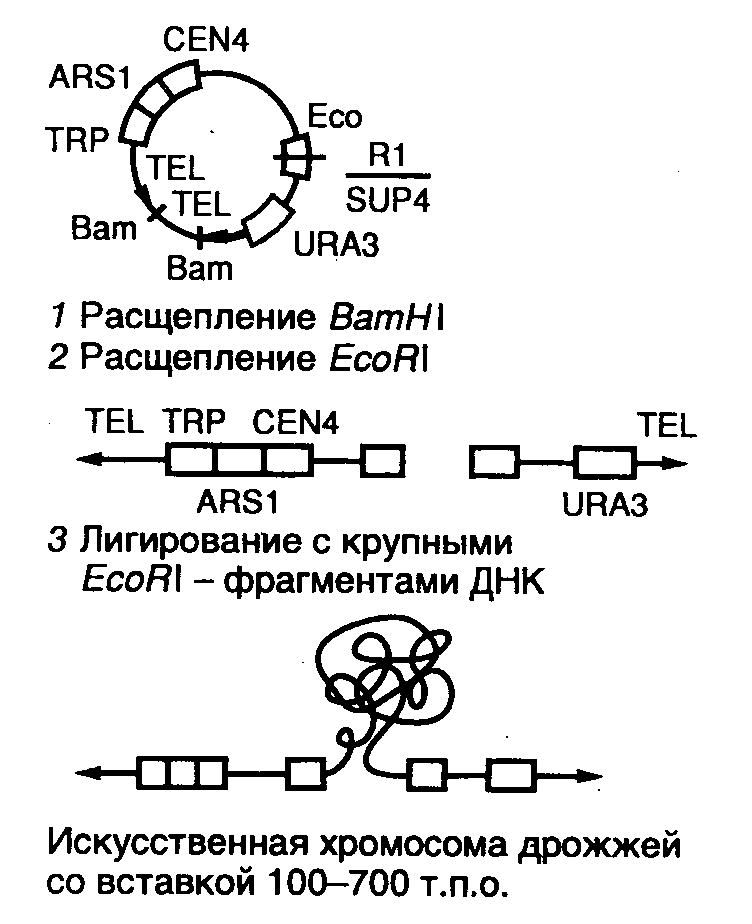 Рис. 9. Схема клонирования сверхдлинных молекул ДНК с использованием вектора YAC 1 – линеаризация ДНК вектора рестриктазой BamHI; 2 – расщепление линеаризованной ДНК вектора рестриктазой EcoRI с образованием "плечей"; 3 – введение в вектор клонируемого EcoRI-фрагмента ДНК Трансгенных мышей получали микроинъекцией в пронуклеус оплодотворенной яйцеклетки или трансфекцией ЕS-клеток с помощью YАС, несущих несколько родственных генов или один большой ген. Трансгенные мыши, несущие кластер из пяти функциональных генов β-глобина человека суммарной длиной примерно 250 т. п. н., экспрессировали все эти гены тканеспецифично и в нужное время — точно так же, как это происходит у человека. Такое соответствие обеспечивалось фланкирующими их последовательностями, которые содержат промотор и другие важные регуляторные элементы. Создание мышей, которые синтезировали бы только человеческие антитела, — это примечательный пример трансгеноза с помощью YАС. Моноклональные антитела можно использовать для лечения некоторых заболеваний человека. Однако получить человеческие моноклональные антитела практически невозможно. К сожалению, и моноклональные антитела грызунов иммуногенны для человека. Чтобы «очеловечить» существующие моноклональные антитела грызунов, были разработаны сложные стратегии с использованием рекомбинантных ДНК. В результате этих трудоемких процедур удалось получить Fv- и Fab-фрагменты, зачастую обладающие каким-то сродством к специфическому антигену. Возможно, технологического прорыва удастся достичь, если использовать для получения полноразмерных человеческих антител более доступный метод с использованием гибридом. Синтез природных антител — это настоящее чудо. Антитело — очень сложная тетрамерная конструкция, состоящая из двух пар разных цепей. Одна из них называется тяжелой (Н), а другая - легкой (λили κ). Эти термины отражают различия в молекулярных массах субъединиц антитела. Генетические особенности каждой тяжелой цепи определяются комбинацией вариабельного (VH), дивергентного (DH), шарнирного (JH) и константного (СH) участков (доменов) соматической ДНК в В-клетке. Известны два типа легких цепей, λ и κ, которые образуются в результате перестройки их собственных вариабельных (Vλ, Vκ, шарнирных (Jλ,Jκ) и константных (Сλ, Сκ) доменов. Данная В-клетка синтезирует один вид антител, с уникальной комбинацией участков, составляющих Н-цепь, и либо перестроенной λ-,либо κ-цепью. Набор генетических элементов, обеспечивающих образование множества разных Н-цепей антител человека, включает около 95 VH-доменов, 30 DH-доменов, 6 JH-доменов и 5 основных константных (Сα, Сγ, Сδ, Сε, Сμ) доменов. Локус κ-генов содержит примерно 76 Vκ-доменов, 5 Jκ-доменов и один константный (Сκ) участок. Размер Н-локусов и κ-генов — от 1 до1,5 т. п. н. Для создания трансгенных мышей, способных синтезировать множество различных человеческих антител, необходимо инактивировать мышиные гены Н- и L-цепей, а затем встроить в хромосомную ДНК мыши YАС, содержащую гены Н- и L-цепей каждого человеческого гена иммуноглобулина. Чтобы решить эту задачу, мышиные гены Н- и κ-цепей были заменены («нокаутированы») небольшим участком кластера генов Н-цепи человека и кластера генов κ-цепи человека. Трансгенные мыши с таким набором генов антител человека синтезировали человеческие антитела к некоторым антигенам; кроме того, были созданы гибридомы, продуцирующие человеческие моноклональные антитела. Однако разнообразие человеческих антител, продуцируемых такими трансгенными мышами, было невелико вследствие ограниченности набора вариабельных сегментов Н- и κ-цепей. Чтобы решить эту проблему, создали YАС с большим числом генов вариабельных участков Н- и κ-цепей гемоглобина человека. Объединив четыре разные YАС с генами Н-цепей гемоглобина человека, создали YАС длиной 1000 т. п. н., несущую 66 VH-доменов, около 30 DH-сегментов, 6 JH-доменов, Сμ, Сδ и Сγ. Аналогично, из трех YАС, несущих различные домены Vκ, создали YАС длиной 800 т. п. н. с 32 Vκ-доменами, 5 Jκ-доменами и Сκ. ЕS-клетки трансфицировали по отдельности YАС с генами Н- и κ-цепей методом слияния клеток, отобрали клетки, в которых произошла интеграция YАС, с помощью селективного маркера и проверили целостность каждой вставки методом ПЦР. Инъецировали клетки, несущие встроенные гены Н- либо κ-цепи, в бластоцисты и идентифицировали особь-основателя с помощью ПЦР. Трансгенных мышей со вставками генов Н- и κ-цепей скрещивали по отдельности с мышами с инактивированными локусами этих цепей. Затем потомство скрещивали между собой, чтобы получить мышей, лишенных функциональных мышиных генов Н- и κ-цепей, но несущих обе вставки генов Н- и κ-цепей гемоглобина человека. Трансгенные мыши с увеличенным числом человеческих VH- и Vκ-доменов синтезировали человеческие антитела. Их иммунизировали тремя разными антигенами, и в каждом случае гибридомы секретировали человеческие моноклональные антитела, обладающие высоким сродством к антигену, которым животные были иммунизированы. Весьма вероятно, что с помощью такой трансгенной системы удастся получать человеческие моноклональные антитела для использования их в медицине. 1 2 |
