Получение биологически активных веществ с помощью культуры клеток растений
 Скачать 276.5 Kb. Скачать 276.5 Kb.
|
|
ПОЛУЧЕНИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ С ПОМОЩЬЮ КУЛЬТУРЫ КЛЕТОК РАСТЕНИЙ Лекарственные растения играют значительную роль в фармацевтической промышленности. Известно около 20000 веществ, которые получаются только из растений, возникает проблема сохранения растений. И тут на помощь приходит биотехнология. Культуры клеток высших растений используются: 1) как модель при изучении регуляции метаболизма в клетках и тканях целого растения; 2) для получения биологически активных веществ • получение уже известных веществ, присущих интактному растению (никотин, кодеин, хинин, диосгенин, сапонины); • синтез новых продуктов из трудно выращиваемых растений (коробочки мака снотворного используют как источники получения морфина, но в культуре клеток этого растения образуется алкалоид сангвинарин, усиливающий перистальтику кишечника и повышающий секрецию слюны. Другой пример – кора хинного дерева содержит алкалоиды, обладающие антипротозойным действием, но в культуре клеток этого растения накапливаются антрахиноны); • использование культуры клеток как мультиферментных систем для биотрансформации химических веществ. 3) для получения безвирусных растений(с помощью микроклонального размножения) 4) клеточная инженерия и селекция (получение новых форм и сортов растений, перенос «чужих» генов в растительные клетки и получение трансгенных растений) – с 1980-х годов. Пример: перенос гена гиосциамин-6-b-гидроксилазы из белены (Hyoscyamus niger L.) в растения красавки (Atropa belladonna L.) превратил продуцент атропина в продуцент скополамина). Этот фермент катализирует реакцию превращения рацематной смеси алкалоидов гиосциамина (атропин) в 6-b-оксигиосциамин с последующей его 6,7-эпоксидацией в скополамин. Преимущества получения БАВ с помощью культуры клеток: стандартность накапливаемого сырья; независимость от влияния климатических, сезонных и географических условий; стабильность выпуска продукции в течение года; устраняется проблема истощения почв; 4) получение фитомассы, полностью свободной от гербицидов, тяжелых металлов и др.; 5) возможность промышленного производства экзотических и малодоступных растений. 6) более высокий выход вторичных метаболитов Промышленный способ выращивания изолированных культур дает возможность за короткий срок 30-45 суток получать значительный объем ценного лекарственного сырья. Можно привести пример такого известного растения, по преданиям способного продлить жизнь и молодость, как женьшень (Panax). Из его корня выделяют комплекс тритерпеновых сапонинов (панаксозиды), которые обладают адаптогенным (повышают неспецифическую сопротивляемость организма к вредным воздействиям) и общетонизирующим действием [9]. Запасы дикорастущего женьшеня малы, для него характерны очень медленные рост и развитие. Годовой прирост корня дикорастущего растения составляет в среднем 1 г. В условиях выращивания женьшеня на плантациях сбор рекомендуется производить только на шестом году его произрастания (к этому времени накапливается достаточно БАВ), при этом «корень жизни» сильно истощает почву, и повторно его можно высаживать не ранее чем через 10 лет. А в культуре клеток растительной ткани панаксозиды можно извлекать в достаточном количестве уже на 15-25-тый день роста. В качестве дополнительного бонуса – по токсичности препараты, получаемые из каллусного сырья, менее опасны. Что такое культура клеток растений? Если очень упрощенно – представьте, что вы взяли несколько растительных клеток и поместили на питательную среду, по аналогии с тем как микробиологи выращивают бактерии. Как будет выглядеть полученное нами «растение в пробирке»? Отличается ли его внешний вид от обычного (интактного) растения? Чаще всего – да. Сравните следующие две фотографии. На обеих – табак обыкновенный, интактное растение (рис. 1) и каллусная культура (рис. 2).  Рисунок 1. Табак обыкновенный  Рисунок 2. Каллусная культура табака обыкновенного Краткая историческая справка Работы по изолированию культур, когда зародыши вычленялись из семени и выращивались в искусственных условиях, принадлежат Блоцишевскому (1876), Брауну и Моррису (1892), Боннэ и Саксу (1893). Первые попытки культивировать изолированные клетки и ткани растений были предприняты в конце XIXв немецкими учеными (Хаберландтом, Фехтингом, Рехингером). Они пытались выращивать кусочки тканей растений, помещая их на влажную поверхность фильтра в растворе сахарозы. Пытались выращивать ткани растений, использую растительные соки и экстракты (т.е. питательные среды природного происхождения). Первые опыты были неудачными, т.к. транспорт и метаболизм питательных веществ у целого растения и изолированных клеток существенно отличается. Хаберланд выдвинул гипотезу о тотипотентности, которая впоследствии была подтверждена экспериментально. Тотипотентность (от лат. totus – весь, целый, potentia – сила, возможность) – это способность клетки путём деления дать начало любому клеточному типу организма. Теоретически любая живая растительная клетка потенциально способна развиваться в организм, из которого была изолирована и культивировалась в определенных условиях. Впервые каллусная культура была получена в 1902 году Хаберландом. Он научился культивировать отдельные клетки в течение некоторого времени. Но он выбрал для экспериментов зеленые фотосинтезирующие клетки (высокодифференцированные, он считал, что содержащие хлорофилл клетки полностью обеспечивают себя питательными веществами, необходимыми для роста и жизнедеятельности, но ошибся). Далее начался поиск адекватных питательных смесей и условий, необходимых для культивирования растительных клеток. Только в начале XX в ученые стали использовать синтетические сбалансированные среды. Основа – среды, используемые для выращивания целых растений. Уайт и Готре в 30-х гг ХХ в показали, что изолированные органы и ткани могут расти в культуре неограниченно долгое время, если их пересаживать на свежую питательную среду через каждые 4-6 недель (пассирование). Такую же способность наблюдал Уайт для клеток опухолевого происхождения. Первыми лекарственными растениями, которые исследовали в культуре ткани, были барвинок розовый и белена черная. В 1947 Уайт и Готре экспериментально доказали способность культуры ткани белены к синтезу алкалоидов (накапливались в каллусной массе и среде культивирования). Получения первичного каллуса Каллус (от лат. callus – толстая кожа, мозоль) – недифференцированная ткань, возникающая путем неорганизованной пролиферации (размножения клеток делением) дедифференцированных (потерявших специализацию) клеток органов растений. Каллусная ткань образуется: • при травмах растений. Эта ткань защищает место ранения, может накапливать питательные вещества для регенерации. Функционирует непродолжительное время. • в результате пролиферации внутренних тканей экспланта из-за нарушения гормонального баланса. Растущий каллус разрывает слои ткани и развивается на поверхности. Фазы ростового цикла в суспензионной культуре Ростовая кривая (модельная) имеет S-образную форму. Различают следующие фазы ростового цикла: 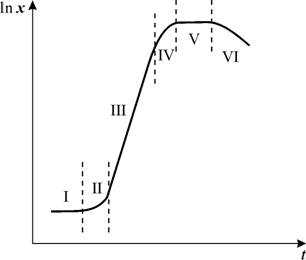 Латентная фаза (лаг-фаза) – клетки не размножаются, отсутствует их видимый рост, но происходит активное поглощения воды и питательных веществ. Экспоненциальная фаза (логарифмическая, фаза роста) – увеличение количества клеток за счет их интенсивного деления. Линейная фаза – очень короткая – скорость роста постоянна. Фаза замедленного роста (ранняя стационарная фаза) –средний размер клеток продолжает возрастать; отмечается гетерогенность клеточной популяции и начало синтеза вторичных метаболитов. Стационарная фаза – культуральная среда истощается (надо проводить пассирование). В этой фазе – максимум синтеза вторичных метаболитов. Фаза деградации клеток (отмирание). Метаболизм прекращается, т. к. энергетические запасы клеток оказываются исчерпанными. При промышленном синтезе, еще до наступления фазы отмирания, ферментацию останавливают. Деление клеток, приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов разобщены во времени. Накопление вторичных метаболитов возрастает в фазе замедленного роста клеточной популяции и достигает максимума в стационарной фазе. Максимум синтеза некоторых алкалоидов – в фазе экспоненциального роста (максимум митотической активности) – исключение. Источников получения каллусов эксплантат – это группа клеток, отделенная от материнского организма. Изолированные культуры каллусов получают из различных органов растений (корни, побеги, листья) или из определенного типа клеток (эндосперма, пыльца). Для обеспечения максимальной генетической стабильности клонируемого материала в качестве исходного экспланта используют молодые слабодифференцированные ткани (кончики молодых стеблей и корней, пазушные почки, зародыши, части молодых проростков). Для выращивания культур необходимы высокопродуктивные клетки растения. Так для выращивания родиолы розовой более перспективными являются клетки корневой системы. Технология получения каллуса Обычно эксплантат представляет собой вырезанные маленькие кусочки растительной ткани (2-4 мм), которые находятся в подходящем биологическом состоянии (они молоды, здоровы). Этот растительный материал • тщательно моют, • стерилизуют гипохлоридом натрия, 96% спиртом или 0,1% сулемы (HgCl2), • тщательно промывают дистиллированной водой • помещают на синтетическую агаризованную питательную среду. Сосуды закрывают ватно-марлевыми тампонами. Для образования каллуса и роста ткани сосуды переносят в темное помещение, где строго поддерживают определенный режим. Для большинства культур: температура +24-260, а влажность 65-70%. Через 2-3 недели на раневой поверхности образуется первичный каллус. Стерилизация питательной среды. Изолированные клетки растений могут успешно расти только при отсутствии конкуренции с микроорганизмами (поэтому все работы по культивированию надо производить в асептических условиях). Если в состав питательной среды входят термолабильные вещества – их фильтруют и добавляют в охлажденную простерилизованную среду. Проверим вашу интуицию, что произойдет с культурой клеток через время? Ведь она развивается в ограниченном пространстве на питательной среде и лишена доступа к земле. Правильно – из-за нехватки питательных веществ клетки начнут стареть и отмирать. Чтобы этого избежать, надо проводить пассирование, т.е. через 4-6 недель пересеивать клетки на свежую питательную среду. При регулярном пассировании способность к делению может поддерживаться в течение десятков лет. Необходимость пассирования для культур клеток показали американец Ф. Уайт и француз Р. Готре в 30-х гг ХХ в. Уайт занимался выращиванием изолированных корней томатов и показал, что корневая меристема может расти неограниченно долго во времени, если ее периодически пересаживать на свежую питательную среду. Культура некоторых его клонов поддерживалась около 30 лет. Компоненты питательной среды 1. макроэлементы 2. микроэлементы 3. источники железа 4. органические добавки – витамины. Большинство культур синтезируют витамины в субминимальных количествах (их надо добавлять дополнительно, особенно группы В). 5. источники углерода (т.к. даже зеленеющие ткани не аутотрофны). Лучший источник – сахароза. 6. органические добавки – регуляторы роста растений – ауксины и цитокинины (играют роль пусковых механизмов). Существует несколько стандартных питательных сред, широко используемых при культивировании, но количество регуляторов роста в них варьирует исходя из вида растений. Концентрации различных компонентов среды могут влиять на выход продукта. Пример: в культуре клеток барвинка розового увеличение выхода алкалоидов было связано с увеличением в среде концентрации сахарозы. Пример: в культуре клеток моркови накопление антоциана стабилизировалось, когда в качестве лимитирующего фактора использовали фосфаты. Культуру клеток получают: • на поверхности твердой питательной среды (твердофазная ферментация); Обычно используется для первичного получения культур клеток, их оценки в качестве возможных продуцентов БАВ и для выращивания посевного материала. • в виде суспензии в жидкой питательной среде (глубинное суспензионное культивирование). Преимущества и недостатки каллусных культур Преимущества каллусных культур в технологии получения растительного сырья: • надежность и стабильность по выходу биомассы и продуктов вторичного метаболизма; • возможность использования каллусной системы для иммобилизации и последующей биотрансформации Недостаток: в необходимости применения ручного труда. При производстве настоек женьшеня, плантационное выращивание этой культуры в количественном отношении по выходупанаксозидовимеет преимущество перед каллусным сырьем, но по токсичности препараты, получаемые из каллусного сырья, менее опасны. СУСПЕНЗИОННЫЕ КУЛЬТУРЫ Суспензионные культуры – отдельные клетки или группы клеток, выращиваемые во взвешенном состоянии в жидкой среде. Клеточную суспензию получают, помещая каллусную ткань в колбу с жидкой питательной средой. Сосуды с суспензией клеток помещаются на качалки, скорость перемешивания 100 - 120 об/мин (так обеспечивается аэрация и клеточные агрегаты распадаются на отдельные фрагменты). Для культивирования суспензий в производственных масштабах применяется аппаратура, разработанная для микробиологической промышленности, но растительные клетки в силу своих специфических особенностей требуют особых сосудов для культивирования. Особенности растительных клеток • наличие целлюлозной клеточной оболочки; • низкая интенсивность дыхания (по сравнению с микроорганизмами). Высокая степень аэрации может оказывать негативное действие на рост и синтез продуктов вторичного метаболизма, поскольку удаляются углекислый газ и летучие соединения. А углекислый газ может существенно влиять на длину лаг-фазы. • клетки растений в 50-100 раз больше, чем клетки бактерий и грибов; • в результате роста клетки увеличиваются в размерах, в них появляется большая вакуоль; Чем крупнее становится клетка, тем больше возрастает опасность ее механического повреждения в процессе перемешивания. В то же время клетки растений, крупные и тяжелые, требуют эффективного перемешивания (иначе оседание клеток приведет к появлению «мертвых зон», в которых происходит быстрое накопление и старение клеток). Важна устойчивость штамма к механическому стрессу. Мягкое перемешивание и аэрацию обеспечивает пневматический способ перемешивания потоком сжатого стерильного воздуха, подаваемого в ферментер с восходящим током воздуха. Однако при этом в культуральной среде возникает избыток воздуха, приводящий к кислородному голоданию. От концентрации кислорода в среде зависят рост и вторичный метаболизм клеток (изучено для микробов, для растений – нет). • суспензионные культуры состоят из клеточных агрегатов (для роста клеткам растений необходима высокая плотность); В верхней части сосуда постепенно может образовываться пена, состоящая из выделяемых клетками белков и полисахаридов. В процессе культивирования клетки слипаются (адгезия) и часть из них скапливается в этой пене, образуя «корку», или «безе». С увеличением биомассы клеток увеличивается и эта «корка», снижая интенсивность перемешивания, что в конце концов может привести культуру к гибели. • клетки растений обладают меньшей физиологической и метаболической активностью по сравнению с микроорганизмами. Время их удвоения: 1-3 суток. Преимущества глубинного культивированияперед твердофазным способом: • автоматически поддерживаются все необходимые параметры; • постоянный контроль содержания в питательной среде основных элементов питания; • постоянный микробиологический контроль с целью предотвращения инфицирования и гибели культур; • контроль активности роста и деления клеток; • контроль образования БАВ; • получение большой биомассы. Выход продуктов вторичного метаболизма выше в каллусных культурах, но управлять процессом культивирования легче при работе в суспензионных культурах. Выращивание культур в биореакторах глубинным способом дает получение большой биомассы. Факторы, от которых зависит накопление вторичных метаболитов в культуре клеток Для индукции морфогенеза in vitro необходимо вызвать неоднородность в клеточных популяциях. Важнейшим условием морфогенеза является адгезия клеток (соединение клеток между собой), в результате которой образуется ткань и орган. Поэтому важна гравитация. 1. Регуляторы роста растений При изменении условий культивирования можно вызвать вторичную дифференциацию и получить целое растение. Решающую роль в этом играет соотношение фитогормонов и их концентрация в питательной среде. Скуг и Мурасиге – концепция, согласно которой можно получить образование стеблей, корней или недифференцированный рост каллуса, изменяя относительное содержание ауксинов и цитокининов. • ауксины (индолил-3-уксусная кислота (ИУК), нафтилукссная кислота (НУК) и 2,4 дихлорфеноксиуксусная кислота (2,4Д)) Ауксин активирует деление и растяжение клеток. Проникая в клетки, ауксины связываются со специфическими рецепторами, в клеточной мембране индуцируют работу протонного насоса (помпы) в результате матрикс клеточных стенок размягчается (необходимое условия для роста и растяжение клеточных стенок). Усиливается секреция кислых гидролаз и полисахаридов, необходимых для дальнейшего роста клеточных стенок. Уменьшается продолжительность митоза. Предварительное усиление синтеза и накопления РНК. Стимуляция синтеза белка и появление новых белков. Усиление активности митохондрий. • цитокинины– 6-бензиламинопурин (БАП), N-изоптен и 6-фурфуриламинопурин (кинетин) – регулируют деление клеток, морфогенез побега и корня, созревание хлоропластов, образование почек и старение. 2. Внесение в питательную среду предшественников Пример: внесение фенилаланина в среду для культивирования клеток диоскореи увеличивает выход диосгенина на 100%. Диосгенин используют для производства гормональных препаратов, таких как кортизон и прогестерон 3. Физические факторы Накопление вторичных метаболитов зависит от света, температуры, рН, а при суспензионном культивировании от аэрации, перемешивания, скорости вращения сосудов, от газового состава и т.д. Дифференцировка клеток Синтез вторичных метаболитов коррелирует с процессом дифференцировки в культуре клеток. Синтез вторичных метаболитов в культуре клеток связан с внутриклеточными органеллами – пластидами и эндоплазматическим ретикулумом. Стабильность синтеза зависит от стадии культивирования и дифференцировки клеток. Пример 1: в суспензионной культуре мака снотворного (Papaver somniferum) синтез алкалоидов начинается только после того, как в ней дифференцируется достаточно большое количество специализированных клеток млечников, предназначенных для депонирования метаболитов. Пример 2: дифференцированные корневые каллусы красавки обыкновенной синтезируют тропановые алкалоиды, а недифференциорованные – нет. Но Пример 3: Культуры клеток табака и моркови синтезируют большое количество никотина и антоциана при слабой дифференцировке клеток. Пример 4: Выход алкалоидов раувольфии наблюдается при использовании недифференцированных клеток. Связь между ростом и метаболизмом – два типа механизма: • прямая связь – рост определяет степень агрегации клеток, оказывая косвенное влияние на синтез вторичных метаболитов. Достаточная степень агрегации может быть получена только в медленно растущих культурах. • обратная связь – определяющим фактором является не агрегация, а кинетика скорости роста, когда первичные и вторичные пути метаболизма по разному конкурируют за предшественник в быстро и медленно растущих клетках. Если условия среды благоприятны для быстрого роста, то в первую очередь синтезируются первичные метаболиты. Если быстрый рост блокирован, то начинается синтез вторичных метаболитов. Таким образом, низкая скорость роста иммобилизованных клеток способствует высокому выходу метаболитов. Проблема За исключением некоторых видов растений, суспензионные и каллусные культуры клеток синтезируют вторичные метаболиты в меньших количествах, чем целые растения. При этом рост биомассы в ферментере может быть значительным. Повысить выход целевого продукта можно с помощью иммобилизации. ИММОБИЛИЗАЦИЯ Иммобилизованные клетки образуют биомассу гораздо медленнее, чем растущие в жидких суспензионных культурах, но они способны к интенсивной выработке метаболитов. Одно из условий при иммобилизации клеток – выделение метаболита в питательную среду, из которой он должна быть легко извлечен (например, алкалоиды). Преимущества иммобилизованных клеток по сравнению с суспензионными культурами: • многократное использование • четкое отделение биомассы от продуктов метаболизма • увеличение продолжительности культивирования на стадии продуцирования • получение большого количества вторичных метаболитов • клетки растут в тесном физическом контакте друг другом, что благоприятно отражается и на химических контактах. Биотрансформация Биотрансформация – метод, использующий ферменты, локализованные в клетке растения и способные менять функциональные группы добавленных из вне химических соединений. Пример: превращение дигитоксина в дигоксин клетками наперстянки шерстистой. Дигитоксин – гликозид, содержащийся в листьях наперстянки пурпуровой (Digitalis purpurea), является липофильным неполярным соединением, поэтому почти полностью всасывается из желудочно-кишечного тракта, биодоступность его составляет 95—100%. Также дигитоксин в значительной степени связывается с белками, медленно инактивируется и выводится из организма, способен к кумуляции. Дигоксин – гликозид наперстянки шерстистой (Digitalis Ianata), по сравнению с дигитоксином обладает меньшей липофильностью (большей полярностью). В меньшей степени, чем дигитоксин связывается с белками плазмы крови. Использование дигоксина предпочтительнее из-за его меньшей токсичности, по сравнению с таковой у дигитоксина. Недеференцированные культуры клеток наперстянки шерстистой сами не образуют сердечных гликозидов, но могут осуществлять реакции биотрансформации субстратов, добавленных в питательную среду. Биотрансформация дигитоксина в дигогсин идет за счет реакции 12-гидроксилирования. До 1970-х гг. спектр соединений, которые образовывались культурами тканей в количествах, характерных для целого растения, был ограничен. Это • никотин, в больших количествах (0,7%) синтезируемый клетками табака, • диосгенин в культуре диоскореи дельтовидной (1,6%), • виснагин, содержание которого в каллусе амми зубной было в 20 раз больше, чем в растении. С начала 1970-х гг. список фармакологически ценных вторичных продуктов биосинтеза, обнаруженных в культурах тканей, значительно расширился. На основе культур клеток получают: • шиконин с помощью культуры клеток воробейника красного (Lithospermum erythrorhizon) – технологию опубликовалаяпонская фирма Mitsui Petrochemical Industries в 1983г. Это было начало эры биотехнологии, когда биотехнологическое использование культур клеток и тканей в качестве сырья в промышленных масштабах стало реальностью. Производные шиконина – красные нафтохиноновые пигменты – антибактериальные и противоопухолевые вещества, используются при кожных заболеваниях. • берберин (кишечные расстройства), • панаксозиды (адаптогены, укрепляющие иммунитет). • убихинон (из табака) • гликозиды в культурах ткани хинного дерева и наперстянки, • в Германии разработали способ получения розмариновой кислоты из культуры клеток каллуса. Это вещество, обладающее противоопухолевой активностью, и природный антибиотик широкого спектра действия. • перспектива использования культуры тканей тиса обыкновенного связана с возможностью получения таксола — вещества, обладающего противоопухолевой активностью. Для лечения одного больного в течение года требуется 120—130 г сухой коры нативного растения, сырьевые запасы которого истощаются. Национальный институт рака США выделил около 1 млн долларов для разработки экономически целесообразного способа получения таксола из культуры клеток. В России: В СССР системные исследования в этой области начались в 1957 г. в Бутенко. В 1965г. по инициативе профессора Грушвицкого при кафедре фармакогнозии Ленинградского химико-фармацевтического института была создана лаборатория по изучению лекарственных растений в культуре in vitro. Основными объектами изучения как возможных продуцентов препаратов для лечения сердечно-сосудистых заболеваний явились культуры тканей тропических видов раувольфии и женьшеня. Позже подобные лаборатории были организованы в Москва, Томске, Харькове. С выпуска экстракта культивируемой биомассы женьшеня(препарат биоженьшень) началось широкое производство продуктов культуры ткани растений в России. Биоженьшеньстали использовать в качестве БАД к кремам, лосьонам, а в пищевой промышленности — для приготовления тонизирующих напитков. Из культуры клеток раувольфии змеиной – производство антиаритмического лекарственного средства Аймалин (Харьков). Также в настоящее время в России разработана технология получения субстанции радиолы розовой и унгерии на основе каллусных культур. |
