Микроэлементы ( Zn, Mn, Cu, Co, Mo и многие другие),доля которых составляет от 0,001% до 0,000001% (1,9% массы клетки). Микроэлементы входят в состав биологически активных веществ — ферментов, витаминов и гормонов.
Ультрамикроэлементы (Hg, Au, U, Ra и др.), концентрация которых не превышает 0,000001% (0,01% массы клетки). Роль большинства элементов этой группы до сих пор не выяснена.
Макро- и микроэлементы присутствуют в живой материи в виде разнообразных
химических соединений, которые подразделяются на
неорганические и органические вещества.К неорганическим веществам относятся:
вода, составляющая примерно 70-80% массы организма;
минеральные вещества — 1-1,5%.
К органическим веществам относятся:
белки, занимающие среди органических веществ первое место по массе (в среднем — 10-20%, в сухом веществе — 40-50%);
жиры — 1-5%;
углеводы — 0,2-2,0%;
нуклеиновые кислоты 1-2%;
АТФ и другие низкомолекулярные органические вещества — 0,1-0,5%.
35.4. Неорганические вещества клетки
Вода
Вода — самое распространенное в живых организмах неорганическое соединение. Ее содержание колеблется в широких пределах: в клетках эмали зубов вода составляет по массе около 10%, а в клетках развивающегося зародыша — более 90%.
Без воды жизнь невозможна. Она не только обязательный компонент живых клеток, но и среда обитания организмов. Биологическое значение воды основано на ее химических и физических свойствах.
Физические и химические
свойства воды
Химические и физические свойства воды необычны. Они объясняются, прежде всего, малыми размерами молекул воды, их полярностью и способностью соединяться друг с другом водородными связями.
В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Молекула полярна: кислородный
атом несет частичный отрицательный заряд, а два водородных — частично положительные заряды. Это делает молекулу воды диполем. Поэтому при взаимодействии молекул воды друг с другом между ними устанавливаются водородные связи. Они слабее ковалентной, но, поскольку каждая молекула воды способна образовывать 4 водородные связи, они существенно влияют на физические свойства воды. Большая теплоемкость, теплота плавления и теплота парообразования объясняются тем, что большая часть поглощаемого водой тепла расходуется на разрыв водородных связей между ее молекулами. Вода обладает высокой теплопроводностью. Вода практически не сжимается, прозрачна в видимом участке спектра. Наконец, вода — единственное вещество,
плотность которого в жидком состоянии больше, чем в твердом.
Биологическое значение воды
Физические и химические свойства делают ее уникальной жидкостью и определяют ее биологическое значение.
Вода — хороший растворитель ионных (полярных) соединений, а также некоторых не ионных, в молекуле которых присутствуют заряженные (полярные) группы. Если энергия притяжения молекул воды к молекулам какого-либо вещества больше, чем энергия притяжения между молекулами вещества, то молекулы гидратируются и вещество растворяется (рис. 256). По отношению к воде различают:
гидрофильные вещества — вещества, хорошо растворимые в воде;
гидрофобные вещества — вещества, практически нерастворимые в воде.
Б
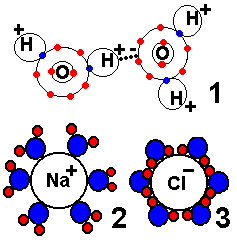
Рис 254. Свойства молекулы воды:
1 — когезия молекул воды; 2 — гидратация катиона; 3 — гидратация аниона.
ольшинство биохимических реакций может идти только в водном растворе; многие вещества поступают в клетку и выводятся из нее в водном растворе.
Большая теплоемкость и теплопроводность воды препятствуют возникновению "горячих точек" в организме, так как способствуют равномерному распределению тепла в клетке.
Благодаря большой теплоте испарения воды, происходит охлаждение организма.
Плотность льда меньше плотности воды. Поэтому при замерзании водоемов подо льдом остается жизненное пространство для водных организмов.
Благодаря силам адгезии3 и когезии4, вода обладает свойством капиллярности, то есть способности подниматься по капиллярам (один из факторов, обеспечивающих движение воды в сосудах растений) (рис. 254).
Вода является непосредственным участником многих химических реакций (гиролитическое расщепление белков, углеводов, жиров и др.).
Несжимаемость воды определяет напряженное состояние клеточных стенок (тургор), а также выполняет опорную функцию (гидростатический скелет, например, у круглых червей).
Минеральные вещества
Минеральные вещества клетки в основном представлены солями,
которые диссоциируют на анионы и катионы, некоторые — в неионизированной форме в микродозах (Fe, Mg, Cu, Co, Ni и др.)
Для процессов жизнедеятельности клетки наиболее важны катионы Na
+, Ca
2+, Mg
2+, анионы HPO
42-, Cl
-, HCO
3-. Концентрации ионов в клетке и среде ее обитания, как правило, различны. Например, во внешней среде (плазме крови, морской воде) K
+ всегда меньше, а Na
+ всегда больше, чем в клетке. Существует ряд механизмов, позволяющих клетке поддерживать определенное соотношение ионов в протопласте и внешней среде.
Различные ионы принимают участие во многих процессах жизнедеятельности клетки:
катионы К+, Na+, Ca2+ обеспечивают раздражимость живых организмов;
катионы Mg2+, Mn2+, Zn2+, Ca2+ и др. необходимы для нормального функционирования многих ферментов;
образование углеводов в процессе фотосинтеза невозможно без Mg2+ (составная часть хлорофилла);
слабощелочная реакция содержимого клетки поддерживается анионами слабых кислот (НСО3-, НРО4-) и слабыми кислотами (Н2СО3);
От концентрации солей внутри клетки зависят ее буферные свойства. Буферностью называют способность клетки поддерживать слабощелочную реакцию своего содержимого на постоянном уровне. Внутри клетки буферность обеспечивается главным образом анионами H2PO4- и НРО42-. Во внеклеточной жидкости и в крови роль буфера играют Н2СО3- и НСО32-.
Фосфатная буферная система:
Низкий pH Высокий pHНРО
42- + Н
+ ←―――――――→H
2PO
4-Гидрофосфат — ион Дигидрофосфат — ион
Бикарбонатная буферная система:
Низкий pH Высокий pHНСО
3- + Н
+ ←―――――――→H
2СO
3Гидрокарбонат — ион Угольная кислота
Некоторые неорганические вещества
содержатся в клетке не только в растворенном, но и в твердом состоянии. Например, Са и Р содержатся в костной ткани, в раковинах моллюсков в виде двойных углекислых и фосфорнокислых солей.
 Скачать 34.42 Mb.
Скачать 34.42 Mb.