биохимия микроорганизмов. микра 3. Практическое занятие 3
 Скачать 113.57 Kb. Скачать 113.57 Kb.
|
|
Практическое занятие №3 Биохимические признаки бактерий. Идентификация бактерий. Вирусы. Строение и классификация. Репродукция вирусов. Культивирование вирусов. Вирусологичес кий метод исследования. Биохимические свойства микробов. Биохимические свойства - способность микроорганизмов к ферментации и ассимиляции тех или иных химических веществ. У бактерий различают три основные группы ферментов: Конститутивные - постоянно синтезирующиеся в микробных клетках. Индуцибельные - синтез которых индуцируется соответствующим субстратом. Репрессибельные - синтез которых подавляется в результате избыточного накопления продукта реакции, катализируемой данным ферментом. Для идентификации микроорганизмов - возбудителей инфекционных болезней, кроме морфологических и культурных свойств, необходимо изучение биохимических признаков. Биохимические признаки · гликолитические свойства бактерий (бактерии характеризуются неодинаковой способностью использовать различные углеводы. Утилизация углеводов бактериями приводит к образованию органических кислот, либо кислот и газов. Определение сахаролитических ферментов проводится на средах пестрого ряда, средах Гисса. Пестрые ряды, среды Гисса-состав: питательная основа-пептонная вода, любой сахар, индикатор рН В пробирку с глюкозой помещают "поплавок" для определения продукции газа (изначально все желтое, а потом окрашивается в розовый) Для определения протеолитических ферментов - коллагеназ производят посев уколом исследуемой культуры в столбик мясо-пептонной желатины (МПЖ). Продолжительность культивирования 7-10 суток при комнатной температуре. При положительном результате наблюдается разжижение желатины. Например: возбудитель сибирской язвы образует кратерообразное разжижение МПЖ. В настоящее время для изучения биохимических свойств бактерий используется система индикаторная бумажная (СИБ) СИБ - набор бумажных дисков, пропитанных различными субстратами и индикаторами, которые помещают в пробирки с взвесью изучаемой культуры. Диски фильтровальной бумаги пропитывают индикаторными (дифференциальными) средами. В высушенном состоянии диски можно длительно хранить. Перед использованием диски раскладывают пинцетом в стерильные пробирки и добавляют суспензию идентифицируемой культуры в физрастворе) · протеолитические свойства бактерий (расщепление желатина, если разжижает-есть активность м.о. Или мясо-пептонный бульон, любая простая среда) Для определения протеолитических ферментов - коллагеназ производят посев уколом исследуемой культуры в столбик мясо-пептонной желатины (МПЖ). Продолжительность культивирования 7-10 суток при комнатной температуре. При положительном результате наблюдается разжижение желатины. Например: возбудитель сибирской язвы образует кратерообразное разжижение МПЖ. В настоящее время для изучения биохимических свойств бактерий используется система индикаторная бумажная (СИБ) СИБ - набор бумажных дисков, пропитанных различными субстратами и индикаторами, которые помещают в пробирки с взвесью изучаемой культуры. Диски фильтровальной бумаги пропитывают индикаторными (дифференциальными) средами. В высушенном состоянии диски можно длительно хранить. Перед использованием диски раскладывают пинцетом в стерильные пробирки и добавляют суспензию идентифицируемой культуры в физрастворе ·липолитические свойства (желточно-солевой агар, расщепление лецитина) · токсинообразование Ферменты. Классификация ферментов микроорганизмов. 1.по типу катализируемой реакции – оксиредуктазы, трансферазы, гидролазы лиазы, изомеразы, лигазы 2. по локализации – эндоферменты – катализируют реакции внутри клетки. Экзоферменты – выделяются из бактериальной клетки , катализируют расщепление 3. генетический контроль образования – конститутивные (в теч всего жизненного цикла), индуцибельные – образуются в ответ на наличие субстрата 4. по субстрату – протеолитические – расщепляют белки, сахаролитические – расщепляют углеводы, липолитические – расщепляют жиры. Токсины бактерий — это яды, образуемые бактерией, и вызывающие появление симптомов заболевания у человека. Различают экзотоксины (выделяются наружу из клетки) и эндотоксины (связаны с клеточной стенкой бактерии и попадают в организм при гибели бактерии). Пигменты — обеспечивают окрашивание колоний. Пигменты различаются по цвету, химическому составу и растворимости. Пигменты предохраняют бактериальную клетку от УФ-лучей, обезвреживают токсичные кислородные радикалы, обладают антибиотическими свойствами, принимают участие в реакциях, сопутствующих фотосинтезу в фототрофных бактериях и защищают бактерии от действия солнечного света. Ароматические вещества вызывают при размножение появления различных запахов как приятных, так и неприятных. Люминофоры — вещества, содержащиеся в некоторых бактериях, вызывающих их свечение. Пигменты микробов. Пигменты бактерий – это специфические фоторецепторные молекулы, вторичные метаболиты, образующиеся на свету и придающие бактериям окраску. (Наличие у бактерий пигментов обычно связано с их способностью существовать за счет энергии света. Некоторые микроорганизмы утратили способность к фотосинтезу, но сохранили пигменты. Способность образовывать пигменты детерминирована генетически и используется в качестве диагностического признака. Образование пигментов зависит от состава среды и условий культивирования. У многих микроорганизмов образование пигмента происходит только на свету. Пигменты различают по химическому составу и цвету.) Классификация пигментов по химическому составу и цвету: 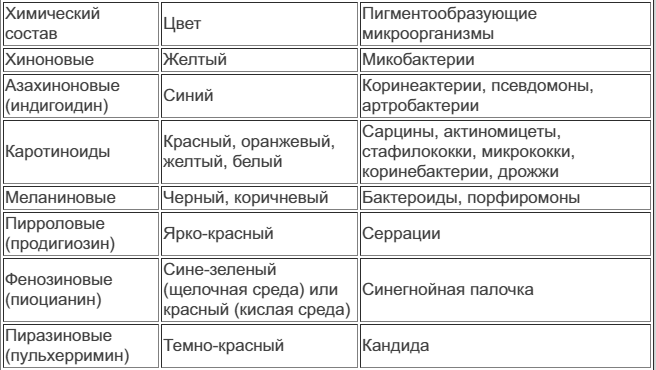 Классификация пигментов по растворимости: Ø жирорастворимые (каротиноидные, хиноновые, азахиноновые); Ø водорастворимые (фенозиновые, пиразиновые) – хромопарные (способны диффундировать в окружающую среду и окрашивать не только колонии, но и питательные среды); Ø спирторастворимые (каротиноидные, пирроловые); Ø нерастворимые ни в воде, ни в сильных кислотах (меланиновые). Значение пигментов: Ø защита от действия видимого света и УФ-лучей; Ø ассимилируют углекислый газ; Ø обезвреживают токсичные кислородные радикалы; Ø участвуют в синтезе витаминов; Ø обладают антибиотическим действием и свойствами биологически активных веществ; Ø цвет пигмента используют в идентификации бактерий. Содержание третьего и четвертого дней исследования по выделению чистой культуры аэробов и анаэробов. Анаэробы - микроорганизмы, активно размножающиеся в бескислородных условиях, без доступа воздуха. Выделение чистых культур анаэробов имеет особенности, проводят в течение четырех дней. Первый день: 1. Посев исследуемого материала на среду Китт-Тароцци или на среду RCM в пробирки. Среды предварительно должны быть выдержаны на кипящей водяной бане в течение 30 мин, для удаления кислорода. Второй день: 1. Бактериоскопия выращенной культуры, если в мазках крупные палочки, исследования продолжают. 2. Посев культуры, выросшей на средах КиттТароцци или RCM по Цейсслеру на три чашки с кровяным, сахарным агаром (МПА с 5% крови и 1% глюкозы). Анаэробы - микроорганизмы, активно размножающиеся в бескислородных условиях, без доступа воздуха. Выделение чистых культур анаэробов имеет особенности, проводят в течение четырех дней. Первый день: 1. Посев исследуемого материала на среду Китт-Тароцци или на среду RCM в пробирки. Среды предварительно должны быть выдержаны на кипящей водяной бане в течение 30 мин, для удаления кислорода. Второй день: 1. Бактериоскопия выращенной культуры, если в мазках крупные палочки, исследования продолжают. 2. Посев культуры, выросшей на средах КиттТароцци или RCM по Цейсслеру на три чашки с кровяным, сахарным агаром (МПА с 5% крови и 1% глюкозы). 22:16 Посев выполняют бактериологической петлей штрихами, ставят в анаэростат, откачивают воздух, потом в термостат. Можно сделать посев по Вейнбергу на три столбика с сахарным агаром, предварительно агар в столбиках выдерживают на кипящей водяной бане 30 мин, затем охлаждают до 37-400 С. Столбики после посева ставят в термостат. 22:17 Третий день: 1. Изучают характер роста, отмечают «типичные колонии». 2. Проводят бактериоскопию «типичных колоний», если морфологические свойства соответствуют предполагаемым микроорганизмам, исследования продолжают. 3. Посев «типичных колоний» на среду Китт-Тароцци или на среду RCM. Четвертый день: 1. Бактериоскопия выросшей культуры, если в мазках одинаковые клетки – культура чистая, приступают к определению ее вида, идентификации. Идентификацию анаэробных микроорганизмов проводят по тем же свойствам, как и аэробных. Важное значение имеет результат биопробы. Если для выделения анаэробов используют улучшенный клостридиальный бульон (RCM), то после посева добавляют стерильное парафиновое масло и пастеризуют 30 мин при 750 С на водяной бане. Инкубируют посевы не менее 7 дней при 300 . Если обнаруживают черное окрашивание, проводят идентификацию. Идентификация бактерий. «Пестрый ряд» или среды Гисса. Для определения ферментативной способности микроорганизмов пользуются средами Гисса. В зависимости от наличия в микробной клетке того или иного фермента она способна разлагать какой-либо один из углеводов с образованием определенных продуктов разложения, поэтому в состав среды вводится какой-либо углевод: лактоза, глюкоза, маннит, сахароза и пр. Набор таких сред получил название «пестрого ряда углеводов». Сначала готовят пептонную воду: на 1 л дистиллированной воды берут 10 г пептона и 5 г химически чистой поваренной соли, кипятят до растворения пептона, фильтруют через бумажный фильтр (фильтрат должен быть совершенно прозрачным) и устанавливают pH 7,2-7,4. Затем к 100 мл пептонной воды добавляют по 0,5 г одного из применяемых углеводов и по 1 мл индикатора Андреде. В состав индикатора Андреде входит: 0,5 г кислого фуксина, 16 мл 1 н. раствора едкого натра (NaOH) и 100 мл дистиллированной воды. При необходимости индикатор можно готовить заранее и сохранять его в темном месте, предварительно про-кипятив при 100 °С в течение 15 мин. После введения индикатора среды разливают по пробиркам с поплавками и стерилизуют в кипятильнике Коха трижды по 30 мин. По окончании стерилизации поплавки должны быть погружены в среду, в противном случае пробирка не может быть использована. Среды Гисса с реактивом Андреде имеют соломенно-желтый цвет без розового оттенка. При развитии в среде микроорганизмов последние, разлагая сахар с образованием кислоты, вызывают изменение реакции. А так как в кислой среде индикатор Андреде краснеет, то это и является свидетельством, что микроорганизм использует данный сахар для своей жизнедеятельности. Отсутствие покраснения, наоборот, свидетельствует об отсутствии в ферментативном комплексе изучаемого микроба фермента, разлагающего имеющийся в среде углевод. Ферментативная активность микроорганизмов богата и разнообразна. Она позволяет установить видовую и типовую принадлежность, определить биологические варианты микроба. Существует целый ряд ферментов, по активности которых можно определить степень патогенности микроорганизма. Для определения ферментативной (биохимической) активности микробов используют дифференциально – диагностические среды. К дифференциально – диагностическим средам относятся среды Гисса, на которых изучается сахаролитическая активность микрооганизмов. Среды Гисса могут быть жидкими и плотными. Основу сред Гисса составляют мясо – пептонный бульон (МПБ) и мясо – пептонный агар (МПА). В состав этих сред входит углевод и индикатор. Существуют два ряда сред Гисса – большой (включающий 27 наименований) и малый. Малый ряд сред Гисса включает мальтозу, глюкозу, сахарозу, манит и лактозу. Исходная установка рН среды – слабо щелочная (7,2 – 7,4). Если при культивировании микробов происходит расщепление субстрата до кислоты, то рН среды изменяется в кислую сторону и при этом происходит изменение цвета индикатора. Изменение цвета питательной среды и является показателем наличия у данного микроба фермента, расщепляющего конкретный субстрат до кислоты. И в жидкой, и в плотной питательной среде о наличии фермента, расщепляющего субстрат до кислоты, судят по изменению цвета индикатора. Образование газа устанавливают по скоплению пузырьков газа в толще агара и по разрыву агара (если среды Гиса плотные) или по скоплению пузырьков газа в поплавке (если среды жидкие). Поплавок – узкая стеклянная трубочка с запаянным концом, обращенным вверх, которую помещают в пробирку со средой перед стерилизацией среды. Различие в наборе ферментов, расщепляющих углеводы, может быть использовано при дифференцировке родственных микробов, например, сальмонелл, шигелл, эшерихий. Так, на средах Эндо, Левина, Плоскирева, в состав которых входит лактоза и индикатор (анилиновый краситель), колонии кишечной палочки будут окрашены в фиолетовый цвет (на среде Левина) или в сиреневый (на средах Эндо и Плоскирева). Колонии сальмонелл и шигелл на этих же средах будут бесцветными. Это обусловлено тем, что кишечная палочка, имея фермент лактазу, расщепляет лактозу, в результате чего образуется кислота, рН среды смещается в кислую сторону и происходит проявление цвета индикатора – анилинового красителя. Особи кишечной палочки хорошо окрашиваются анилиновым красителем, а совокупность окрашенных особей представляет окрашенную колонию. Шигеллы и сальмонеллы не имеют фермента лактазы и не расщепляют лактозу, рН среды не изменяется, индикатор не проявляется, микробные клетки не окрашиваются. Поэтому колонии сальмонелл и шигелл на средах Эндо и Плоскирева будут бесцветными. О наличии фермента амилазы можно судить, посеяв культуру на среду, содержащую крахмал. Если есть фермент, расщепляющий крахмал, то при добавлении в пробирку капли раствора Люголя, посинение среды не произойдет. Нерасщепленный крахмал при добавлении раствора Люголя дает синее окрашивание. Протеолитические свойства (т.е. способность расщеплять белки, полипептиды и пр.) изучают на средах с желатином, молоком, сывороткой, пептоном. При росте на желатиновой среде микробов, ферментирующих желатин, среда разжижается. Характер разжижения, вызываемый разными микробами, различен. Гемолитические свойства микробов можно выявить, используя кровяной агар. Если микроб имеет фермент гемолизин, то вокруг колоний этого микроба будут зоны лизиса эритроцитов ( в этих зонах агар будет бесцветным). Фермент лецитиназу выявляют при посеве культуры на желточно – солевой агар. Вокруг колонии микроба, продуцирующего этот фермент, образуется матовый ореол. Следует помнить о том, что наличие различных ферментов определяет биохимические свойства микробов. Вирусы. Строение и классификация. Вирусы – это мельчайшие инфекционные агенты, которые имеют молекулярную (неклеточную) организацию, обладают единственным типом нуклеиновой кислоты (ДНК или РНК) и являются облигатными (строгими) внутриклеточными паразитами. Несмотря на уникальный жизненный цикл и особенности структуры, вирусы являются биологическими организмами, способными к самовоспроизведению на основании универсального для всего живого генетического кода. Вирусы являются важнейшими возбудителями инфекционных заболеваний человека. Для вирусов характерен ряд общих свойств: – молекулярная (неклеточная) структура; – геном представлен только одним типом нуклеиновой кислоты (ДНК или РНК); количество цепей (1 или 2) и их структура у разных вирусов существенно отличаются; – вирусы обладают наследственностью и выраженной изменчивостью; филогенез вирусов подчиняется законам эволюции; – размножение (или репродукция) вирусов происходит только в зараженных ими клетках (строгий внутриклеточный паразитизм); – вирусы не обладают собственными системами синтеза белка и генерации энергии; для репродукции используют белоксинтезирующие и энергетические системы клеток хозяина; – имеют минимальный размер (обычно в пределах от 10-20 до 400 нм); – в природе распространены повсеместно (убиквитарность вирусов). По своей структуре вирусы представляют собой геометрически правильные образования, состоящие из центральной части (генома) и одной или двух оболочек. В зависимости от количества оболочек вирусы подразделяются на 2 типа: - простые вирусы ”, состоящие из нуклеиновой кислоты и одной белковой оболочки - капсида; - сложные вирусы , содержащие кроме нуклеиновой кислоты и капсида внешнюю липопротеиновую оболочку (суперкапсид). Понятие о репродукции вирусов. Репродукция вируса – это процесс размножения вирусных частиц в чувствительных к ним клетках. Репродуцируются только вирулентные вирусы, обладающие высокой степенью патогенности[. Общие закономерности репродукции вируса К самостоятельному размножению вирусы не способны. Синтез вирусных белков и воспроизведение копий вирусного генома обеспечиваются биосинтетическими процессами клетки-хозяина. Для вирусов характерен дизъюнктивный (разобщенный) тип репродукции. Он осуществляется при взаимодействии вируса с инфицируемой клеткой. В этом случае белковые молекулы и нуклеиновые кислоты образуются отдельно друг от друга. После чего происходит сборка дочерних популяций[3]. Особенности репродукции вирусов зависят от типа вирусного генома. Однако отмечается существование целого ряда общих закономерностей репродукции вируса: Все вирусы, содержащие молекулу РНК, кроме вирусов гриппа и ретровирусов, репродуцируются в цитоплазме клетки. Геномы ретровирусов и вирусов гриппа при репродукции проникают в ядро клетки-хозяина[2]. Все вирусы, содержащие молекулу ДНК, кроме вируса оспы репродуцируются в ядре и в цитоплазме клетки. В ядре происходит транскрипция и репликация вирусных нуклеиновых кислот, а в цитоплазме – трансляция вирусных белков и сборка дочерних вирионов. Вирус оспы размножается только в цитоплазме клетки[2]. Процесс синтеза нуклеокапсидных белков происходит на свободных полирибосомах (не связанных с мембраной). Процесс синтеза суперкапсидных белков проходит на рибосомах, ассоциированных с мембранами[2]. Белки вирусов после образования подвергаются протеолитическому процессингу (разрезанию или расщеплению)[2]. Суперкапсидные белки оболочечных вирусов при транспортировке к клеточной мембране проходят гликозирование (присоединении к полипептиду углеводных остатков)[2]. Этапы репродукции вируса Репродукцию или жизненный цикл вируса делят на шесть последовательных этапов: Адсорбция на мембране клетки[2]. Проникновение в клетку[2]. Депротеинизация[2]. Синтез компонентов вирусов[2]. Формирование дочерних вирионов[2]. Выход вирионов[2 Этапы вирусологического метода исследования. Для выделения и культивирования облигатных паразитов (вирусов, риккетсий и хламидий) применяются вирусологические методы: заражение тканевых культур, куриного эмбриона и восприимчивых лабораторных животных. Вирусологическое исследование проводится в два этапа: выделение вируса и идентификация вируса. Материалами для вирусологического исследования могут быть отделяемое носоглотки, испражнения, кровь и другие материалы в зависимости от локализации вируса. Вирусологические методы также применяются для культивирования некоторых факультативных паразитов, например, микоплазмы, бруцелл, франциселл, легионелл и др. Способы культивирования вирусов. Для культивирования вирусов используют культуры клеток, куриные эмбрионы и чувствительных лабораторных животных. Эти же методы используют и для культивирования риккетсий и хламидий — облигатных внутриклеточных бактерий, которые не растут на искусственных питательных средах. Культуры клеток. Культуры клеток готовят из тканей животных или человека. Культуры подразделяют на первичные (неперевиваемые), полуперевиваемые и перевиваемые. Приготовление первичной культуры клеток складывается из нескольких последовательных этапов: измельчения ткани, разъединения клеток путем трипсинизации, отмывания полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост, например в среде 199 с добавлением телячьей сыворотки крови. Перевиваемые культуры в отличие от первичных адаптированы к условиям, обеспечивающим им постоянное существование invitro, и сохраняются на протяжении нескольких десятков пассажей. Перевиваемые однослойные культуры клеток приготовляют из злокачественных и нормальных линий клеток, обладающих способностью длительно размножаться invitro в определенных условиях. К ним относятся злокачественные клетки HeLa, первоначально выделенные из карциномы шейки матки, Нер-3 (из лимфоидной карциномы), а также нормальные клетки амниона человека, почек обезьяны и др. К полуперевиваемым культурам относятся диплоидные клетки человека. Они представляют собой клеточную систему, сохраняющую в процессе 50 пассажей (до года) диплоидный набор хромосом, типичный для соматических клеток используемой ткани. Диплоидные клетки человека не претерпевают злокачественного перерождения и этим выгодно отличаются от опухолевых. О размножении (репродукции) вирусов в культуре клеток судят по цитопатическому действию (ЦПД), которое может быть обнаружено микроскопически и характеризуется морфологическими изменениями клеток. Характер ЦПД вирусов используют как для их обнаружения (индикации), так и для ориентировочной идентификации, т. е. определения их видовой принадлежности. Один из методов индикации вирусов основан на способности поверхности клеток, в которых они репродуцируются, адсорбировать эритроциты — реакция гемадсорбции. Для ее постановки в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты. Другой метод — реакция гемагглютинации (РГ). Применяется для обнаружения вирусов в культуральной жидкости культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона. Количество вирусных частиц определяют методом титрования по ЦПД в культуре клеток. Для этого клетки культуры заражают десятикратным разведением вируса. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических доз. Более точным количественным методом учета отдельных вирусных частиц является метод бляшек. Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток. Куриные эмбрионы. Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминированы вирусами и микоплазмами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям. Для получения чистых культур риккетсий, хламидий и ряда вирусов в диагностических целях, а также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. О размножении упомянутых микроорганизмов судят по морфологическим изменениям, выявляемым после вскрытия эмбриона на его оболочках. О репродукции некоторых вирусов, например гриппа, оспы, можно судить по реакции гемагглютинации (РГА) с куриными или другими эритроцитами. К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие в нем большого количества белков и других соединений, затрудняющих последующую очистку риккетсий или вирусов при изготовлении различных препаратов. Лабораторные животные. Видовая чувствительность животных к определенному вирусу и их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки — к вирусам Коксаки). Преимущество данного метода перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре или эмбрионе. К его недостаткам относятся контаминация организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой линии данного вируса, что удлиняет сроки исследования. Методы обнаружения (индикации) вирусов. Для индикации или обнаружения вирусов используют: 1. Цитопатическое действие вирусов (ЦПД). 2. Метод негативных колоний. 3. Реакция гемадсорбции (ГА). 4. Реакция гемагглютинации (РГА) После получения монослоя жизнеспособных культур клеток их заражают материалом, который содержит вирусы. Цитопатическое действие (ЦПД) характеризуется морфологическими изменениями клеток. Часть из таких клеток погибает и отслаивается от стенок пробирки. Вирусные частицы, освобождающиеся при разрушении одних клеток, инфицируют другие, которые через некоторое время также погибают. В результате, вместо сплошного монослоя клеток остаются лишь отдельные клеточные островки, которые обнаруживаются микроскопически. Характер ЦПД, вызваного разными вирусами неодинаков. Например, при поражении парамиксовирусами, герпесвирусами наблюдается слияние клеток с образованием синцития, при энтеровирусах, реовирусах – сморщивание и деструкция клеток, при аденовирусах – гроздевидная агрегация клеток, при поражении вирусом кори – симпластобразование. То есть, характер ЦПД используют для ориентировочной идентификации. Определение вирусных частиц методом титрования по ЦПД в культуре клеток.Для этого клетки культуры заражают 10-ти кратными разведениями вируса. После инкубации в 6-7 дней их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50% зараженных культур. Титр вируса выражают количеством цитопатических доз (ЦПД 50) в 1 мл препарата. ЦПД, кроме микроскопирования, может быть обнаружено методом негативных колоний или методом бляшек. Суть этого метода заключается в следующем: монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара с индикатором нейтральным красным. Агар в этом случае используют для того, чтобы ограничить распространение вируса по клеточному слою. Инкубируют при 37 0С и через 48-96 часов выявляют пятна бляшки или негативные колонии. Живые клетки накапливают краску, погибшие –ее теряют, поэтому участки клеточного монослоя, поврежденные вирусом, выглядят светлыми на фоне окрашенных клеток. Обычно бляшки имеют диаметр 1-3 мм. Пятна возникают за счет ЦПД вируса. Наиболее точным количественным методом учета вирусных частиц является метод бляшек. Зависимость между числом образовавшихся бляшек и числом инфекционных вирусных частиц в препарате строго линейна, и, следовательно, каждая негативная колония соответствует одной инфекционной единице. Конечный результат титрования или титр вируса выражается количеством бляшкообразующих единиц –БОЕ. Понятие о бактериофагах. Бактериофаги (фаги) - это вирусы, поражающие бактериальные клетки (в качестве клетки-хозяина). бактериофаги имеют смешанный тип симметрии нуклеокапсида. Большинство фагов содержит кольцевую двунитчатую ДНК, и лишь некоторые РНК или однонитчатую ДНК. Фаги, как и другие вирусы, обладают антигенные свойствами и содержат группоспецифические (по ним делятся на серотипы) и типоспецифические антигены. Сыворотки, содержащие антитела к этим антигенам (антифаговые сыворотки) нейтрализуют литическую активность фагов. Взаимодействие бактериофага с клеткой происходит в соответствии с основными типами взаимодействия, характерными для всех вирусов, - продуктивная (литическая), абортивная вирусная и латентная (лизогения, вирогения) инфекция, а также вирус-индуцированная трансформация. По характеру взаимодействия фага с клеткой все бактериофаги делятся на: вирулентные (литические), вызывающие продуктивную инфекцию и лизис бактериальной клетки, умеренные, вызывающие латентную инфекцию и ассоциацию генома вируса с бактериальной хромосомой. Умеренные фаги, в отличие от вирулентности, не вызывают гибель бактериальных клеток, и при взаимодействии с ней переходят в неинфекционную форму фага, называемую профагом. Профаг - геном фага, ассоциированный с бактериальной хромосомой. Профаг, ставший частью хромосомы клетки, при ее размножении реплицируется синхронно с геномом бактерии, не вызывая ее лизиса, и передается по наследству от клетки к клетке в неограниченном числе поколений. Бактериальные клетки, содержащие в своей хромосоме профаг, называются лизогенными. Профаг в лизогенных бактериях самопроизвольно или под влиянием различных индуцированных агентов может переходить в вегетативный фаг. В результате такого превращения бактериальная клетка лизируется и продуцирует новые фаговые частицы. В ходе лизогенизации бактериальные клетки могут дополнительно приобретать новые признаки, детерминируемые геномом вируса. Такое явление - изменение свойств микроорганизмов под влиянием профага, называется фаговой, или лизогенной конверсией (проявление вирус-индуцированной трансформации). Умеренные фаги, неспособные ни при каких условиях переходить из профага в вегетативный фаг (образовывать зрелые фаговые частицы), называются дефектными, чаще это происходит в результате нарушения стадии сборки вирусных частиц. Некоторые умеренные фаги называются трансдуцирующими. поскольку с их помощью осуществляется один из механизмов генетической рекомбинации у бактерий - трансдукции. Классификация бактериофагов. Фаготипирование Специфичность фагов послужила основанием для их наименования по видовым и родовым названиям чувствительных к ним бактерий. Так, например, фаги, лизирующие стрептококки, называются стрептококковыми, лизирующие холерные вибрионы - холерные, стафилококки - стафилококковыми. По признаку специфичности выделяют поливалентныебактериофаги, лизирующие культуры одного семейства или рода бактерий, моновалентные (монофаги) - лизирующие культуры только одного вида бактерий, а также отличающиеся наиболее высокой специфичностью - типовыебактериофаги, способные вызывать лизис только определенных типов (вариантов) бактериальной культуры внутри вида бактерий. Диагностическая и терапевтическая роль фагов Фаги могут применяться в качестве диагностических препаратов для установления рода и вида бактерий, выделенных в ходе бактериологических исследования. Однако чаще всего их используют для лечения и профилактики некоторых инфекционных заболеваний (перорально или местно). Активность фага выражают числом частиц фага, содержащихся в 1 мл или 1 таблетке. Лечебное и профилактическое действие фагов основано на их литической активности. Отличительной чертой бактериофагов как терапевтических средств является почти полное отсутствие у них побочного действия, что позволяет назначать эти препараты различным возрастным группам без каких-либо ограничений, и возможность назначения поливалентных бактериофагов до получения результатов бактериологического исследования. Взаимодействие фага с бактериальной клеткой. Взаимодействие вируса с клеткой, приводящее к образованию самостоятельного биологического комплекса вирус - клетка и к размножению вируса, - сложный процесс, состоящий из ряда последовательных этапов: адсорбции, внедрения, размножения, или репродукции, созревания и освобождения Первый этап взаимодействия фага с бактериальной клеткой - адсорбция. Он осуществляется в результате случайных столкновений фага с бактериями и прикреплении его к клеточной поверхности. Адсорбция является высокоспецифическим процессом. Каждый вид фага адсорбируется только на определенных бактериях и на определенных участках клеточной поверхности, так называемых фагочувствительных рецепторах. Они расположены в наружных слоях клеточной стенки. Процесс адсорбции состоит из двух стадий: первая стадия неспецифическая. Она сводится к прикреплению фаговых частиц, обусловлена электростатическими силами и носит обратимый характер. Фаговые частицы могут быть удалены с поверхности клетки при перенесении ее в среду, неблагоприятствующую адсорбции, или при обработке ее антифаговой сывороткой. Вторая стадия - специфическая, необратимая - обусловлена образованием связей между рецепторами фага, расположенными на поверхности отростка, и соответствующими рецепторами клетки. За адсорбцией фага следует этап внедрения (инъекции) фаговой нуклеиновой кислоты в клетку. Процесс начинается с сокращения чехла отростка. Сокращение стимулируется базальной пластинкой, изменяющей свою конформацию под влиянием нитей отростка. При этом лизоцим, расположенный в области базальной пластинки, разрушает' муреин клеточной стенки и внутренний стержень хвостового отростка проходит через разрыхленную клеточную стенку. Когда дистальный конец его достигает цитоплазматической мембраны, ДНК фага по каналу стержня впрыскивается в бактериальную клетку. Белковые пустые оболочки (тени фага) отрываются от клеточной стенки и разрушаются. Третий этап - внутриклеточное размножение, или репродукция фага - заключается в синтезе компонентов вируса: нуклеиновой кислоты и белков. Синтезируются они неодновременно, а раздельно в разных участках клетки, затем следует самосборка фаговых частиц. С внедрением в клетку фаговой ДНК происходит перестройка метаболизма клетки в направлении синтеза компонентов фаговых частиц. Сразу после инъекции фаговой ДНК прекращается синтез бактериальных ДНК, РНК и белка, начинается синтез фагов нуклеиновой кислоты и белков. Крупные и сложно организованные после внедрения в клетку фаги индуцируют синтез по крайней мере грех типов ферментов: первый тип - это нуклеазы, функция их состоит в разрушении ДНК клетки-хозяина; ферменты второго типа катализируют образование предшественников синтеза нуклеиновых кислот фага. Третий тип ферментов - это ДНК-полимеразы, РНК-репликазы и транскриптазы. Они катализируют реакции, осуществляющие репликацию и экспрессию фагового генома. Четвертый этап - созревание. В этот период происходит сборка фаговой частицы, соединение ДНК фага с белковой оболочкой. Созревание начинается с уплотнения молекулы ДНК, ее конденсации и укладки. Вскоре на поверхности этой конденсированной ДНК начинают собираться молекулы субъединиц (капсомер) белковой оболочки фага и образуется капсид. К сформированной головке присоединяются отросток и его компоненты. Так образуется зрелая частица фага. Отрезок времени с момента проникновения фаговой ДНК в бактериальную клетку и до полного созревания в ней частиц фага называется латентным, или скрытым, периодом. различают три состояния фага: зрелый фаг (фаг находится вне клетки и способен к заражению чувствительных бактерий), профаг (ДНК фага включена в бактериальную хромосому), вегетативный фаг (фаг находится в клетке в состоянии размножения). Практическое применение фагов. Благодаря своему разрушающему (литическому) действию на бактерии фаги могут быть использованы с лечебно - профилактической целью при различных заболеваниях (дизентерия, холера, различные гнойно-воспалительные заболевания и т. д.). Наборы стандартных фагов, в том числе международные, используются для фаготипирования возбудителей ряда болезней (холеры, брюшного тифа, сальмонеллезов, дифтерии, стафилококковых и других заболеваний). Бактериофаги применяются также в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция). Как правило, таким больным назначаются антибиотики. Как действуют бактериофаги в организме? Они проникают только в определенные клетки и взаимодействуют с их ДНК, создавая лизогенный или литический эффект. Воздействуя на микробы при литическом типе, бактериофаги уничтожают их, что позволяет им быстро размножаться. Лизогенный тип представляет собой проникновение генома фага в геном бактерии, их синтез и дальнейший переход из одного поколения в другое. Эффективность применения бактериофагов состоит в отсутствии противопоказаний и осложнений, сочетаемости с другими лекарствами, активном воздействии на антибиотико-устойчивые микробы. Благодаря этим свойствам, бактериофаги оценены как препараты будущего для успешной борьбы с инфекциями Материальные основы наследственности микроорганизмов. Материальной основой наследственности, определяющей генетические свойства всех организмов, в том числе бактерии и вирусы, является молекула ДНК. Исключение составляют только РНК-содержащие вирусы, у которых генетическая информация закодирована в РНК. Прокариотический геном. У бактерий обычно имеется одна замкнутая хромосома, содержащая до 4000 отдельных генов, необходимых для поддержания жизнедеятельности и размножения бактерий, то есть бактериальная клетка гаплоидна. Внехромосомные факторы наследственности Внехромосомные факторы наследственности бактерий представлены плазмидами, вставочными последовательностями и транспозонами. Плазмиды. Плазмиды – фрагменты ДНК (от 40 до 50 генов). Выделяют автономные (не связанные с хромосомой бактерии) и интегрированные (встроенные в хромосому) плазмиды. Выделяют следующие группы плазмид. F-плазмиды. F-плазмиды контролируют синтез F-пилей, способствующих спариванию бактерий-доноров (F+) c бактериями-реципиентами (F–). R-плазмиды (от англ. resistance, устойчивость) кодируют устойчивость к лекарственным препаратам. Плазмиды патогенности контролируют вирулентные свойства бактерий и токсинообразование(плазмиды включают tox+-гены). Плазмиды бактериоциногении кодируют синтез бактериоцинов - белковых продуктов, вызывающих гибель бактерий того же или близких видов. Виды изменчивости. Модификации и мутация. В процессе изучения изменчивости микроорганизмов была обнаружена особая форма изменчивости – диссоциация. Этот вид изменчивости проявляется в том, что при посеве некоторых культур на плотные питательные среды происходит разделение колоний на два типа: 1) гладкие, круглые, блестящие колонии с ровными краями – S-форма (Smooth – гладкий) и 2) плоские, непрозрачные колонии неправильной формы, с неровными краями – R- форма. Фенотипическая изменчивость представлена модификацией – это ответная реакция клетки на неблагоприятные условия ее существования. Модификации могут касаться морфологических, культуральных, биохимических свойств микробов. Морфологическая модификация изменяет форму и величину микробной клетки. Культуральная модификация обуславливает изменение пигментообразования и размера колоний, скорости деления особей и времени формирования колоний и др. Биохимическая модификация проявляется в возникновении адаптивных ферментов, позволяющих существовать микробным клеткам в определенных условиях. Модификация – это способ приспособления микроорганизма к условиям внешней среды. Поскольку приобретенные свойства не передаются по наследству, они только способствуют в основном выживанию микробных популяций Генотипическая изменчивость возникает в результате изменений, передающихся по наследству. Генотипическая изменчивость представлена мутациями и рекомбинациями. Мутации и рекомбинации – это передаваемые по наследству структурные изменения генов. Мутации возникают в результате влияния внешних факторов (физических и химических). Мутации подразделяются на крупные мутации, обусловленные изменениями во всей хромосоме, и мелкие (точечные) мутации, возникающих в результате изменений отдельных нуклеотидов ДНК. Мутации возникают в результате выпадения или добавления отдельных оснований ДНК, замены одного основания другим или смещения относительно оси симметрии. Микробные мутации делят на спонтанные и индуцированные. В результате мутаций могут изменяться морфологические и культуральные свойства, возникать устойчивость к лекарственным препаратам, снижаться вирулентные свойства, утрачиваться способность синтезировать аминокислоты, утилизировать углеводы и другие питательные вещества. Если мутации возникают под воздействием внешних факторов на генную структуру, то рекомбинационная изменчивость возникает в результате влияния ДНК донора на клетку реципиента. Рекомбинация бывает трех видов: 1. Трансформация, которая возникает в результате способности клетки-реципиента вступить непосредственно в контакт с ДНК донора. 2. Трансдукция, которая обусловлена переносом генетической информации от донора к реципиенту при помощи умеренного фага. С помощью умеренного фага клетке – реципиенту можно передать способность продуцировать токсин, образовывать споры, продуцировать дополнительные ферменты и др. Дифтерийные бактерии типа mitis в результате трансдукции, обусловленной бактериофагом, могут приобрести новые свойства, в результате которых становятся более токсигенными, а следовательно, и более вирулентными. 3. Конъюгация – передача генетического материала от клетки – донора к клетке – реципиенту при непосредственном контакте особей друг с другом. Генетические рекомбинации. Генетические рекомбинации Бактерии способны обмениваться генетическим материалом и, по аналогии с половым размножением, давать начало потомству с новыми свойствами. При этом образуется ДНК, которая содержит гены обеих родительских клеток. Такую ДНК называют рекомбинантной. У потомства, или рекомбинантов, наблюдается заметное разнообразие признаков, вызванное смешением генов. Известны три способа получения рекомбинантов: путем трансформации, трансдукции и конъюгации. Плазмиды. Кроме хромосомных факторов наследственности существуют и внехромосомные. Это плазмиды – сравнительно небольшие внехромосомные молекулы ДНК микробной клетки. Они расположены в цитоплазме и имеют кольцевую структуру. Плазмиды обеспечивают устойчивость бактерий к лекарственным веществам, в том числе и к антибиотикам. Плазмиды – фрагменты ДНК (от 40 до 50 генов). Выделяют автономные (не связанные с хромосомой бактерии) и интегрированные (встроенные в хромосому) плазмиды. Выделяют следующие группы плазмид. F-плазмиды. F-плазмиды контролируют синтез F-пилей, способствующих спариванию бактерий-доноров (F+) c бактериями-реципиентами (F–). R-плазмиды (от англ. resistance, устойчивость) кодируют устойчивость к лекарственным препаратам. Плазмиды патогенности контролируют вирулентные свойства бактерий и токсинообразование(плазмиды включают tox+-гены). Плазмиды бактериоциногении кодируют синтез бактериоцинов - белковых продуктов, вызывающих гибель бактерий того же или близких видов. |
