Практика 2. Коррозия металлов, электролиз (1). Практика. Коррозия металлов и электролиз Теоретический материал и разбор задач
 Скачать 167.5 Kb. Скачать 167.5 Kb.
|
|
Практика. Коррозия металлов и электролиз Теоретический материал и разбор задач План 1. Повторение ранее пройденного материала: Электродные потенциалы и ЭДС. 2. Коррозия металлов. 3. Электролиз. Электродные потенциалы и ЭДС гальванического элемента Если металл опустить в раствор своей соли, то на границе раздела металл-раствор возникает разность потенциалов вследствие перехода заряженных частиц (катионов металла) из одной фазы в другую. Эта разность потенциалов представляет собой так называемый электродный потенциал металла. Потенциал электрода зависит от природы металла, концентрации (активности) его ионов в растворе, а также от температуры. Эта зависимость для разбавленных растворов определяется уравнением Нернста: где eМеz+/Ме – равновесный электродный потенциал, В; eoМеz+/Ме – стандартный электродный потенциал, В; R – универсальная газовая постоянная, равная 8,314 Дж/(моль·К); Т – абсолютная температура, К; z – заряд иона металла; Сm(Меz+) – моляльность потенциалопределяющих ионов металла в растворе, моль/кг; F – постоянная Фарадея, равная округленно 96500 Кл/моль. Переходя от натуральных логарифмов к десятичным и подставляя в уравнение численные значения R и F при температуре 25 оС (Т = 298 К), получаем В гальванических элементах (ГЭ) энергия химической окислительно–восстановительной (ОВ) реакции превращается в электрическую. Простейший ГЭ можно составить из двух металлических пластин, опущенных в растворы солей этих металлов. Растворы помещены в сосуд, разделенный диафрагмой, препятствующей их смешиванию. При замыкании внешней цепи на электроде с более положительным потенциалом протекает процесс восстановления – этот электрод называется катодом. На электроде с более отрицательным потенциалом протекает процесс окисления и он называется анодом. При записи схемы ГЭ границу раздела между металлом (проводник первого рода) и раствором (проводник второго рода) обозначают одной вертикальной чертой, а границу раздела между растворами – двумя чертами. Причем слева записывают материал отрицательного электрода (анода), а справа – материал положительного электрода (катода). Например, схема ГЭ Якоби–Даниэля: Zn|Zn2+||Cu2+|Cu. Электродвижущая сила (ЭДС) гальванического элемента Е равна разности равновесных потенциалов катода и анода при разомкнутой внешней цепи где εок, εоа и Ео – стандартные значения потенциалов катода, анода и ЭДС соответственно; Сox и Cred - концентрации окисленной и восстановленной форм соответственно; z - число электронов, участвующее в токообразующей реакции. Величина ЭДС и энергия Гиббса (G) токообразующей реакции ГЭ связаны между собой соотношением Gр = – zFE. При стандартных условиях Gор = – zFEо. Константа равновесия токообразующей реакции и ЭДС связаны соотношением Пример 1. Напишите уравнение токообразующей реакции, протекающей в серебряно–цинковом элементе Zn ǀ ZnSO4 ǀǀ AgNO3 ǀ Ag. Решение. При работе элемента протекают следующие процессы. На отрицательном электроде (аноде) цинк подвергается ионизации: Znо(т) – 2е– = Zn2+(водн). На положительном электроде (катоде) происходит восстановление ионов серебра: Ag+(водн) + e– = Ago(т) . Суммируя электродные реакции, получим уравнение токообразующей реакции в ионно–молекулярном виде: анод: Znо(т.) – 2е– = Zn2+(водн.) | 1 катод: Аg+(водн.) + e– = Ago(т.) | 2 ––––––––––––––––––––––––––––––––––––– Znо(т) + 2Аg+(водн) = Zn2+(водн) +2Ago(т). В молекулярном виде уравнение токообразующей реакции, протекающей в серебряно–цинковом элементе: Zn + 2 AgNO3 = Zn(NO3)2 + 2Ag. Пример 2. Вычислите потенциал кобальтового электрода при температуре 298 К в растворе, содержащем 10 г соли Со(NO3)2 и 200 мл воды. Решение. Рассчитаем моляльность раствора нитрата кобальта (II): 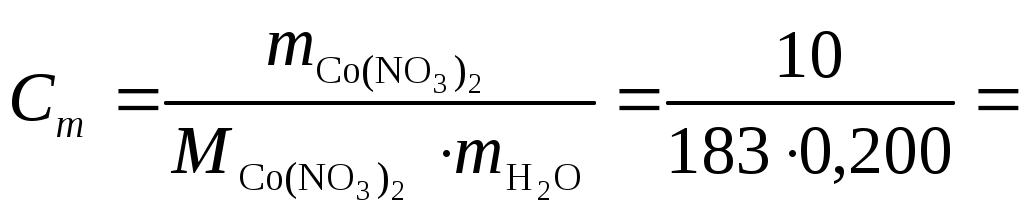 0,273 моль/(1 кг воды). 0,273 моль/(1 кг воды).Электродный потенциал кобальта вычисляем по формуле Нернста. Значение eo находим по таблице стандартных потенциалов (прил. 5). eСо2+/Со = eoСо2+/Со+ Пример 3. Цинковую пластинку опустили в раствор сульфата цинка. При этом электродный потенциал цинка оказался равным –0,822 В. Вычислите моляльность ионов цинка в растворе. Решение. Используя уравнение Нернста, запишем: - 0,822 = – 0,763 + (0,059/2) ·lg Cm (Zn2+); –0,059 = 0,0295·lg Cm (Zn2+); –lg Cm (Zn2+) = – (0,059/0,0295) = –2. Cm (Zn2+) = 10–2 моль/ (1 кг воды). Пример 4. Составьте схему и вычислите ЭДС магний–цинкового гальванического элемента, в котором моляльность ионов Mg2+ составляет 0,01 моль/(1 кг воды), а моляльность ионов Zn2+ равна 0,1 моль/(1 кг воды). Решение. Схема данного гальванического элемента: (–) Mg|Mg2+||Zn2+|Zn (+). Магний имеет меньший стандартный электродный потенциал (– 2,37 В) и является отрицательным электродом (анодом), а цинк, потенциал которого – 0,763 В, является положительным электродом (катодом). Для определения ЭДС гальванического элемента из потенциала катода необходимо вычесть потенциал анода. Потенциал цинкового электрода равен eZn2+/Zn = eoZn2+/Zn + (0,059/z).lgCm (Zn2+) = – 0,763 + (0,059/2).lg 0,1= = - 0,792 В. Потенциал магниевого электрода равен eMg2+/Mg = eoMg2+/Mg + + (0,059/z)·lgCm (Mg2+) = – 2,37 + (0,059/2)·lg 0,01= –2,96 В. Таким образом ЭДС данного гальванического элемента равна Е = eZn2+/Zn – eMg2+/Mg = – 0,792– (– 2,96) = 2,168 В. Пример 5. Для серебряно–цинкового элемента определите стандартное значение ЭДС, используя стандартное изменение энергии Гиббса для токообразующей реакции. Решение. В данном элементе протекает токообразующая реакция Znо(т) + 2Аg+(водн) = Zn2+(водн) + 2Ago(т). Изменение энергии Гиббса для данной реакции: ΔGoр = ΔGoZn2+(водн) – 2ΔGoAg+(водн) = – 147,26 – 2.77,12 = – 301,5 кДж. Так как ΔGор = – z·F·E, то Ео = – ΔGoр / (z·F) = (301,5·103) / (2·96500) = = 1,56 В. 2. Коррозия металловКоррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию. Химической коррозией называется окисление металла, не сопровождающееся возникновением в системе электрического тока. Такой механизм наблюдается при взаимодействии металлов с агрессивными газами при высокой температуре (газовая коррозия) и с органическими жидкими неэлектролитами (коррозия в неэлектролитах). Электрохимической коррозией называется разрушение металла в среде электролита, сопровождающееся возникновением внутри системы электрического тока. Электрохимическая коррозия – это гетерогенная окислительно–восстановительная реакция, в которой анодным процессом является окисление металла, то есть собственно коррозия, а катодным – восстановление окислителей. Для электрохимической коррозии окислителями являются ионы водорода и растворенный в воде кислород. Анодный и катодный процессы не могут протекать в одной и той же точке металлической поверхности и разделены пространственно. Таким образом, корродирующий образец представляет собой короткозамкнутый гальванический элемент, в котором электродами являются катодные и анодные участки поверхности металла. Направление протекания процессов, происходящих в таком гальваническом элементе, определяется стандартными электродными потенциалами соответствующих полуреакций. Электрохимическая коррозия протекает по механизму действия гальванического элемента. На поверхности металла одновременно протекают два процесса: анодный – окисление металла М – nē = Мn+ катодный – восстановление окислителя (Ох): Ох + nē = Red. Наиболее распространенными окислителями при электрохимической коррозии являются молекулы О2 воздуха и ионы водорода Н+ электролита, восстановление которых на катоде протекают по уравнениям: О2 + 2Н2О + 4ē = 4ОН– – в нейтральной или щелочной среде 2Н+ + 2ē = Н2 – в кислой среде. Например, при контакте железа с медью в растворе электролита – соляной кислоты – на аноде идет процесс окисления железа: Fe – 2ē = Fe2+ на катоде – процесс восстановления ионов водорода: 2H+ + 2ē =H2 В результате железо разрушается, а на меди выделяется водород. Схема образующегося при этом гальванического элемента имеет вид: (–) Fe Fe2+HClH2Cu (+) При контакте железа с медью во влажном воздухе (O2 + Н2O) процесс коррозии выражается уравнениями: на аноде: Fe – 2ē = Fe2+ на катоде: O2 + 2Н2O +4ē = 4OH– Схема образующегося гальванического элемента: (–) Fe Fe2+ O2, Н2O OH–Cu (+) Возникающие в результате коррозии ионы Fe2+ соединяются с гидроксильными группами, выделяющимися на катоде: Fe2 + 2OH– = Fe(OH)2. Далее Fe(OH)2 окисляется в Fe(OH)3: 4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3, который частично теряет воду и превращается в ржавчину. Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. Коррозия с участием ионов Н+ называется коррозией с водородной деполяризацией, а с участием молекул О2 – коррозией с кислородной деполяризацией. При атмосферной коррозии – коррозии во влажном воздухе при комнатной температуре – деполяризатором является кислород. Одним из методов защиты металлов от коррозии является использование металлических покрытий. Различают катодные и анодные покрытия. Покрытие защищаемого металла менее активным металлом называется катодным. Катодными, например, являются покрытия на стали из меди, никеля, серебра. При повреждении таких покрытий защищаемый металл становится анодом и окисляется. Покрытие защищаемого металла более активным металлом называется анодным. Анодными, например, являются покрытия на стали из алюминия, цинка, хрома. В этом случае защищаемый металл будет катодом коррозионного элемента, поэтому он не корродирует, а окисляться будет металл покрытия. Эффективным методом защиты от коррозии является протекторная защита. В этом методе к защищаемому металлу присоединяется лист, изготовленный из более активного металла. В результате защищаемое изделие становится катодом, а корродирует металл-протектор (анод). Катодным процессом коррозии может быть восстановление катионов водорода и растворенного в воде молекулярного кислорода. Уравнения процесса восстановления водорода: 2Н+ + 2е– = Н2 в кислой среде; 2Н2О + 2е– = Н2 + 2ОН– в нейтральной и щелочной средах. Потенциал водородного электрода, согласно уравнению Нернста, зависит от рН: Если катодным процессом коррозии является восстановление водорода, то это коррозия с водородной деполяризацией. Восстановление кислорода протекает по схемам: О2 + 4Н+ + 4е– = 2Н2О в кислой среде; О2 + 2Н2О + 4е– = 4ОН– в щелочной среде. Потенциал кислородного электрода: В этом случае коррозия протекает с кислородной деполяризацией. Скорость коррозии можно выразить несколькими способами: 1) объемный показатель коррозии (л/(см2·ч)): где V – объем, л, водорода, выделяющегося за время Dt, ч, на образце площадью S, см2. 2) массовый показатель коррозии (г/(см2·ч)): где Dm – изменение массы, г, корродирующего образца площадью S, см2, за время Dt, ч. Примеры решения задач Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием, во влажном воздухе и в кислом растворе (НС1)? Составьте уравнения анодного и катодного процессов. Приведите схемы образующихся при этом гальванических элементов. Определите состав продуктов коррозии. Решение. Цинк имеет меньшее значение потенциала (–0,763 В), чем кадмий (–0,403 В), поэтому он является анодом, а кадмий – катодом. Следовательно, цинк растворяется, а на поверхности кадмия идет восстановление деполяризатора: в кислом растворе – с водородной деполяризацией, во влажном воздухе – с кислородной деполяризацией. Анодный процесс: Zn – 2ē = Zn2+ Катодный процесс: в кислом растворе 2Н+ + 2ē = Н2 во влажном воздухе О2 + 2Н2О + 4ē = 4ОН– Схема образующегося гальванического элемента во влажном воздухе: (–)ZnZn2+| O2,H2O |OH–Cd(+). Схема образующегося гальванического элемента в кислом растворе: (–)ZnZn2+|НС1|H2Cd(+). Во влажном воздухе ионы Zn2+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Zn(ОН)2, который и является продуктом коррозии. В кислой среде на поверхности кадмия выделяется газообразный водород. В раствор переходят ионы Zn2+. Пример 2 Цинковая пластина находится в контакте с железной в коррозионной среде. Какой из контактирующих металлов будет подвергаться коррозии? Напишите уравнения анодного и катодного процессов с учетом смешанной деполяризации. Решение. Из двух металлов, находящихся в контакте друг с другом, коррозии будет подвергаться металл с меньшим значением электродного потенциала. Так как потенциал цинка равен – 0,763 В, а железа – 0,4 В, то коррозии будет подвергаться цинк. Контактирующие металлы оказывают поляризующее действие друг на друга: металл с меньшим потенциалом поляризуется анодно и скорость коррозии его в месте контакта резко возрастает. Уравнения процесса коррозии: анодный процесс: Zn – 2e– = Zn2+ (на цинке); катодный процесс: 2H+ + 2e– = H2 (на железе); O2 + 4H+ + 4e– = 2H2O (на железе). Пример 3. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадает в кислую среду (НС1)? Приведите уравнения анодного и катодного процессов, схему образующегося гальванического элемента. Каков состав продуктов коррозии? Решение. По положению в ряду напряжений металлов видно, что хром более активный металл (φ0Сr3+/Cr = –0,744 В), чем медь (φ0Сu2+/Cu = 0,337В). В образованной гальванической паре Cr – анод, он окисляется, а Cu – катод, на ее поверхности выделяется (восстанавливается) водород из НС1. Анодный процесс: Cr –3ē = Cr3+ Катодный процесс в кислой среде: 2Н+ + 2ē = Н2 Схема гальванического элемента: (–)CrCr3+HClН2Cu(+) Появляющиеся ионы Cr3+ образуют с хлорид-анионами (из НС1) растворимое соединение – CrC13, на поверхности меди выделяется Н2. Пример 4. С каким видом деполяризации будет подвергаться коррозии свинец в растворе, рН которого равен 4, если стандартный электродный потенциал свинца равен – 0,126 В? Решение. Вид деполяризации при протекания коррозии определяется неравенством eк > ea, вытекающим из условия положительного значения ЭДС коррозии, то есть Е= eк – ea >0. Рассчитаем потенциал катодной реакции: при водородной деполяризации eк = – 0,059рН = – 0,059 . 4 = – 0,236 В; при кислородной деполяризации eк = 1,23 – 0,059·рН = 1,23– 0,059·4 = = 0,994 В. Как видно, условию протекания коррозии удовлетворяет соотношение электродных потенциалов для случая кислородной деполяризации, то есть – 0,126 < 0,994. Поэтому в указанном растворе свинец будет подвергаться коррозии только с кислородной деполяризацией. Электролиз Электролиз – совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита. Сущность электролиза заключается в том, что при пропускании тока через раствор или расплав электролита положительно заряженные ионы перемещаются к катоду (отрицательному электроду), а отрицательно заряженные – к аноду (положительному электроду). Достигнув электродов, ионы разряжаются: у анода восстановитель отдает электроны (в сеть) и окисляется; у катода окислитель присоединяет электроны (из сети) и восстанавливается. Например, при прохождении электрического тока через расплав MgCl2 катионы магния под действием электрического поля движутся к катоду и восстанавливаются на нем до металла: Mg2+ + 2ē = Mg Анионы хлора перемещаются к аноду и окисляются на нем с образованием молекул газообразного хлора: 2С1– – 2ē = С12 Суммарный процесс, протекающий при электролизе, выражается уравнением окислительно-восстановительной реакции: Mg2+ + 2С1– = Mg + С12. При электролизе водных растворов, кроме ионов электролита в окислительно-восстановительном процессе принимают участие молекулы воды. На катоде молекулы воды могут восстанавливаться: 2Н2О + 2ē = Н2 + 2ОН– (φ = –0,41 В), а на аноде – окисляться 2Н2О – 4ē = 4Н+ + О2 (φ = +1,23 В). При электролизе расплавов (например, хлорида меди (II)) катионы Cu2+ будут двигаться к катоду, а анионы Cl–– к аноду. На катоде происходит восстановление катионов: Cu2+ + 2е– ® Cuо. На аноде идет процесс окисления анионов: 2Cl– – 2е– ® Cl2. Суммарное уравнение электролиза расплава хлорида меди (II): CuCl2 ® Cuo + Cl2. В водных растворах кроме ионов самого электролита присутствуют молекулы воды, способные восстанавливаться на катоде и окисляться на аноде. Критерием, определяющим преимущество того или иного электродного процесса, являются значения стандартных электродных потенциалов. Из всех конкурирующих процессов на аноде в первую очередь будет протекать процесс с наименьшим значением потенциала, а на катоде – процесс с большим значением потенциала. На катоде в водных растворах могут восстанавливаться: – ионы металлов (Cu2+ + 2e– ® Cuo); – ионы водорода в кислой среде (2Н+ + 2е– ® Н2); – молекулы воды в нейтральной и щелочной средах (2Н2О + 2е– ® ® Н2+ 2ОН–). Последовательность разряда катионов на катоде представлена на схеме: Li, K, Na, Ca, Mg, A1 < Mn, Zn, Fe, Ni, Sn, Pb < H2 < Cu, Hg, Ag, Pt, Au активные средней активности неактивные не выделяются, выделяются выделяются выделяется Н2 вместе с Н2 в чистом виде 2Н2О + 2е– = Н2 + 2ОН– Меz+ +zе– = Ме Меz+ +zе– = Ме 2Н2О + 2е– = Н2 + 2ОН– Активные металлы, стоящие в ряду активности до Аl включительно, не выделяются из водных растворов, так как легче происходит процесс выделения водорода из молекул воды. Металлы средней активности, стоящие в ряду активности между алюминием и водородом, выделяются на катоде параллельно с водородом. Неактивные металлы, имеющие положительное значение окислительно-восстановительного потенциала, выделяются практически в чистом виде. Если в водном растворе присутствует одновременно несколько катионов металлов, то в первую очередь восстанавливаются (выделяются на катоде) менее активные. На аноде могут окисляться: – анионы некоторых кислот (2SO42– – 2e– ® S2O82–); – молекула воды в нейтральной и кислой средах (2Н2О – 4е– ® 4Н+ + О2); – катионы металлов (Fe2+– e– ® Fe3+); – металл анода (Cuo – 2e– ® Cu2+); – гидроксид–ионы в щелочной среде (4ОН–– 4е– ® 2Н2О + О2). Если анод растворимый, изготовлен из металла более активного, чем платина, то независимо от природы аниона всегда происходит растворение (окисление) металла анода. Если анод нерастворимый, то характер реакций на аноде зависит от восстановительной активности анионов. Последовательность разряда анионов представлена рядом I–, Br–, S2–, C1–, OH– , H2O, > SO42–, NO3–, F– ¬¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ восстановительная активность Г – – е– = Го 2Н2О – 4е– = О2 + 4Н+ Анионы галогенов (Г–) разряжаются (окисляются) на аноде. Кислородсодержащие анионы и фториды не разряжаются из водных растворов, происходит окисление воды, а анионы остаются в растворе. Если в растворе присутствуют несколько анионов галогенов, то в первую очередь должен окисляться более сильный восстановитель. Характер катодного процесса при электролизе водных растворов определяется величиной стандартного электродного потенциала металла. На катоде в первую очередь восстанавливаются катионы, имеющие наибольшее значение электродного потенциала. Если катионом электролита является металл, электродный потенциал которого значительно более отрицательный, чем –0,41 В, то на катоде металл восстанавливаться не будет, а произойдет восстановление молекул воды. Эти металлы расположены в ряду напряжений от Li по Al включительно. Если катионом электролита является металл, электродный потенциал которого значительно положительнее, чем –0,41 В, то из нейтрального раствора такого электролита на катоде будет восстанавливаться металл. Такие металлы находятся в ряду напряжений вблизи водорода (примерно от олова и после него). В случае ионов металлов, имеющих значения потенциала близкие к –0,41 В (Zn, Cr, Fe, Cd, Ni), в зависимости от концентрации электролита и условий электролиза, возможно как восстановление металла, так и выделение водорода, а нередко и их совместный разряд. На анодев первую очередь осуществляется окисление наиболее сильных восстановителей – ионов, имеющих меньшее значение электродного потенциала. Различают электролиз с инертным (нерастворимым) анодом и электролиз с активным (растворимым) анодом. Инертный анод(графит, уголь, платина) не претерпевает окисления в ходе электролиза. При электролизе водных растворов щелочей, кислородсодержащих кислот (HNO3, H2SO4, H3PO4) и их солей (нитраты, сульфаты, ортофосфаты и др.), а также фтороводорода и фторидов на нем происходит электрохимическое окисление воды. Если анионы электролита бескислородны (Сl–, Br–, I–, S2–), то они и разряжаются на аноде в ходе электролиза. Например, 2С1– – 2ē = С12. Активный анодизготовлен из материала, который при электролизе может окисляться по схеме: М0 – nē = Mn+. Рассмотрим несколько случаев электролиза водных растворов солей. Электролиз раствора CuCl2 с инертным анодом В водном растворе хлорид меди (II) диссоциирует: CuС12 = Cu2+ + 2С1–. Стандартный электродный потенциал меди (II) (+0,337 В) существенно выше значения потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде будет происходить разряд ионов Cu2+ и выделение металлической меди. На аноде будут окисляться хлорид-анионы. Катод: Cu2+, Н2О Анод : С1–, Н2О Катодный процесс: Cu2+ + 2ē = Сu Анодный процесс: 2С1– – 2ē = С12 Продукты электролиза – Сu и С12. Электролиз раствора КNO3 с инертным анодом В водном растворе нитрат калия диссоциирует: КNO3 = К+ + NO3–. Стандартный электродный потенциал калия (–2,924 В) значительно ниже значения потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому катионы К+ не будут восстанавливаться на катоде. Кислородсодержащие анионы NO3– не будут окисляться на аноде. В этом случае на катоде и на аноде восстанавливаются и окисляются молекулы воды. При этом в катодном пространстве будут накапливаться ионы ОН-, образующие с ионами К+ щелочь КОН. В анодном пространстве накапливаются ионы Н+, образующие с ионами NO3– кислоту НNO3. Катод: К+, Н2О Анод: NO3–, Н2О. На катоде: 2Н2О + 2ē = Н2 + 2ОН– На аноде: 2Н2О – 4ē = 4Н+ + О2 Продукты электролиза – Н2 и О2. У катода: К+ + ОН– = КОН У анода: Н+ + NO3– = НNO3 Электролиз раствора NiSO4 с никелевым анодом В водном растворе сульфат никеля диссоциирует: NiSO4 = Ni2+ + SO42–. В этом случае окислению подвергается анод, а на катоде процесс протекает так же, как и при электролизе растворов с инертным анодом: Катод: Ni2+, Н2О Анод: SO42–., Н2О, Ni Катодный процесс: Ni2+ + 2ē = Ni Анодный процесс: Ni – 2ē = Ni2+ Законы электролиза 1. Количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества. При превращении одного моля эквивалентов вещества на электроде через него проходит 96500 Кл электричества. 2. Массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов. Количественная характеристика электролиза выражается объединенным законом Фарадея: массы веществ, выделяющихся на электродах, прямо пропорциональны количеству прошедшего электричества, а при одинаковых количествах электричества – пропорциональны их химическим эквивалентам: где m – масса вещества, г; МЭ – молярная масса эквивалента, г/моль; I – сила тока, А; t – время электролиза, с; F– постоянная Фарадея, равная округленно 96500 Кл/моль; k – электрохимический эквивалент, т.е. масса вещества, выделяющаяся на электроде при прохождении одного фарадея электричества (96500 Кл или 26,8 А·ч), г/Кл или г/А.ч. |
