химия. 12 лаб ГД-22вв Омаров М.Б.. Приведены правые части окислительновосстановительных превращений. Запишите эти уравнения реакции полностью
 Скачать 92.39 Kb. Скачать 92.39 Kb.
|
|
Задания Приведены правые части окислительно-восстановительных превращений. Запишите эти уравнения реакции полностью. 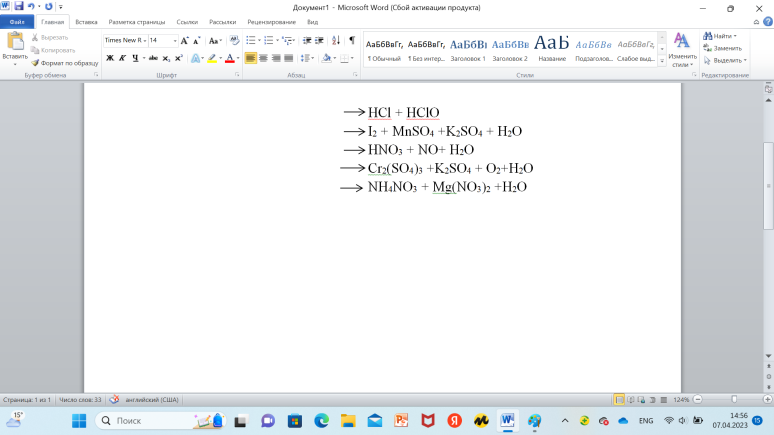 HCIO + HCI → 2CI + H2O Какова масса кристалогидрата Na2SO4∙10H2O, которая останется после испарения 3 кг 10%-ного по массе раствора сульфата натрия. Масса 1 л полученного раствора будет составлять: 1,091 * 1000 = 1091 г. В этом растворе должно содержаться 10\% безводной соли, т.е. 1091 * 10/100 = 109,1 г. Массу Na2SO4*10H2O (мольная масса = 322 г/моль), содержащую 109,1 г безводной соли Na2SO4 (мольная масса = 142 г/моль), найдем из пропорции: 322 : 142 = х : 109,1 х = 322 * 109, 1 : 142 = 247,4 г Масса воды, необходимая для приготовления раствора = 1091 - 247,4 = 843,6 г Объем воды = 843,6 г * 1 г/мл = 843,6 мл. Ответ: m(Na2SO4*10H2O) = 247,4 г V(H2O) = 843,6 мл Определите массовые доли оксида железа (III)и оксида алюминия в смеси, если известно, что при обработке некоторого количества этой смеси избытком раствора щелочи ее масса уменьшилась на 8,0 г, а при восстановлении такого же количества смеси избытком водорода образовалось 10,8 г воды. Определите доли (в мас.%) азотной и серной кислот, совместно присутствующих в растворе, если известно, что при добавлении к 400 г раствора избытка хлорида бария образуется 93,2 г осадка, а для нейтрализации этой же массы раствора кислот потребуется 100 мл 30%-ного по массе растворап NaOH c плотностью p=1,333 г/см3 H2SO4+BaCl2=BaSO4+2HCl n(BaSO4)=93.2/233=0.4моль n(H2SO4)=n(BaSO4)=0.4моль m(H2SO4)=98*0.4=39.2г w(H2SO4)=39.2/400*100=9.8% HCl + HClO I22 + MnSo4 +K2So4 + H2O HNO3+ NO +H2O Cr(So4)3 + K2So4 + O2 +H2+O NH4NO3 + Mg(NO3)2 + H2O |
