Производство кальцинированной соды
 Скачать 398.02 Kb. Скачать 398.02 Kb.
|
Описание технологического процессаПроизводство кальцинированной соды по аммиачному способу включает 8 основных переделов: получение карбонатного сырья: вскрыша, взрывные работы, добыча, дробление, сортировка сырья и транспортирование; переработка карбонатного сырья: обжиг, охлаждение и очистка диоксида углерода, гашение извести с получением известковой суспензии; очистка рассола: взаимодействие сырого рассола с реагентами в реакторах и отстой рассола; абсорбция: отмывка в промывателях газов, выделяющихся на других стадиях, от аммиака, двухстадийное насыщение раствора хлорида натрия аммиаком и частично диоксидом углерода, поступающим со стадии дистилляции, охлаждение аммонизированного рассола; карбонизация: отмывка от аммиака газа, покидающего стадию карбонизации (сопровождается улавливанием диоксида углерода), предварительная карбонизация, карбонизация с выделением гидрокарбоната натрия в осадительных колоннах, компримирование (перед подачей в карбонизационные колонны) диоксид углерода, поступающего со стадий переработки сырья и кальцинации; фильтрация: отделение гидрокарбоната натрия на фильтрах и отсос воздуха вакуум – насосами; кальцинация: обезвоживание и разложение гидрокарбоната натрия в содовых печах, охлаждение и очистка диоксида углерода после содовых печей; регенерация аммиака (дистилляция): предварительный подогрев и диссоциация содержащихся в фильтровой жидкости карбонатов и гидрокарбонатов аммония в конденсаторе и теплообменнике дистилляции, смешение и взаимодействие нагретой жидкости с известковой суспензией в смесителе и отгонка аммиака в дистиллере. Весь содовый процесс полностью может быть изображен следующими химическими уравнениями: NH3+H2O= NH4OH CO2+ H2O=H2CO3 H2CO3+ NH4OH= NH4HCO3+ H2O NH4HCO3+ NaCl=NaHCO3+ NH4Cl 2 NaHCO3→Na2CO3+ H2O+ CO2 CaCO3 → CaO+ CO2 CaO+ H2O= Ca(OH)2 Ca(OH)2+2 NH4Cl= NH4OH+CaCl2 NH3H2O Взаимную связь реакций можно изобразить следующей схемой: CaCO3=CaO+CO2 NaCl + NH3 + CO2 + H2O↔ NH4Cl+ NaHCO3 CaO+ H2O→ Ca(OH)2 –ΔΗ=63,8 кДж/моль Ca(OH)2 +2 NH4Cl→2 NH3 + CaCl2 + H2O+ΔΗ=27,6 NaHCO3→Na2CO3+ CO2+ H2O+ΔΗ Реализация химической модели сопряжена с разработкой технологического режима с использованием физико – химических свойств водной четырехкомпонентной системы. В водном растворе существуют четыре компонента NaCl – NH4HCO3 - NH4Cl – NaHCO3 (независимых компонентов – четыре, ибо если известны значения трех компонентов, то по уравнению реакции можно рассчитать содержание четвертого.) Соль NH4HCO3 образуется в результате взаимодействия в растворе СО2 и NH3: СО2 (p) + 2NH3(p)↔NH2COONH4(p) – ΔΗ1 Образовавшийся карбамат гидролизуется: NH2COONH4(p) + H2O ↔ NH4HCO3(р) + NH3(p) + ΔΗ2 - ΔΗ + ΔΗ= -63,8 кДж Температурный режим избран по результатам исследования реакций, а материальные расчеты и соотношения реагирующих компонентов определены по данным о четырехполюсной системе. Ниже приведены графические методы разработки технологического режима для реакций такого типа. На основании диаграммы (рис.1) устанавливают, что хлорид натрия взаимодействует с бикарбонатом аммония, образуя бикарбонат натрия и хлорид аммония, и растворимость бикарбоната натрия в этой системе мала, так как в равновесном растворе 1 моль бикарбоната растворяется в 4240 молях воды, т.е. практически впадает в твердую фазу. Проекция диаграммы на квадрат солевого состава представлена на рис.2 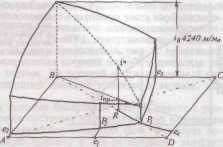 Рис. 3. Система Na+, NH+4║Cl-, HCO3- - H2O, Т 30ºС: А-NaС1; B-NaHCO3; C-NH4HCO3; D - NH4C1; i-количество Н2О - молей воды/1 моль Σ солей; i* -равновесное, inp - практическое R-отношение А : С, вступающих в реакцию; Р – солевой состав раствора 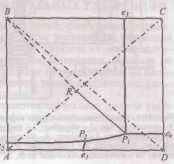 Рис.4. Проекция системы Na+, NH4+║Cl-, HCO-3- H2O, Т 30ºС: А-NaС1; B-NaHCO3; C-NH4HCO3; D - NH4C1; e – солевой состав эвтонических растворов двухкомпонентных систем; Р – нонвариантные точки четырех - компонентной системы; R – солевой состав реакционной смеси Стабильной диагональю солевого квадрата, которая пересекает только два полюса кристаллизации, является диагональ бикарбоната натрия – хлорид аммония, соотношение между реагирующими компонентами выбирают графически по проекции диаграммы, учитывая необходимость получения бикарбоната натрия, не содержащего в твердой фазе аммонийных солей. Иллюстрацией этого приема служит рис 3. Он заключается в создании в растворе несколько увеличенного содержания воды по сравнению с нонвариантной фигуративной точкой Р1, на которую направлен луч кристаллизации. 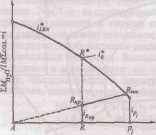 Рис.5 Сечение диаграммы по ARP1: i*LBN – количество воды в равновесном растворе; iR.пр – количество воды в технологическом растворе; ip1 - количество воды в растворе Р1; R – фигуративная точка реакционной смеси. Сущность процесса может быть выражена таким образом, что при обработке насыщенного аммиаком рассола углекислым газом сперва происходит как – бы нейтрализация этого раствора углекислотой, сопровождающаяся значительным выделением тепла, а в дальнейшем, по мере повышения в растворе концентрации средней углеаммониевой соли, начинается ее обменное разложение с поваренной солью с образованием соды, которая при дальнейшем действии на раствор углекислоты образует наименее растворимое соединение – бикарбонат. С практической точки зрения является интересным не только ход реакции и достижение наилучшего выхода бикарбоната, но и качество (физические свойства, структура) получаемого осадка бикарбоната. В заводских условиях, когда выпадение бикарбоната начинается при несколько повышенной температуре, а рост кристаллов – при охлаждении, получается крупно - кристаллический, хорошо отстаивающийся, хорошо фильтрующийся и хорошо промывающийся осадок. Пределом охлаждения на заводах чаще всего является температура 28 – 30ºС, но иногда и ниже – до 25ºС. Структура осадка имеет большое значение, так как легкость и скорость фильтрации и промывки сокращает расход пара на дистилляцию маточных жидкостей, а, кроме того, уменьшает остающуюся в бикарбонате после фильтрации влажность, что в свою очередь облегчает кальцинацию осадка и сокращает расход топлива на этот процесс. Слишком сильное охлаждение вызывает образование очень мелкого, илообразного осадка, который трудно фильтруется и нарушает и удорожает нормальный ход производства. Очистка рассола поваренной соли На содовых заводах сырой рассол очищают от примесей известково – содовым способом. В этом случае для осаждения солей кальция используют соду, для осаждения солей магния – известковую суспензию. В основе известково-содового способа лежат реакции ион ного обмена, приводящие к образованию труднорастворимых карбоната кальция и гидроксида магния: Ca2++CO32-↔CaCO3; Mg2++2OH-↔Mg(OH)2 Полнота выделения ионов магния и кальция в осадок, а сле довательно, степень очистки, определяется растворимостью СаСО3 и Mg(OH)2 в растворе хлорида натрия. Косвенным па раметром, характеризующим полноту выделения Са2+ и Mg2+ в осадок, может служить величина pH, что важно при создании автоматической системы управления процессом очистки. Основными трудностями первой стадии очистки рассола яв ляются низкая скорость сгущения суспензии гидроксида магния и неудовлетворительная скорость фильтрования сгущенной сус пензии. Установлено, что в процессе осаждения происходит образование аморфного (или близкого к аморфному) продукта с довольно высокой растворимостью. Продолжительность его существования зависит от состава маточного раствора, темпера туры и свойств используемой щелочи. Такой продукт представ ляет собой гидратированный гидроксид магния: Mg(OH)2·(Н2О)m. Расстояние между плоскостями спайности у такого гидроксида больше длины молекул воды. Процесс созревания осадка, который может продолжаться несколько суток, можно описать уравнением Mg(OH)2·(Н2О)m→ Mg(OH)2+mН2О; 1 В результате образуется гидроксид магния с хорошими седимен-тационными свойствами, имеющий решетку типа брусита. Необходимо отметить, что с повышением температуры рас сола увеличиваются скорость отстоя и уплотнение суспензии. С другой стороны, повышение температуры нежелательно для последующей стадии производства — абсорбции аммиака. По этому на стадии рассолоочистки температуру рассола поддер живают не выше 22 °С (при большом содержании ионов маг ния). На рис. 6 приведена технологическая схема очистки рассола известково-содовым способом. В бак 1 подают содовый рас твор, для приготовления которого используются кальцинирован ная сода и очищенный рассол. Из гасительного отделения цеха известковых печей в бак 2 поступает известковая суспензия (90 ±10 н. д.). Для регулирования титра известковой суспен зии в мешалку-резервуар 2 подводят очищенный рассол. Далее реагенты поступают в смеситель 3. Технологическая схема отделения очистки Рис. 6 Схема отделения очистки рассола: 1 – бак содового раствора; 2 - бак известкового молока; 3 – смеситель; 4 – расширитель; 5 – реактор; 6 – отстойник; 7 – резервуар очищенного рассола; 8 – сборник шлама; 9 – сборник неочищенного рассола; 10 – насосы. 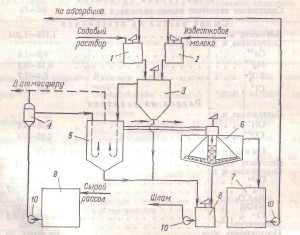 Процесс очистки рассола осуществляется непрерывно. Сырой рассол поступает из рассолопромысла в резервуары — храни лища сырого рассола 9. Основной поток сырого рассола центро бежным насосом 10 через расширитель 4 направляется по тру бопроводу в реактор. В случае необходимости часть сырого рас сола нагревают за счет охлаждения газа содовых печей, после чего смешивают с основным потоком в расширителе. Труба, под водящая жидкость в реактор, имеет U-образную форму. Реактор не имеет мешалки. Требуемое перемешивание достигается за счет большой скорости поступления жидкости из U-образных труб реактора. Для осуществления нормального течения процесса в реак торе температуру пульпы желательно поддерживать в пределах 17±3°С. Реактор соединен трубопроводом с отстойником 6. Суспензия поступает сверху в отстойник и по центральной тру бе, не доходящей до дна, опускается вниз. Затем рассол под нимается вверх, отделяясь от твердой фазы. Осветленный рас сол удаляется из отстойника через переливной желоб, располо женный по периферии. Шлам из нижней части отстойника через специальные трубы периодически спускается в сборник (шламо вую мешалку) 8; сюда же поступает шлам из реактора 5. Осветленный рассол из отстойника 6 направляется в сбор ник 7 и далее насосом 10—на абсорбцию. В мешалке 8 шлам разбавляется водой и насосом 10 перекачивается в шламопроводы дистиллерной жидкости. Обжиг извести и получение углекислого газа На практике для содового процесса углекислый газ добывается путем обжига известняка, при чем параллельно, кроме углекислого газа, получается известь, которая также необходима для аммиачно – содового процесса в виде известкового молока, как щелочь при дистилляции для разложения аммония, содержащихся в маточной жидкости. Известковое отделение является, таким образом, в содовом деле вспомогательным, вырабатывающим полупродукты для главного процесса. Процесс, происходящий в известковом отделении, разделяется на три операции:
Реакцию, происходящую при обжиге мела или известняка, можно изобразить так: CaCO3=CaO+CO2. При обжиге карбонатного сырья наряду с реакциями разложения карбонатов кальция и магния протекает ряд побочных вредных реакций: взаимодействие образующегося оксида кальция с оксидами кремния, алюминия, железа. Последние содержатся в виде примесей в сырье, также входят в состав золы топлива и огнеупорного кирпича, применяемого для футеровки печи. Образующиеся побочные соединения не могут быть использованы для получения известковой суспензии, что снижает эффективность обжига. Кремнезем SiO2 взаимодействует с основными оксидами при 700—800°С с образованием следующих соединений:CaO·SiO2—метасиликат кальция (tпл = 1540°C); 3CaO·2SiO2 - полуторакальциевый силикат (tпл = 1475°С); 2CaО·SiO2— двухкальциевый силикат (tпл = 2130°С); ЗСаО·SiO2 —трехкальциевый силикат (tраэл=1900 °С). Вначале об разуется двухкальциевый силикат, который в избытке СаО в из вести донасыщается с образованием трехкальциевого силиката. Глинозем Al2OS реагирует с СаО в интервале 500—900°С. С ростом температуры образующийся вначале моноалюминат кальция СаО·А12О3 превращается в трехкальциевый алюминат ЗСаО·Al2О3, который обладает способностью переводить из весть в малоактивную форму. Соединения СаО с оксидами алюминия и железа наиболее легкоплавки и играют более важ ную роль при оплавлении извести, чем кремнезем. Сульфат кальция CaSO4 основное свое влияние оказывает на процесс обжига извести, понижая температуру образования жидкой фазы. Примесь сульфата кальция влияет также и на процесс гидратации извести, сильно замедляя его. Оксид маг ния хорошо растворяется в расплаве и заметно понижает тем пературу плавления жидкой фазы. Водяные пары оказывают влияние на процесс диссоциации СаСО3 в области низких температур (650—750ºС). Водяной пар адсорбируется на поверхности кристаллов, облегчая выход активированных ионов за пределы кристаллической решетки. При высоких температурах обжига (1000°С и выше) присутствие водяного пара не оказывает каталитического действия на процесс диссоциации. Оксид кальция, входящий в состав извести, может быть ввиде свободного (активного или неактивного) либо связан ного, т. е. вступившего во взаимодействие с примесями и обра зовавшего новые соединения (безвозвратные потери СаО). Активный СаО — это часть свободного оксида кальция, ко торая способна реагировать с водой в обычных условиях га шения; неактивный СаО —часть свободного оксида кальция, ко торая не реагирует с водой в обычных условиях гашения, Неактивный СаО образуется вследствие структурных измене ний под воздействием высоких температур, а также за счет об волакивания зерен СаО пленкой плава, который появляется при взаимодействии СаО с примесями. При этом усиливается взаимодействие СаО с футеровкой печи. При повышении темпера туры выше допустимой может произойти образование более или менее крупных масс спекшейся извести («козлы»), что нару шает режим работы печей. Горение твердого топлива в слое кускового материала имеет следующие особенности: отсутствует сплошной горящий слой (отдельные куски топлива разделены инертной к горению массой обжигаемого материала, так как в шихте содержится от 6,5 до 10 % топлива); 2)поглощение тепла, затрачиваемого на разложение карбонатов, происходит непосредственно в зоне горения; 3)горение осуществляется в потоке воздуха, нагретого в зоне подогрева; 4)куски топлива, уменьшаясь в процессе горения, опере жают движущийся слой обжигаемого материала, что существенно сказывается на процессе горения в целом; 5)летучие вещества топлива, выделяющиеся в зоне подготовки топлива, контактируют с потоком горячих газов, почти не содержащих кислород, и отгоняются, не сгорая. 1.Работа печей. Обжиг мела или известняка происходит в шахтных печах. Она состоит из трех основных механизмов – шахты, загрузочного и разгрузочного механизмов (рис. 7), в которых сверху печей производится загрузка смеси определенной пропорции известняка и твердого горючего. В случае последнего применяется кокс. Под влиянием происходящей снизу печи выгрузки извести, вышеуказанная смесь известняка и кокса опускается постепенно сверху вниз. В верхней части печи происходит обмен теплоты между отходящими газами и загруженной смесью, при чем известняк сушится, а газы охлаждаются. По мере опускания смеси, она поступает в зону наиболее интенсивного горения кокса, и здесь происходит окончательный обжиг мела с выделением угольной кислоты. Мел, превратившись в известь, опускается вниз, и по пути следования последней происходит вторичный обмен теплоты между горячею известью и поступающим снизу воздухом, необходимым для процесса горения топлива. Известь при этом охлаждается, а воздух нагревается. Печи работают под давлением воздуха, нагнетаемого вентилятором в закрытую нижнюю часть печи. 2. Разница давлений. Давление внизу печи должно регулироваться задвижкой на нагнетательной трубе вентилятора так, чтобы давление газа, выходящего из печи, составляло бы 5 мм водного столба, количество же его соразмеряется с анализом углекислого газа во избежание избытка или недостатка воздуха. Такое давление наверху печи гарантирует отсутствие засасывания воздуха извне, которое иначе могло происходить при открывании верхнего отверстия печи для загрузки, хотя, с другой стороны, вызывает некоторую утечку газа из печи при загрузке. Рис.7 Шахтная известково – обжигательная печь: 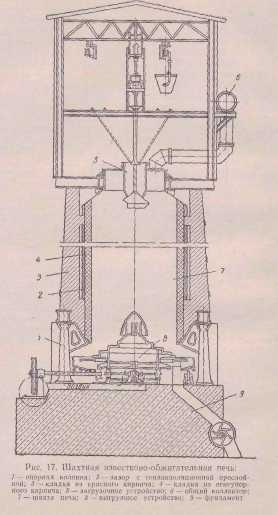 1 – опорная колонна; 2 – зазор с теплоизоляционной прослойкой; 3 – кладка из красного кирпича; 4 – кладка из огнеупорного кирпича; 5 – загрузочное устройство; 6 – общий коллектор; 7 – шахта печи; 8 – выгрузное устройство; 9 – фундамент. Вдувание в печь воздуха создает кроме того преимущество в том отношении, что повышается интенсивность горения, увеличивается производительность печи, повышается процентный состав углекислого газа и создается некоторая независимость работы печи от работы компрессора. При одной и той же производительности печи увеличение разницы давления воздуха между нижней и верхней частью служит указанием того или иного качества загружаемых в печь материалов. Нормальным размером загружаемых в печь мела и кокса является: для мела - куски, диаметром 120 – 150 мм, а для кокса – куски, диаметром 50 – 60 мм. Увеличение разницы давлений указывает на присутствие в загруженном в печь материале слишком большого количества мелких кусков, которая может вызвать уменьшение производительности печи, вплоть до полного затухания, уменьшение же разницы давлений на слишком большую величину кусков загруженного материала и может вызвать плохое использование топлива и тем самым явлением недопала и понижение концентрации углекислого газа. Нормальная разность давления лежит в пределах 20 – 25 мм водяного столба. 3. Разница температур. Показателем правильного горения в печи служит также температура извести внизу печи и температура газа, выходящего из печи. При нормальной работе температура извести внизу печи равна 45 - 55ºС, а температура выходящего газа сверху печи – 130 - 150ºС. При ненормальной работе печи могут быть следующие отклонения:
а) либо в загрузочном мелу находится много частиц мелкого размера; при загрузке в печь такого материала большие куски отбрасываются распределительным аппаратом по периферии, а мелочь собирается преимущественно в середине. Воздух, вгоняемый вентилятором, проходит большею своею частью по периферии и тем самым поднимает зону горения. В центре же, вследствие недостатка воздуха, зона горения получает конусообразную форму; б) либо в печи образовались у стенок козлы, которые в одном месте задерживают проход воздуха внизу, понижая зону горения, а в других местах пропускают больше воздуха и поднимают зону горения вверх. Громадное значение для поддержания концентрированной зоны горения в печи на нормальной высоте имеет равномерная периодичность загрузки печи, поддержание постоянного горизонта материала наверху печи и тщательная подготовка смеси мела и кокса; в) значительный процент мелочи на нормальный размер кусков топлива, загруженного в печь. Мелкие куски загораются вверху скорее, а более крупные сгорают значительно ниже, и таким образом зона горения растягивается. |
