производство метанола. Производство метилового спирта
 Скачать 385.87 Kb. Скачать 385.87 Kb.
|
30 т/сут. метанола на двух небольших агрегатах Новомосковского химического комбината. Сырьем для производства метанола служил водяной газ, полученный газификацией кокса. В настоящее время основное количество метанола вырабатывается на базе природного газа. Процесс синтеза осуществляется при 250—300 кгс/см2 и 380 °С.Несмотря на токсичность, метанол находит широкое применение как в органической химии – в качестве растворителя, так и в газовой промышленности – для борьбы с образованием гидратов. В органическом синтезе метанол применяют для получения формальдегида, формалина, уксусной кислоты, эфиров, изопрена и других. Часть спирта идет на производство формальдегида, который далее используется для производства карбамидоформальдегидных и фенолформальдегидных смол. Так же CH3OH используют в лакокрасочной промышленности по изготовлению растворителей при производстве лаков. Кроме того, его применяют как добавку к жидкому топливу для двигателей внутреннего сгорания. Метанол используется для заправки гоночных автомобилей и мотоциклов, так как он горит в воздушной среде, и при его окислении образуется двуокись углерода и вода. При совместном использовании метанола с растительным маслом получают – биодизель. Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. Из вышесказанного видно, что метиловый спирт имеет значительные масштабы производства и применения во многих направлениях. Предприятия по выпуску метанола размещены в различных экономических районах страны, поэтому и виды используемого сырья различны. Наиболее дешевый метанол получают при использования в качестве сырья природного газа. Это и стимулирует перевод предприятий метанола на природный газ. Несмотря на достигнутые успехи, производство метанола продолжает совершенствоваться. Разрабатываются более активные и селективные катализаторы, а также совершенствуются цинк-хромовые катализаторы, методы получения и подготовки исходного технологического газа, аппаратурное оформление процесса. Более полно используется тепло, выделяющееся при синтезе метанола. Разрабатываются технологические схемы на основе прогрессивной техники. Новые мощные агрегаты синтеза метанола производительностью до 30 тыс. т/г в энергетическом отношении будут автономны—для ведения процесса практически не потребуется подводить извне энергию и пар. Одновременно с созданием крупных одноагрегатных установок с использованием низкотемпературных катализаторов в мировой практике имеются примеры создания крупных агрегатов, работающих при высоком давлении (250— 350 кгс/см2). Однако в мировой и отечественной практике ввиду технико-экономических преимуществ намечается развитие схем производства метанола при низком давлении 50—150 кгс/см2. 2.Исходное сырье Метанол по значению и объемам производства является одним из важнейших многотоннажных продуктов, выпускаемых современной химической промышленностью. В качестве сырья для получения метанола могут использоваться: природный газ, синтез-газ производства ацетилена, газы нефтепереработки, твердое топливо. Метанол получают различными методами, отличающимися исходным сырьем, способами его переработки в технологический газ, а также условиями проведения синтеза метанола. В настоящее время основной способ получения метанола – синтез из оксида углерода и водорода (эта смесь называется синтез-газом). Смесь окиси углерода и водорода производят путем конверсии метана. Синтез метанола по физико-химическим условиям его проведения и по технологическому оформлению аналогичен синтезу аммиака. Как азото-водородную смесь, так и синтез-газ можно получить конверсией природного газа. В обоих процессах взаимодействие смесей тщательно очищенных газов происходит в присутствии катализатора. Из-за малого выхода конечных продуктов и тот и другой процессы являются непрерывно циклическими, причем реакцию никогда не ведут до полного превращения. Такая аналогия дала возможность вести оба синтеза на подобных установках, которые монтируют в составе одного завода. Исходным сырьем в процессе синтеза метанола является газ после паро-кислородной конверсии метана, а также технический водород, применяемый для регулирования соотношения Н2:СО. К составу сырья предъявляются общин требования: наличие примесей – СН4 0.5%, СО2 2.2%, Н2S 2.0 мг/м3, карбонилы железа 3.0 мг/м3. Процесс получения метанола состоит из следующих стадий: 1. Парокислородной конверсии природного газа в шахтном конверторе. 2. Очистке конвертированного газа от углекислоты до получения газа с функционалом f = (Н2 –СО2) /(СО +СО2) =2.05 -2.20 3. Осушке конвертированного газа на алюмогеле. 4. Компримировании свежего газа до давления не более 9.3 МПа. 5. Синтез метанола – сырца. 6. Ректификация метанола – сырца. 1. Паро-кислородная конверсия метана. Процесс получения технологического газа ведется в одну стадию методом паро-кислородной конверсии метана в шахтном конверторе на никелевых катализаторах при температуре 850-12000С. 3.Характеристика целевого продукта 3.1 Физические свойства Метанол — CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость. Температура кипения – 64,5; температура плавления – 97,9; плотность – 0,79 г/см в кубе. На организм человека метанол действует опьяняющим образом и является сильным ядом, вызывающим потерю зрения и, в зависимости от дозы, смерть. Физические характеристики метанола при нормальных условиях: Молекулярный вес - 32,04; Плотность, г/см8 - 0,8100; Вязкость, мПа-с -0,817 Теплота парообразования, ккал/моль - 8,94 3.2 Химические свойства метилового спирта При взаимодействии метанола с щелочными металлами гидроксильный водород замещается металлом 2CH3OH + 2Na -> 2CH3ONa + H2 Метанол реагирует с минеральными и карбоновыми кислотами. При этом образуются сложные эфиры CH3OH + CH3COOH CH3COOCH3 + H2O Метанол может реагировать с галогенов водородными кислотами, галогенидами фосфора CH3OH + HCl CH3Cl + H2O С аммиаком метанол образует метиламины: СНзОН + NH3 ——> CH3NH2 + Н2О СНзОН + СНзNН2 ——> (CH3)2NH2 + Н2О CH3OH + (СНз)2NH2 ——> (СН3)3NH2 + Н2О Эти реакции протекают в паровой фазе в присутствии катализаторов при 370—400 °С и повышенных давлениях.. Дегидратацией на катализаторе при повышенных температурах получают диметиловый эфир: 2СН3ОН ——> (СНз)2О + Н2О При взаимодействии метанола и минеральных кислот образуются сложные эфиры. .Этот процесс называется этерификацией, и его широко используют в промышленной практике для получения различных метиловых эфиров — метилхлоридов, метилбромидов, метилнитратов, метилсульфатов и др.: СНзОН + H2SO4 ——>- СНзSОзОН + Н2О ГОСТ 2222-95, Метанол технический Настоящий стандарт распространяется на технический метанол, получаемый каталитическим синтезом из оксидов углерода и водорода, и устанавливает требования к метанолу, предназначенному для использования в химической, лесохимической, фармацевтической, нефтяной, газовой, микробиологической и других отраслях промышленности, а также для поставки на экспорт. 4.Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производства 4.1 Основные реакции химическая схеиа: Синтез метанола основан на обратимой реакции, описываемой уравнением: СО + 2Н2 Реакция – обратима, экзотермична и протекает с уменьшением объема. С термодинамической точки зрения для смещения равновесия в сторону образования метанола необходимо проводить процесс при низких температурах и высоком давлении. Однако, для увеличения скорости реакции необходимо повышение температуры. При этом выбирая температурный режим, следует учитывать образование побочных продуктов: метана, высших спиртов, кетонов и эфиров. 4.2 Приведем некоторые побочные реакции: СО2 +3Н2 СО + 3Н2 = СН4 + Н2О 2СО + 4Н2 = (СН3)2О + Н2О 4СО + 8Н2 = С4Н9ОН + 3Н2О 2СО = СО2 + С т.е. процесс получения метанола является сложным. Побочные реакции обуславливают бесполезный расход синтез-газа и удорожают очистку метанола. Свежий и циркулирующий газ смешиваются в смесителе и поступают в колонну синтеза. После конденсации и отделения жидкого метанола-сырца в сепараторе газ возвращается в смеситель. Во избежание накапливания инертных примесей в циркулирующем газе часть газа выводят из системы. Метанол – сырец поступает на ректификацию. Содержание СН3ОН в ректификате составляет 99,5% (по массе). 4.3 Температура: Процесс синтеза метилового спирта в зависимости от температурного режима работы катализатора может быть осуществлен в двух вариантах А) высокотемпературный ( катализатор 2,5ZnO*ZnCr2O4, температура 370-420, давление 20-35 МПа); Б) низкотемпературный ( катализатор ZnO*CuO*Al2O3 или ZnO*CuO*Cr2O3, температура 250-300, давление 5-10 МПа) 4.4 Катализатор: Применяемый для синтеза метанола катализатор должен обладать высокой селективностью, т.е. максимально ускорять образование метанола при одновременном подавлении побочных реакций. Для синтеза метанола предложено много катализаторов. Лучшими оказались катализаторы, основными компонентами которых являются оксид цинка или медь. Катализаторы синтеза метанола весьма чувствительны к каталитическим ядам, поэтому первой стадией процесса является очистка газа от сернистых соединений. Сернистые соединения отравляют цинк-хромовые катализаторы обратимо, а медьсодержащие катализаторы – необратимо. Необходима также тщательная очистка газа от карбонила железа, который образуется в результате взаимодействия оксида углерода с железом аппаратуры. На катализаторе карбонил железа разлагается с выделением элементного железа, что способствует образованию метана. Таким образом, процесс получения метанола является гетерогенно-каталитическим. Лимитирующая стадия – адсорбция водорода на поверхности катализатора. 5.Описание технологической схемы процесса Рассмотрим два варианта производства метанола 5.1 Процесс при 32МПа: Технологический процесс получения метанола из оксида углерода и водорода включает ряд операций, обязательных для любой технологической схемы синтеза. Газ предварительно очищается от карбонила железа, сернистых соединений, подогревается до температуры начала реакции и поступает в реактор синтеза метанола. По выходе из зоны катализа из газов выделяется образовавшийся метанол, что достигается охлаждением смеси, которая затем сжимается до давления синтеза и возвращается в процесс. 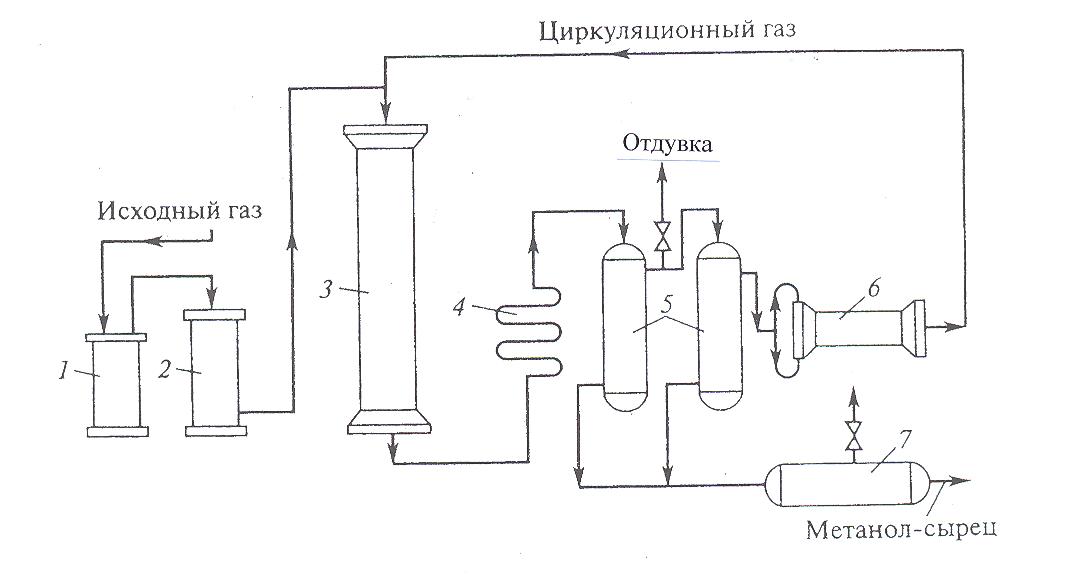 Технологическая схема получения метанола при давлении 32 МПа: 1, 2 – фильтры (масляный и угольный), 3 – колонна синтеза, 4 – холодильник-конденсатор, 5 – сепараторы, 6 – компрессор, 7 – сборник метанола-сырца. Описание технологической схемы получения метанола при давлении 32 МПа. Сжатый до 32 МПа синтез-газ очищается в масляном фильтре 1 и в угольном фильтре 2, после чего смешивается с циркуляционным газом и поступает в колонну синтеза 3. Смещанный газ (на схеме – синтез-газ), пройдя через кольцевой зазор между катализаторной коробкой и корпусом колонны 3 (рис.11) (колонна синтеза метанола высокого давления – рис.13), поступает в межтрубное пространство теплообменника, расположенного в нижней части колонны (рис.13). В теплообменнике 1 (рис.13) газ нагревается до 330-3400 С и по центральной трубе, в которой размещен электроподогреватель 3 (рис.13), поступает в верхнюю часть колонны и проходит последовательно пять слоев катализатора 4 (рис.13). После каждого слоя катализатора, кроме последнего, в колонну синтеза вводят определенное количество холодного циркуляционного газа (холодный байпас) 2 (рис.13)для поддержания необходимой температуры (проведение процесса синтеза метанола по ЛОТ). После пятого слоя катализатора контактный газ направляется в теплообменник, где охлаждается до 300-385 0С 130 0С, а затем в холодильник-конденсатор типа «труба в трубе» 4 (рис.11). Здесь газ охлаждается до 30-35 0С и продукты синтеза конденсируются. Метанол-сырец отделяют в сепараторе 5 и направляют в сборник 7, после чего выводят на ректификацию. Газ проходит второй сепаратор 5 для выделения капель метанола, компримируется до давления синтеза турбоциркуляционным компрессором 6 и возвращается на синтез. Продувочные газы выводят перед компрессором и вместе с танковыми газами используют в качестве топлива. 6 пункт Колонна синтеза метанола 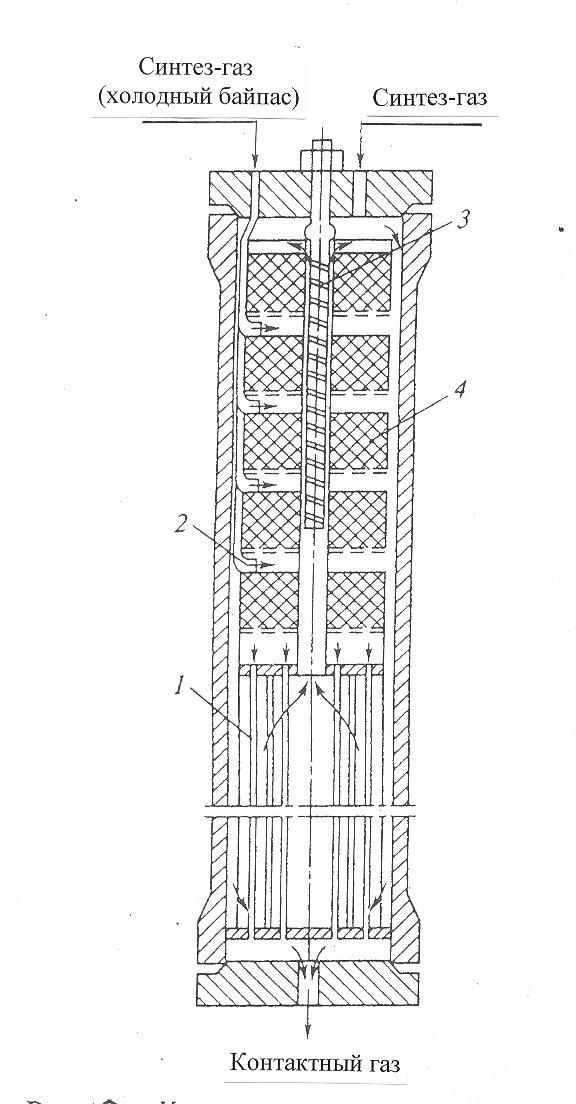 Колонна синтеза метанола при 32 МПа: 1 – теплообменник; 2 – холодный байпас; 3 –электроподогреватель; 4 - катализатор 5.2 Процесс при 5МПа: 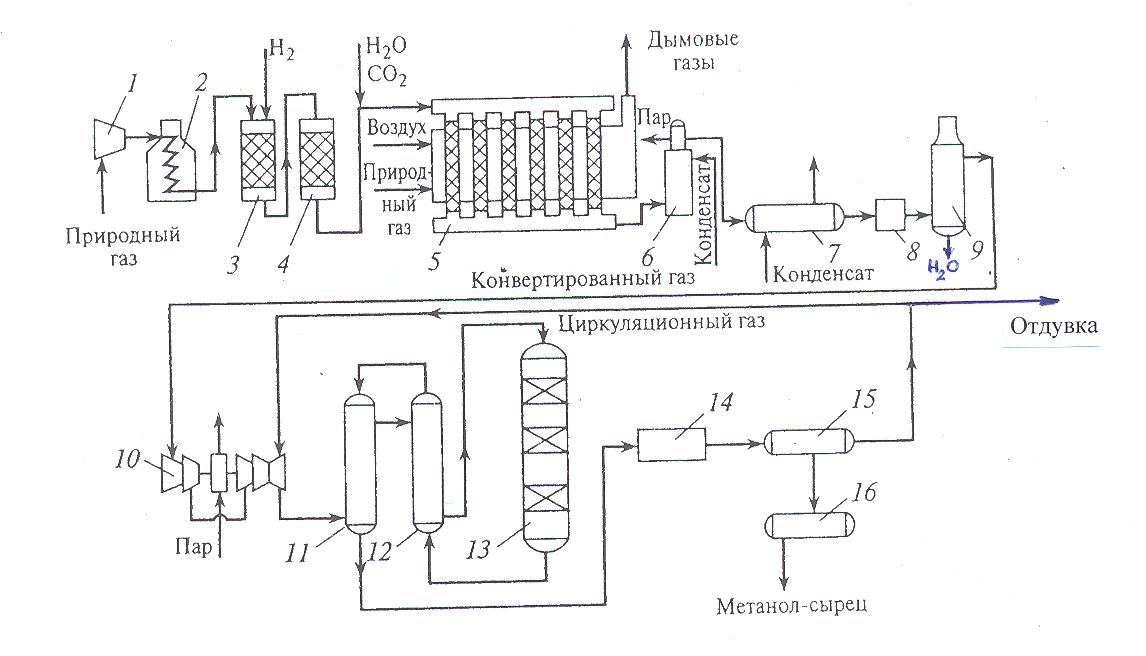 1, 10 –турбокомпрессоры, 2 –подогреватель природного газа, 3 –реактор гидрирования сернистых соединений, 4 –адсорбер, 5 –трубчатый конвектор, 6 –котел-утилизатор, 7, 11, 12 –теплообменники, 8, 14 –холодильники-конденсаторы, 9, 15 –сепараторы, 13 –колонна синтеза, 16 –сборник. Описание технологической схемы получения метанола при давлении 5МПа Природный газ сжимается турбокомпрессором 1 до давления 3 МПа, подогревается в подогревателе 2 за счет сжигания в межтрубном пространстве природного газа и направляется на сероочистку в аппараты 3 и 4, где последовательно осуществляется каталитическое гидрирование органических соединений серы на алюмокобальтмолибденовом катализаторе и поглощение образующегося сероводорода адсорбентом на основе оксида цинка. После этого газ смешивается с водяным паром и диоксидом углерода в соотношении СН4 : Н2О : СО2 = 1 : 3,3 : 0,24. Смесь направляют в трубчатый конвертор 5, где на никелевом катализаторе происходит паро-углекислотная конверсия при температуре 850 - 870 0С. Теплоту, необходимую для конверсии, получают в результате сжигания природного газа в специальных горелках. Конвертированный газ поступает в котел-утилизатор 6, где охлаждается до 280 - 290 0С. Теплоту выходящего газа используют в теплообменнике 7 для подогрева питательной воды, направляемой в котел-утилизатор. Пройдя воздушный холодильник 8 и сепаратор 9, газ охлаждается до 35-40 0С. Охлажденный конвертированный газ сжимают до 5 МПа в компрессоре 10, смешивают с циркуляционным газом и подают в теплообменники 11, 12, где он нагревается до 220-230 0С. Нагретая газовая смесь поступает в колонну синтеза 13, температурный режим в которой регулируют с помощью холодных байпасов (проведение процесса синтеза метанола по ЛОТ). Далее газовая смесь охлаждается в холодильнике-конденсаторе 14, сконденсировавшийся метанол-сырец отделяется в сепараторе 15 и поступает в сборник 16. Циркуляционный газ возвращается на синтез, продувочные газы отдают на сжигание в трубчатую печь. В 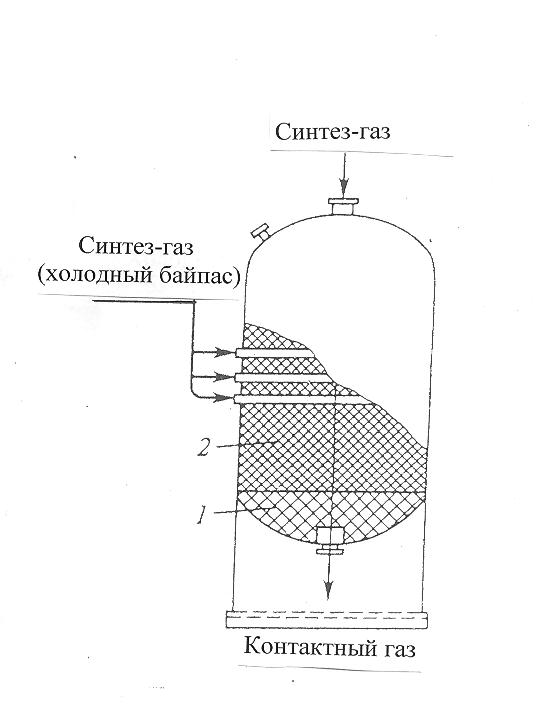 следствие снижения температуры синтеза при низком давлении процесс осуществляется в условиях, близких к равновесию, что позволяет увеличить производительность агрегата. следствие снижения температуры синтеза при низком давлении процесс осуществляется в условиях, близких к равновесию, что позволяет увеличить производительность агрегата.Колонна синтеза метанола при 5 МПа: 1- фарфоровые шары; 2 – катализатор 5.3 Функциональная схема производства метанола Технологический процесс получения метанола из оксида углерода и водорода включает ряд операций, обязательных для любой технологической схемы синтеза. Газ предварительно очищается от карбонила железа, сернистых соединений, подогревается до температуры начала реакции и поступает в реактор синтеза метанола. По выходе из зоны катализа из газов выделяется образовавшийся метанол, что достигается охлаждением смеси, которая затем сжимается до давления синтеза и возвращается в процесс. 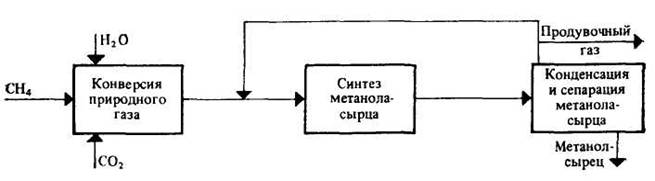 5.4 Структурная блок-схема 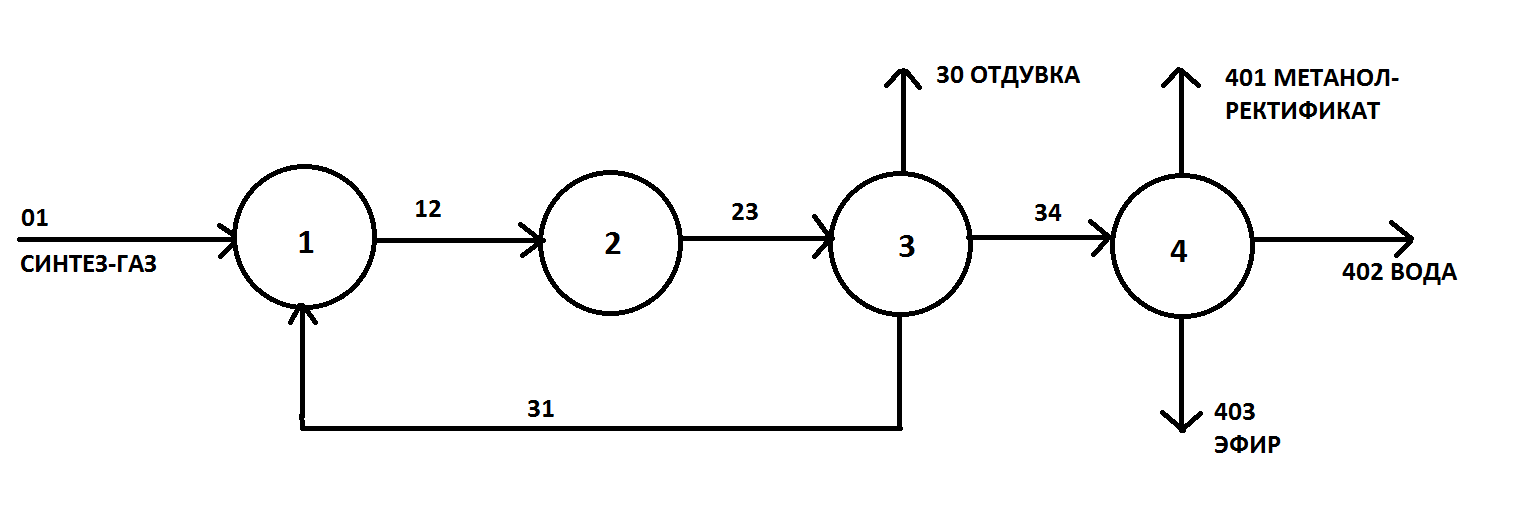 Потоки: 01 - свежий газ; 12 - Смесь газов; 23,34 – смесь продуктов; 31 – циркуляционный газ; 30 – отдувочный газ; 401 – метанол-ректификат; 402 – вода; 403 – эфир. Блоки: 1 – смешение; 2 – синтез; 3 – конденсация и сепарация; 4 – ректификация. 6.Расчет материального баланса ХТС 6.1 Условно-постоянная информация для расчета Производство метанола основано на реакции: СО + 2Н2 Одновременно протекают побочные реакции: СО + 3Н2 = СН4 + Н2О 2СО + 4Н2 = (СН3)2О + Н2О 6.2 Исходные данные для расчёта. Вариант №4.
6.3 Балансовая математическая модель 1) N01CO+N31ɣ31CO=N12CO 2) N01H2+ N31ɣ31H2= N12H2 3) N12CO(1-X)= N31ɣ31CO+ N30ɣ31CO 4) N12H2=2N12COX(ɣ403(CH3)2O+φCH3OHCO)+ N31ɣ31H2+ N30ɣ31H2+3 N12COXφCH4CO 5) (ПCH3OH ɷCH3OH)/MCH3OH = N12COXφCH3OHCO 6) N30ɣ31CH4 = (( N01H2+ N01CO)/(1- ɣ01СH4)) ɣ01СH4+ N12COXφCH4CO 7) N403 = 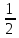 N12COXφ(CH3)2OCO N12COXφ(CH3)2OCO8)G402 = N12COXφCH4CO MH2O + 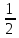 N12COXφ(CH3)2OCOMH2O – П(1-ɷCH3OH) N12COXφ(CH3)2OCOMH2O – П(1-ɷCH3OH)6.4 Соответствие переменных потокам
6.5 Матрица
6.6 Материальный баланс ХТС производства метилового спирта в расчёте на 1500 кг
8.Список использованной литературы 1. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология: Учебн. для вузов – 3-е изд., перераб.– М.: ИКЦ «Академкнига», 2003. – 528 с. 2. Брук Л.Г., Егорова Е.В., Киричек И.Д., Кононова Г.Н., Сафонов В.В., Смирнова С.Н., Цыганков В.Н., Чабан Н.Г., Шварц А.Л., Устюгов А.В., Путин А.Ю. Основы химической технологии. Лабораторный практикум. Учебное пособие – 4-е издание, исправленное и дополненное – М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2013. – 173 с. 3. Шварц А.Л., Брук Л.Г. Основы термодинамики и кинетики гомогенных процессов. Учебное пособие. - М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2012. – 56 с.: ил. 4. Кононова Г.Н. Цыганков В.Н. Графические изображения химико-технологических систем Учебное пособие. - М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2007. 5. Общая химическая технология и основы промышленной экологии: учебник для студентов вузов / Под ред. В.И. Ксензенко. 2-е изд., стер. М.: КолосС, 2003. – 328 с. 6. Соколов Р.С. Химическая технология. В 2-х томах. – М.: Гуманитарный издательский центр ВЛАДОС, 2000. Т. 1 – 367 с., Т. 2 – 447 с. 7. Кононова Г.Н. ,Сафонов В.В., Цыганков В.Н. Технологические принципы разработки химико-технологических систем. Учебное пособие - М.: ИПЦ МИТХТ им. М.В.Ломоносова, 2003. - 57 с. 8. Кононова Г.Н., Сафонов В.В. Химико-технологические системы. - М.:ИПЦ МИТХТ им. М.В. Ломоносова, 2005. – 66 с 9. Кононова Г.Н., Сафонов В.В., Егорова Е.В. Расчет материального баланса химико-технологических систем интегральным методом. Учебно-методическое пособие.–М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2007. – 31 с. 10. Брук Л.Г., Егорова Е.В., Кононова Г.Н., Сафонов В.В., Смирнова С.Н., Чабан Н.Г., Шварц А.Л. Сборник заданий и методических указаний по расчёту материального баланса химико-технологических производств. Учебно-методическое пособие. Под ред. Брука Л.Г., Кононовой Г.Н., Сафонова В.В. Изд. 3-е перераб. – М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2008. – 72 с. 11. Кононова Г.Н., Сафонов В.В. Производство этилового спирта прямой гидратацией этилена. Учебное пособие. Издание 3-е, перераб.– М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2006. – 26 с. 12. Шварц А.Л., Брук Л.Г. Конверсия метана в технологические газы. Учебное пособие. – М.: МИТХТ им. М.В. Ломоносова, 2012. – 32 с.: ил. 13. Кузнецова И.М., Харлампиди Х.Э., Иванов В.Г., Чиркунов Э.В. Общая химическая технология. Методология проектирования химико-технологических процессов / под ред. Х.Э. Харлампиди: Учебник.- 2-е изд., перераб. – СПб.: Издательство «Лань», 2013. – 448 с.: ил. – Электронный ресурс: http://e.lanbook.com/view/book/37357/ 14. Кузнецова И.М., Харлампиди Х.Э., Иванов В.Г., Чиркунов Э.В. Общая химическая технология. Основные концепции проектирования химико-технологических систем: Учебник / под ред. Х.Э. Харлампиди: - 2-е изд., перераб. – СПб.: Издательство «Лань», 2014. – 384 с.: ил. – Электронный ресурс: http://e.lanbook.com/view/book/45973/ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

