Основные физико-химические свойства воды. расширением. Затвердевая, вода становится менее плотной
 Скачать 210.77 Kb. Скачать 210.77 Kb.
|
|
Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4 градусов по Цельсию плотность ее увеличивается. При 4 градусах вода имеет максимальную плотность. При дальнейшем нагревании ее плотность снова уменьшается. Замерзание воды сопровождается не сжатием (как у других жидкостей), а наоборот – расширением. Затвердевая, вода становится менее плотной – поэтому лед плавает, а не тонет. Лед тем самым защищает нижележащие слои воды от дальнейшего охлаждения и замерзания. Таким образом, жизнь в воде продолжается. Высокая, по сравнению с соединениями водорода с похожим молекулярным весом, температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг). Высокая теплоёмкость жидкой воды. В ночное время, а также при переходе от лета к зиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, самым главным регулятором температуры на земном шаре. Высокая вязкость. Высокое поверхностное натяжение. Вода практически несжимаема. Отрицательный электрический потенциал поверхности воды. Особенности физических свойств воды обусловлены водородными связями. Молекула воды несимметрична: три ядра образуют равнобедренный треугольник с ядрами водорода в основании и ядром кислорода в вершине (радиус молекул воды значительно меньше внутримолекулярного расстояния, т.е. молекулы воды “упакованы” не слишком плотно). 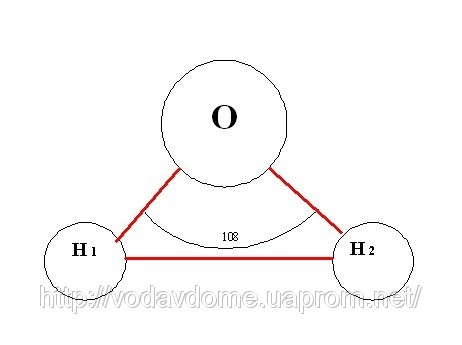 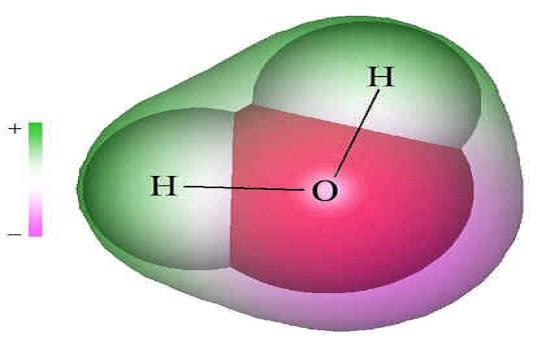 Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода, тогда как 2 атома водорода в сумме формируют достаточно большую "площадь» распределения положительного заряда в "углах" молекулы. Несколько таких диполей будут образовывать структуры типа: Н2О...Н2О с водородной связью, когда между двумя атомами водорода будет втянут атом кислорода соседней молекулы. При этом общее распределение потенциала будет стремиться к минимизации взаимодействия с внешней средой, следовательно, молекулы воды будут располагаться в пространстве с чёткой ориентацией, в виде пространственных структур разной сложности: от спиралевидных (как у молекул ДНК) до пирамидальных, кубических, сферических разной сложности. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода – каждый в одной, а атом кислорода – в двух. Простая, не объединившаяся с другой молекула воды H2O, называется гидроль, (H2O)2 – дигидроль, (H2O)3 – тригидроль. В парообразном состоянии вода в основном состоит из молекул гидроля, в жидком состоянии вода – смесь гидроля, дигидроля и тригидроля, во льду преобладают молекулы тригидроля. При таянии льда часть связей рвётся, при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями. По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные – атомы водорода. Поскольку молекула воды мала по размерам, каждую молекулу растворяемого вещества могут окружить много молекул воды. Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде.[ Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле. Чистая (не содержащая примесей) вода – хороший изолятор. Но поскольку вода – хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту. Она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи. |
