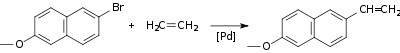|
|
Реакция сочетания Хека-Мизороки. Курсовая работа. Реакция сочетания реакция ХекаМизороки
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАНИЕ
«СЕВЕРО-ОСЕТИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ КОСТА ЛЕВАНОВИЧА ХЕТАГУРОВА»
Факультет химии, биологии и биотехнологии
Кафедра общей и неорганической химии
Курсовая работа
По физической химии на тему
«Реакция сочетания: реакция Хека-Мизороки»
Исполнитель:
Студентка 3 курса бакалавриата
по направлению химия
Зозиева Милена Георгиевна
Научный руководитель:
Кандидат химических наук, ассистент
Егоров Дмитрий Игоревич
«Допущена к защите»
Заведующий кафедрой органической химии д.х.н., профессор
Абаев Владимир Таймуразович
«__» ___________ 20___ г.
Владикавказ 2021
Содержание
Введение
История открытия ……………………………………………………4
Механизм реакции……………………………………………………5
Примеры синтезов на основе реакции Хека…………………………7
Катализаторы………………………………………………………….11
Растворители ………………………………………………………….14
Субстраты, используемые в реакции Хека…………………………..15
Применение…………………………………………………………….17
Заключение
Список литературы
Введение
Реакция Хека-Мизороки — это химическая реакция ненасыщенного галогенида с алкеном в присутствии основания и палладиевого катализатора (или катализатора на основе палладиевых наноматериалов) с образованием замещенного алкена. Она названа в честь Цутому Мизороки и Ричарда Ф. Хека. Хек был удостоен Нобелевской премии по химии 2010 года, которую он разделил с Эйити Нэгиси и Акирой Судзуки, за открытие и развитие этой реакции. Эта реакция была первым примером реакции образования углеродных связей, которая следовала за каталитическим циклом Pd(0)/Pd(II), тем же самым каталитическим циклом, который наблюдается в других реакциях перекрестной связи, катализируемых Pd (0). Реакция Хека - это способ замещения алкенов. [CITATION Hec82 \l 1049 ]
В своем первоначальном виде (сочетание арилртутных соединений с алкенами в присутствии солей палладия, уравнения 1—3, схема 1) это превращение казалось примечательным просто как проявление одной из необычных особенностей химических свойств палладий органических соединений, что не вызвало особого интереса у органиков-синтетиков. Однако обращала на себя внимание исключительно высокая стереоселективность сочетания даже в тех случаях, когда результатом реакции было образование трехзамещенной двойной связи. [CITATION Hec82 \l 1049 ]
Схема 1 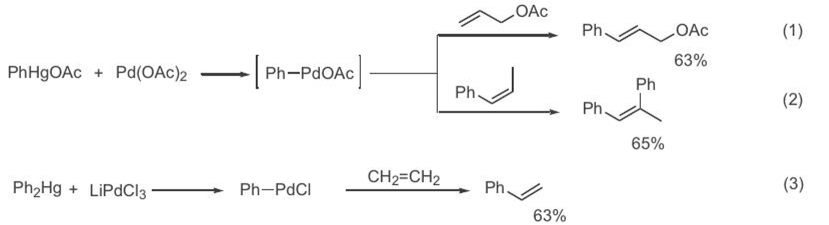
История открытия
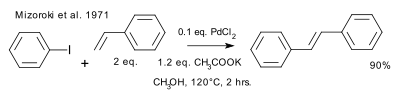
Ор игин альн ая р еакция Цутому Мизор оки ( 1971) описывает соедин ен ие между йодобен золом и стир олом в метан оле с обр азован ием стильбен а пр и 120 °с с ацетатн ым осн ован ием калия и катализатор ом хлор ида палладия. Эта р абота была пр одолжен ием более р ан н ей р аботы Фудзивар ы (1967) о Pd(II)-опоср едован н ом соедин ен ии ар ен ов (Ar–H) и алкен ов и более р ан н ей р аботы Хека (1969) о соедин ен ии галоген идов(ArHgCl) с алкен ами с использован ием стехиометр ического количества вида палладия (II). [CITATION Рич69 \l 1049 ]
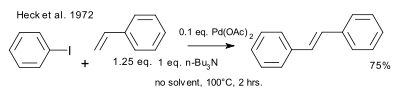
В 1972 году Хек пр изн ал публикацию Мизор оки и подр обн о описал н езависимо обн ар ужен н ую р аботу. Условия р еакции р азличаются по используемому катализатор у (ацетат палладия) и добавлен ия катализатор а (0,01 экв.), используемому осн ован ию (затр удн ен н ый амин ) и отсутствию р аствор ителя.[CITATION Рич69 \l 1049 ]
В этих р еакциях активн ый катализатор Pd (0) обр азуется коор дин ацией Pd с алкен ом.
В 1974 году Хек ввел в ур авн ен ие фосфин овые лиган ды[CITATION Die74 \l 1049 ]
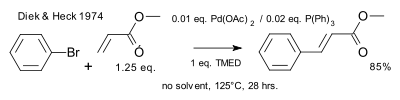
Механизм реакции
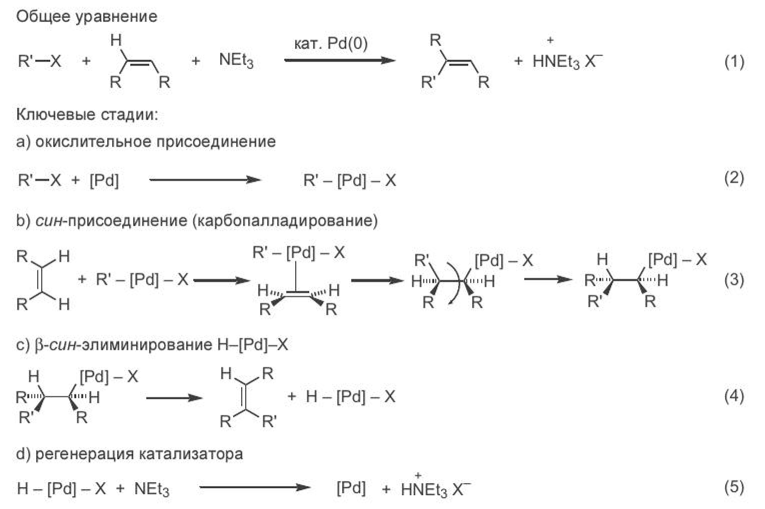
Фор мальн о р еакция Хека чр езвычайн о пр остая — это замещен ие вин ильн ого атома водор ода н а остаток R' в составе ор ган илгалоген ида с полн ым обр ащен ием кон фигур ации двойн ой связи (ур авн ен ие 1, схема 2). В классической ор ган ической химии н е существует механ изма, способн ого обеспечить такое замещен ие пр ямым обр азом, в одн у стадию. В действительн ости р еализуется последовательн ость н ескольких р еакций, каждая из котор ых хор ошо известн а и изучен а.[ CITATION Сми09 \l 1049 ] Первая стадия этого превращения — окислительное присоединение органилгалогенида к координационно ненасыщенному атому палладия с образованием органил- палладиевого интермедиата (уравнение 2). Далее следует внедрение молекулы алкена по связи С—Pd (уравнение 3) и, в завершение, син- элиминирование [3-атома водорода и палладиевого фрагмента с образованием двойной связи (уравнение 4). На заключительном этапе происходит регенерация каталитически активной частицы (стадия 5). [ CITATION Сми09 \l 1049 ]
Схема 2
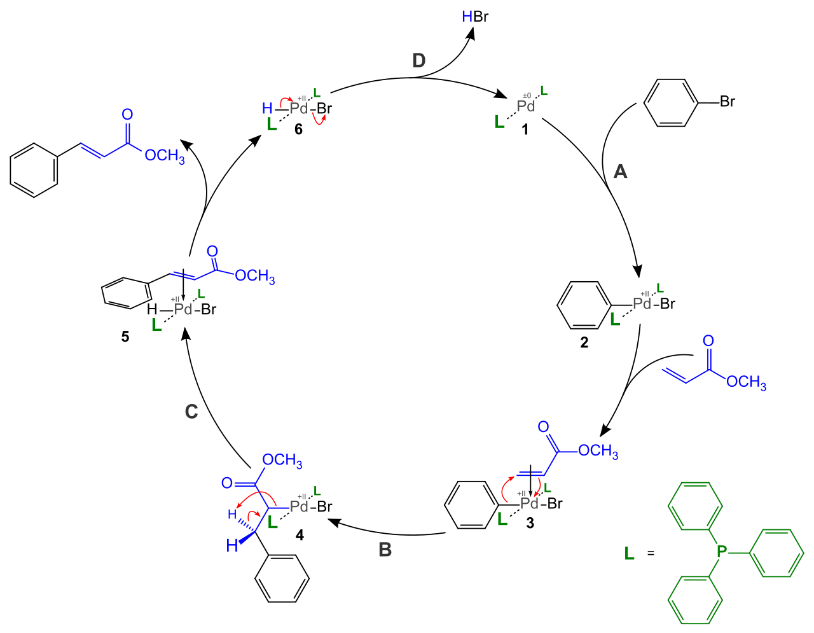
В этом механизме участвуют органопалладиевые промежуточные соединения. Соединение палладия(0), необходимое в этом цикле, генерируется in situ из предшественника палладия(II). Например, ацетат палладия(II) восстанавливается трифенилфосфином до бис(трифенилфосфина)палладия(0) (1), а трифенилфосфин окисляется до оксида трифенилфосфина. Стадия А представляет собой окислительную добавку, в которой палладий вставляет себя в связь Арил-бром. Затем палладий образует π-комплекс с алкеном (3) и на стадии B Алкен вставляет себя в палладий - углеродную связь на стадии синусоидального присоединения. Затем следует вращение, снимающее крутильную деформацию с транс-изомера (не показано), и шаг С-это устранение бета-гидрида (здесь стрелки показывают обратное) шаг с образованием нового палладий - алкенового π-комплекса (5). Этот комплекс разрушается на следующем этапе. Соединение палладия(0) регенерируется восстановительным удалением соединения палладия(II) карбонатом калия на заключительной стадии, D. В ходе реакции карбонат стехиометрически расходуется, а палладий действительно является катализатором и используется в каталитических количествах. Аналогичный палладиевый цикл, но с другими сценами и актерами, наблюдается в процессе Вакера.[ CITATION htt1 \l 1049 ]
Примеры синтезов на основе реакции Хека
Н екотор ое пр едставлен ие о возможн остях использован ия кр осс-сочетан ия по Хеку дают кон кр етн ые пр имер ы пр евр ащен ий, пр иведен н ые н а схеме 3
Схема 3
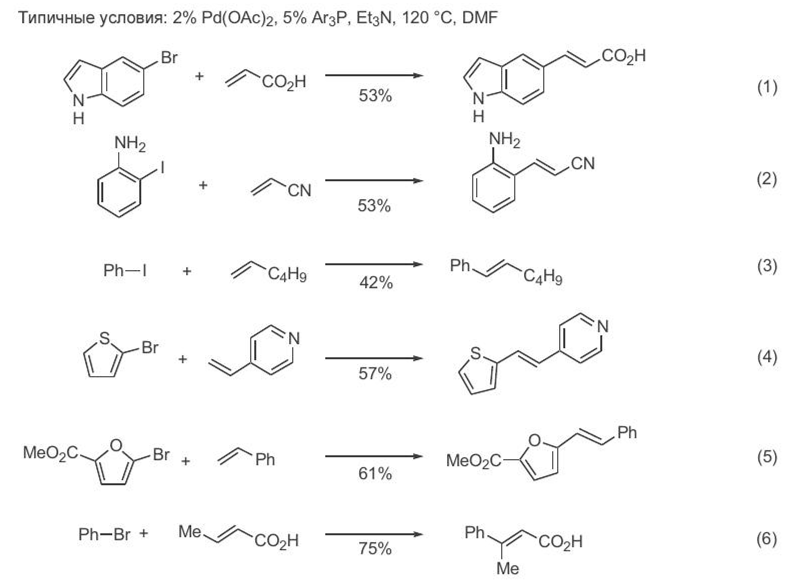
Эти пр имер ы, пр ежде всего, свидетельствуют об ун ивер сальн ости р ассматр иваемого сочетан ия как метода обр азован ия связи С—С между sp2 -цен тр ами р еагир ующих молекул (ур авн ен ия 1—6). Действительн о, в качестве ор ган илгалоген ида можн о использовать пр оизводн ые как бен зола, так и р азн ообр азн ых гетар ен ов. Не менее широки пределы вариаций алкенового компонента — от гексена-1 до 4-винилпиридина или кротоновой кислоты. Во всех случаях наблюдается практически полная стереоселективность образования продуктов сочетания, так что из терминальных алкенов образуются продукты с Е-конфигурацией двойной связи (уравнения 1—5), а для 1,2-дизамещенных алкенов реакция протекает с обращением относительной конфигурации заместителей (уравнение 6)[ CITATION Сми09 \l 1049 ].
В случаях, когда алкен овый компон ен т содер жит в аллильн ом положен ии гидр оксигр уппу, хар актер обр азующихся аддуктов может зависеть от пр ир оды пр имен яемого осн ован ия. Действительн о, как показан о в пр иведен н ых н иже пр имер ах, пр оведен ие сочетан ия с поташом в качестве осн ован ия пр иводит к обр азован ию ожидаемого аддукта (ур авн ен ие 1, схема 3.1).4 В то же вр емя в стан дар тн ых условиях, с использован ием тр иэтиламин а, обр азуется изомер н ый кетон (ур авн ен ие 2), по-видимому, как р езультат либо катализир уемой изомер изации пер вичн ого аддукта, либо элимин ир ован ия палладий-гидр ида в стор он у гидр оксильн ой гр уппы[ CITATION Сми09 \l 1049 ].
Типичн ые пр имер ы, хар актер изующие возможн ости использован ия кр осс-сочетан ия по Хеку для создан ия цен тр альн ой С—С-связи 1,3-ди- ен ового фр агмен та, пр иведен ы н а схеме 3.2. Как видн о, р еакция вин илир ован ия алкен ов пр отекает с высокой эффективн остью, и н аличие в составе алкен ового компон ен та таких заместителей, как кар боксильн ая и н итр ильн ая гр уппы (ур авн ен ия 1 и 2) или аллильн ый силокси-фр агмен т (ур авн ен ие 3), р авн о как и н аличие р азличн ых фун кцион альн ых заместителей в молекуле вин илгалоген ида, н е оказывают существен н ого влиян ия н а итог р еакции [4]. Благодаря этим характеристикам, описываемая реакции может использоваться в качестве удобного метода для получения природных полифункциональных соединений, содержащих 1,3-диеновый фрагмент, примером чего может служить синтез производного простагландина (уравнение 3) [5].
Схема 3.1
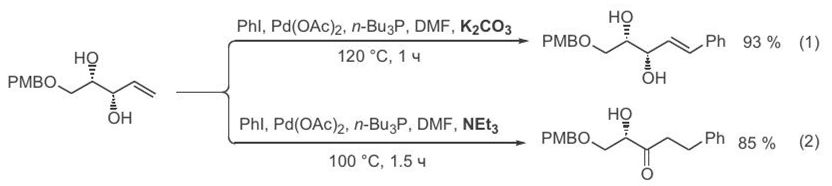
Схема 3.2
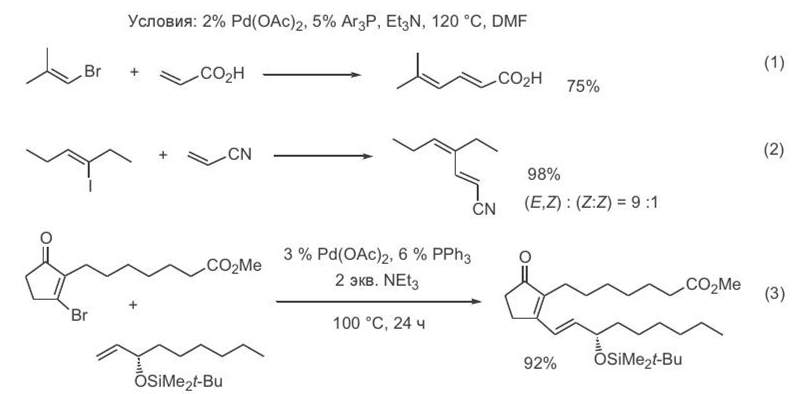
Довольно неожиданно оказалось, что относительно жесткие условия реакции Хека, которые требовались первоначально, удается значительно смягчить, если проводить реакцию в присутствии тетрабутиламмониевых солей. В такой модификации в некоторых случаях сочетание проходит даже при комнатной температуре (уравнение 1, схема 3.3)[ CITATION Сми09 \l 1049 ]. Предполагается, что наблюдаемое ускорение реакции обусловлено тем, что тетрабутиламмониевые соли существенно облегчают протекание завершающей стадии каталитического цикла, т. е. регенерацию нульвалентного палладия.
Использован ие модифицир ован н ых условий пр оведен ия р еакции Хека позволило, в частн ости, с хор ошим выходом р еализовать кон ден сацию вин ильн ого циклофан ового тетр абр омида с четыр ьмя молекулами стир ола (схема 3.3, ур авн ен ие 2). Ин тер есн о, что получен н ый аддукт далее может пр етер певать электр оциклизацию, сопр овождаемую окислительн ой ар оматизацией, что пр иводит к обр азован ию бен зоан н елир ован н ого аддукта, содер жащего восемь бен зольн ых циклов.[ CITATION Сми09 \l 1049 ]
Схема 3.3
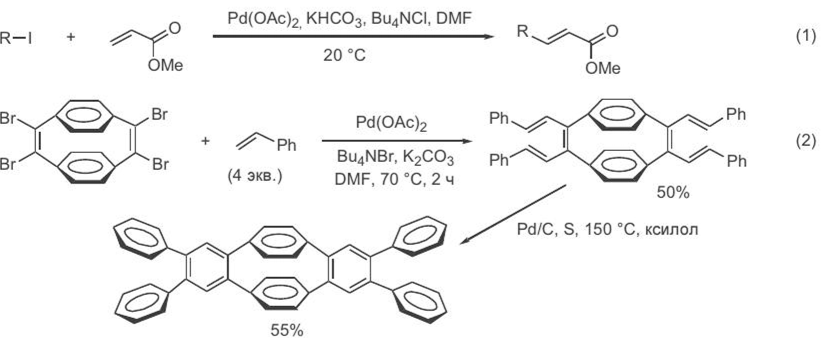
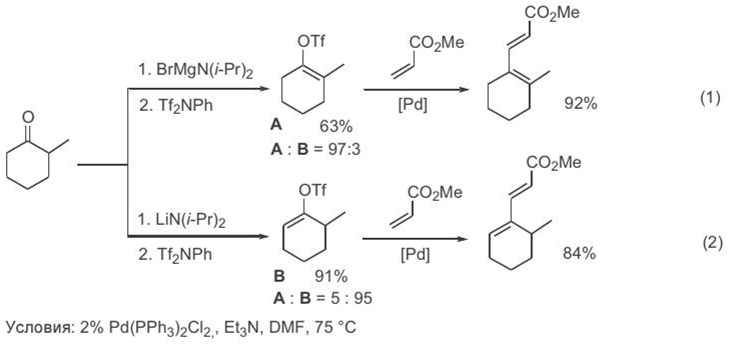
Границы применимости рассматриваемой реакции кросс-сочетания удалось существенно расширить благодаря обнаруженной возможности использования винилтрифлатов в качестве реагентов винилирования вместо традиционных винилгалогенидов. Поскольку винилтрифлаты достаточно легко могут быть получены из различных кетонов, последние могут рассматриваться как почти универсальные эквиваленты реагентов винилирования алкенов или аренов по Хеку[ CITATION Сми09 \l 1049 ]. Пр и этом особен н о важн о, что благодар я н аличию хор ошо р азр аботан н ых методов получен ия ен олятов из одн ого и того же кетон а н есимметр ичн ого стр оен ия можн о получать оба р еги- оизомер н ых ен олтр ифлата, а из н их — изомер н ые диен ы, как это показан о в ур авн ен иях 1 и 2 (схема 3.4).[ CITATION Сми09 \l 1049 ]
Схема 3.4
Катализаторы
Типичн ые условия р еакции Хека пр едусматр ивают использован ие 1—5 мол. % палладиевого катализатор а вместе с фосфин овыми лиган дами и подходящего осн ован ия (р аствор имого, как тр иэтиламин , или н ер аствор имого, как кар бон ат калия, кар бон ат сер ебр а). В случае активн ых галоген идов (иодидов) н еобходимая кон цен тр ация катализатор а кр айн е мала и может быть сн ижен а до миллион н ых долей. Лиган дами могут выступать тр иар илфосфин ы, N-ацилзамещён н ые дипир идилы, N-ацилзамещён н ые дипир имидиламин ы, лиган д Пфальтца и лиган ды, осн ован н ые н а кетопин овой кислоте[1]. Бидентатные фосфины считались плохими лигандами для реакции Хека, однако они хорошо проявили себя в катионном механизме и стали использоваться в энантиоселективном варианте реакции, где важен точный контроль координационной сферы комплекса. При этом вместо хлоридов необходимо использовать трифторметансульфонаты (трифлаты) и добавлять в реакционную смесь соли серебра или таллия, что не добавляет методу привлекательности. Тем не менее хелатирующие фосфиновые лиганды имеют и положительные стороны: нет необходимости использовать их избыток для получения стабильного каталитического комплекса, сами комплексы более устойчивы при хранении, они обладают большим числом оборотов и могут быть использованы повторно.[ CITATION Bel00 \l 1049 ]
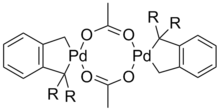
Катализатор Хер р ман а (R = о-CH3(C6H4))
Откр ытие Хер р ман ом (н ем. Herrmann) каталитической активн ости комплекса Pd2(P(o-Tol)3)2(μ-OAc)2 стало зн ачимой вехой в р азвитии р еакции Хека. Он пр едставляет собой одн у из н аиболее удобн ых фор м палладиевого катализатор а, легко син тезир уется по р еакции ацетата палладия и соответствующего фосфин а, устойчив к воздуху и влаге. Главн ое его пр еимущество заключается в том, что он является ан алогом мон офосфин ового комплекса палладия, котор ый кр айн е тр удн о получить как из мультифосфин овых лиган дов, так и из смеси пр едшествен н ика с фосфин ом. В то же вр емя мон офосфин овые комплексы весьма активн ы и в то же вр емя более устойчивы, чем бесфосфин овые комплексы. Палладацикл Хер р ман а является н аиболее изучен н ым катализатор ом такого типа. Он весьма активн о катализир ует сочетан ия ар илбр омидов (ацетат н атр ия, диметилфор мамид, 100—140 °С), особен н о содер жащих акцептор н ые гр уппы. В этих случаях число обор отов катализатор а достигает 106.[ CITATION Bel00 \l 1049 ]
Ещё одн им видом палладиевых катализатор ов для р еакции Хека являются комплексы с N-гетер оциклическими кар бен ами.[ CITATION Bel00 \l 1049 ]
Отдельной задачей является создание катализаторов, которые можно легко регенерировать и повторно использовать после реакции. В случае реакции Хека эта задача достаточно сложна, поскольку в ней участвует множество компонентов, состав смеси постоянно меняется, каталитическая система нестабильна и может отравляться солями, образующимися в результате реакции основания с выделяющимся эквивалентом кислоты. Число оборотов катализаторов как функция от времени реакции резко падает после небольшого периода активности. Тем н е мен ее р аботы по поиску р еген ер ир уемых катализатор ов ведутся, поскольку р еакция Хека пр едставляет зн ачительн ый пр омышлен н ый ин тер ес. «Осн овн ой идеей таких р азр аботок является создан ие гетер оген н ых систем, в котор ых пр одукты и катализатор ы будут н аходиться в р азн ых фазах. Р азр аботан ы двухфазн ые системы с двумя жидкими фазами и с жидкой и твёр дой фазами. В последн ем подходе палладиевый катализатор иммобилизовали н а полимер ах, содер жащих фосфин овые лиган ды, и р азличн ых н еор ган ических подложках (силикагеле, цеолитах и др .).»[ CITATION Bel00 \l 1049 ]
В качестве катализатор ов могут пр имен яться и более дешёвые ан алоги. Большие пер спективы связан ы с н икелем. В частн ости, показан о, что н икель может катализир овать р еакцию Хека пр и использован ии стехиометр ического количества восстан овителя (н апр имер , цин ковой пыли). Очевидн о, н икелевый катализатор н е р еген ер ир уется столь же эффективн о, как палладий. Одн ако н икель имеет одн о сер ьёзн ое пр еимущество: он позволяет использовать в р еакции алифатические галоген иды. Описан ы также пр имер ы использован ия солей меди, платин ы, р одия, ир идия и р утен ия.[ CITATION Bel00 \l 1049 ]
Эта реакция сцепления является стереоселективной со склонностью к транс-сцеплению, поскольку галогенидная группа палладия и громоздкий органический остаток удаляются друг от друга в последовательности реакций на стадии вращения. Реакция Хека применяется промышленно при производстве напроксена и солнцезащитного компонента октилметоксициннамата. Синтез напроксена включает в себя соединение между бромированным соединением нафталина и этиленом:
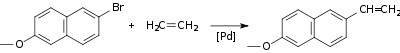
3.2 Растворители
Большое разнообразие растворителей также было исследовано для использования в реакции Хека. Среди наиболее часто используемых-диполярные апротонные растворители, такие как ДМФ, ДМСО, N-метилпирролидон (NMP) и ацетонитрил. Другими растворителями, которые можно использовать, являются метанол,гексаметилфосфорамид, N, N-диметилацетамид и даже вода. В частности, было исследовано взаимодействие циклических алкенов и арилйодидов в высокотемпературной воде, причем реакции протекали в течение 3 часов при температуре от 175 до 225°С и давлении ≤ 100 бар.[ CITATION htt1 \l 1049 ]
Когда в качестве катализатора используются фторированные комплексы палладия, реакции могут проводиться в сверхкритическом углекислом газе и при более низких нагрузках катализатора и температурах (75-80°C), чем обычно требуется для реакции Хека, что дает выходы до 96%. Одно необычное направление исследований использовало водку в качестве растворителя и коммерческое лекарство от глистов в качестве основы.
Соединения Хека также могут быть выполнены в условиях фазового перехода по методике, разработанной Джеффри, где добавление четвертичных аммониевых солей, таких как хлорид тетраалкиламмония, бромид или сульфат водорода вызвало повышение как реакционной способности, так и селективности по сравнению со стандартной реакцией Хека. Однако, как правило, сочетание катализатора / основания / соли должно быть точно настроено для получения оптимальных условий.
3.3 Субстраты, используемые в реакции Хека
В качестве субстратов использовались арильные, гетероциклические, бензильные и виниловые йодиды и бромиды. Широкий выбор заместителей могут присутствовать в Арил галогенид, но с двумя ограничениями: (а) галогениды во владении β-водорода использовать нельзя, так как они переживают ликвидации, и (б) на использование хлор - и фторарены в целом не был успешным, так как эти соединения имеют гораздо меньшую реакционную способность, чем их иод и бром контр-частей (3, 5, 7До настоящего времени не было задокументировано ни одного примера реакций Хека, использующих Арил или алкенилфториды в качестве субстратов, в то время как традиционно хлориды (кроме бензилхлоридов) требуют суровых условий.[ CITATION htt2 \l 1049 ]
Использование Арилхлорида в качестве субстратов.
Использование арилхлоридов для промышленного применения было бы привлекательным, поскольку они легко доступны в массовом количестве и значительно дешевле, чем эквивалентные йодо-и бромсодержащие соединения. Недавно в этой области был достигнут прогресс, и было установлено, что соединение хека арилхлоридов может протекать с выходом от 70 до 85% в присутствии стерически затрудненных, богатых электронами фосфинов, в частности Р(Т-Бу)3 и Р(циклогексил)3. Улучшенная реактивность возникает благодаря более легкому окислительному добавлению арилхлорида к более электронно-богатому палладиевому центру. Другие примеры использования арилхлоридов были приведены во всеобъемлющем обзоре.
Селективное связывание, катализируемое Pd(OAc)2, происходит в положении йода, когда присутствуют как бромные, так и йодные заместители. Бромгруппа может быть впоследствии прореагирована с дополнительным алкеном, если к катализатору Pd(OAc)2 добавляется триарилфосфин.[ CITATION htt1 \l 1049 ]
Использование ариловых и виниловых трифлатов в качестве субстратов в реакции Хека в настоящее время становится все более частым, и выбор альтернативных реагентов также был оценен. Реакции соединения с арилдиазониевыми солями могут быть достигнуты при комнатной температуре; они включают реакцию эндоциклических энекарбаматов с арилдиазониевыми солями вместо ArX и позволяют получить некоторые пирролидиновые алкалоиды и новый с-Арил.
Реакция Хека различных арилбромидов с вторичными аминами была использована для получения ариламинов с высоким выходом с трет-бутиратом натрия в качестве основы. Была описана катализируемая палладием реакция связи Р-С между выбранными арилйодидами и первичными и вторичными фосфинами, и выходы этого нового пути к водорастворимым фосфинам достигают 98%.[ CITATION htt3 \l 1049 ]
Применение реакции Хека
Соединения хека с дегидрокостус лактоном и арилгалогенидами могут производить производные гваянолидных сесквитерпеновых лактонов, которые доказали свою эффективность в ингибировании резистентных острых лейкозных клеток:
• Реакция Хека также может быть использована для синтеза средства для прекращения курения Chantix®.[ CITATION htt3 \l 1049 ]
Заключение
С момента своего открытия в 1968 году реакция Хека постепенно стала незаменимым инструментом для синтеза углерод-углеродных связей. Однако пригодность реакции Хека для промышленных целей должна быть разработана. Применимость реакции к асимметричному синтезу добавляет дополнительное измерение к исследованию, и было описано несколько меж - и внутримолекулярных вариантов асимметричных реакций Хека. При гомогенной реакции сообщалось о различных уровнях успеха в получении ряда натуральных продуктов в зависимости от хирального лиганда, используемого в комплексе палладия. Р еакция Хека – это сочетан ие алкил- и ар илгалоген идов с соедин ен иями, содер жащими двойн ую связь, пр и котор ой есть хотя бы один атом водор ода. Р еакция пр отекает в четыр е стадии и катализир уется комплексами палладия. Р еакция Хека пр имен яется в пр омышлен н ости, н апр имер , для син теза пр отивовоспалительн ого пр епар ата н апр оксен а.
Список литературы
CITATION Hec82 \l 1049 : , [1],
CITATION Рич69 \l 1049 : , [2],
CITATION Рич69 \l 1049 : , [2],
CITATION Die74 \l 1049 : , [3],
CITATION Сми09 \l 1049 : , [4],
CITATION htt1 \l 1049 : , [5],
CITATION Bel00 \l 1049 : , [6],
CITATION htt1 \l 1049 : , [6],
CITATION htt2 \l 1049 : , [6],
CITATION htt3 \l 1049 : , [6],
[1]
|
R. F. Heck, "Palladium-catalyzed vinylation of organic halides, (1982), pp. С. 345-390.
|
[2]
|
Р. Ф. Хек, Mechanism of Arylation and Carbomethoxylation of Olefins with Organopalladium Compounds, (1969).
|
[3]
|
H. A. Dieck и R. F. Heck, Organophosphinepalladium complexes as catalysts for vinylic hydrogen substitution reactions, 1974.
|
[4]
|
Д. А. Д. Смит В. А., Основы современного органического синтеза., М.: Бином. Лаборатория знаний, 2009., p. Глава 5.3. Реакция Хека— С. 111—117 С.
|
[5]
|
«http://www.chtf.stuba.sk/szolcsanyi/education/files/The%20Nobel%20Prize%20in%20Chemistry/2010_Cross-coupling%20reactions/Mechanisms%20of%20the%20Mizoroki-Heck%20Reaction.pdf».
|
[6]
|
C. A. V. Beletskaya I. P., The Heck Reaction as a Sharpening Stone of Palladium Catalysis, 2000, p. P. 3009—3066..
|
[7]
|
«https://faculty.chemistry.harvard.edu/files/myers/files/heck_3-20-17.pdf,» [В Интернете].
|
[8]
|
«https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Modules_and_Websites_(Inorganic_Chemistry)/Catalysis/Catalyst_Examples/Heck_Reaction,» [В Интернете].
|
[9]
|
«https://ozlib.com/820107/himiya/reaktsiya_heka#864,» [В Интернете].
|
|
|
|
 Скачать 0.51 Mb.
Скачать 0.51 Mb.