Реферат на тему ферменты. Эссе мой Пушкин. Реферат дисциплина Научные исследования в химии, химической технологии и биотехнологии тема Что такое фермент Что такое специфичность ферментов
 Скачать 287.48 Kb. Скачать 287.48 Kb.
|
РЕФЕРАТ дисциплина «Научные исследования в химии, химической технологии и биотехнологии» тема «Что такое фермент? Что такое специфичность ферментов?»
Москва 2019 ОГЛАВНЕНИЕВВЕДЕНИЕ 2 СОСТАВ 3 СВОЙСТВА ФЕРМЕНТОВ 4 СПЕЦИФИЧНОСТЬ 5 НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ 6 ЗАКЛЮЧЕНИЕ 7 Приложение 1. «Схема действия ферментов» 8 ВВЕДЕНИЕ Ферменты (или энзимы) можно определить, как биологические катализаторы, имеющие белковую природу и ускоряющие химические реакции в живых клетках. Под действием различных ферментов белки, жиры и углеводы расщепляются до более простых соединений, из которых затем в организме синтезируются новые макромолекулы, свойственные данному типу. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ. Вещество, превращение которого катализирует данный фермент называют субстратом. Фермент, объединяясь с субстратом, образует фермент-субстратный комплекс, который по завершению реакции распадается на продукт (или продукты) и фермент. Фермент в реакции не изменяется и по окончании ее может снова взаимодействовать с новой молекулой субстрата: 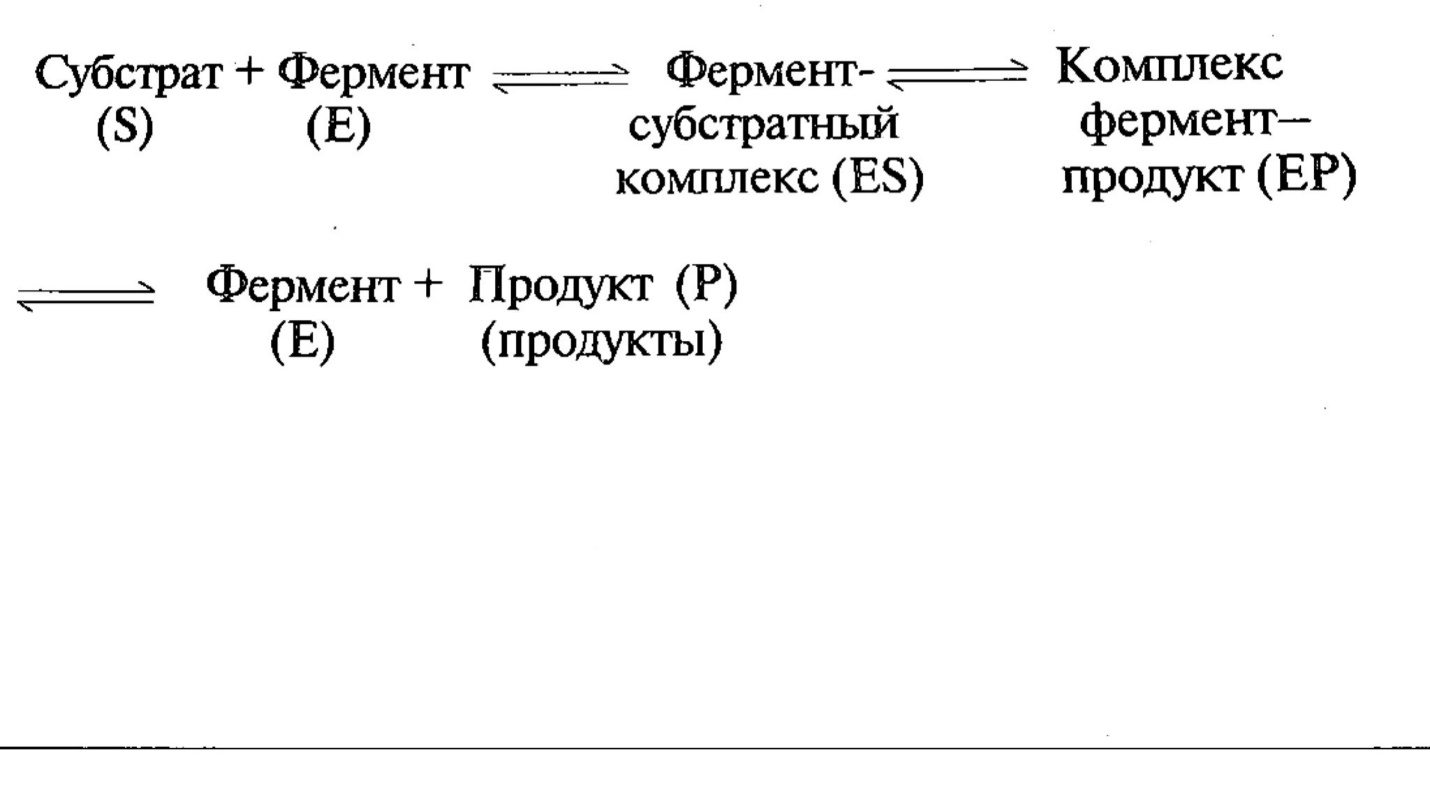 СОСТАВ С открытием новых технологий стало возможным установить химическую природу ферментов. Было выявлено, что все они представляют собой вещества белковой природы и как все белки, могут быть простыми и сложными в зависимости от сопутствующего компонента небелкового характера (простетической группы). Ферменты—простые белки—построены только из аминокислот, и их каталитические свойства обусловлены свойством самой белковой молекулы. К этой группе ферментов относится большинство гидролитических ферментов. Ферменты—сложные белки— содержат в своём составе, помимо белкового компонента, ещё и небелковый—например, нуклеотиды, геминовую группу, витамины, катионы металла. К таким ферментам обычно относятся ферменты окислительно-восстановительного действия. Прочность связи между белковым компонентом и простетической группой в сложных ферментах может быть различной. В некоторых случаях связь прочная, в других—простетическая группа довольно легко отделяется, например, при диализе. Легко диссоциирующие простетические группы ферментов получили название коферментов. СВОЙСТВА ФЕРМЕНТОВ Все ферменты представляют собой глобулярные (четвертичные) белки. Информация о них закодирована в ДНК. Действуют как катализаторы. Их присутствие не влияет ни на свойства, ни на природу конечного продукта (продуктов) реакции. Ферменты действуют чрезвычайно эффективно, т.е. весьма малое количество фермента приводит к превращению больших количеств субстрата. В среднем ферменты способны катализировать около 1000 реакций в секунду. Реакция, катализируемая ферментом, обратима Снижают энергию активации катализируемой реакции. Энергия активации-энергия, необходимая для того, чтобы вещества начали реагировать между собой. Ферменты снижают ее, не повышая общую скорость реакции, не изменяя в какой-нибудь значительной степени температуру, при которой эта реакция протекает Активность ферментов зависит от рН (при более высоких и более низких значениях активность снижается. Оптимумом является рН=7) и температуры (Для большинства млекопитающих лежит в пределах 37—40 °С. Однако существуют ферменты с более высоким температурным оптимумом; у бактерий, обитающих в горячих источниках, он может превышать 70 °С), концентрации субстрата и самого фермента (с повышением концентрации фермента растет и скорость катализа) Ферменты обладают высокой специфичностью, т.е. один фермент катализирует обычно только одну реакция СПЕЦИФИЧНОСТЬ Специфичность действия — способность фермента катализировать только определенный тип химической реакции. Высокая специфичность ферментов объясняется тем, что субстрат (или группа субстратов схожих по строению) подходит к их активному центру (части молекулы фермента, вступающей в контакт с субстратом) как ключ к замку (Приложение.1). По мере изучения механизма действия ферментов был выявлен ряд данных, которые нельзя согласовать с теорией “ключа и замка”. Например, фермент не может атаковать молекулы веществ, обладающие меньшим или большим размером по сравнению с субстратом, но имеющие такие же группы для взаимодействия с ферментом, что и субстрат. Следует отметить, что в ряде случаев такие молекулы связываются с контактным участком активного центра, но при этом превращение субстрата не происходит. Специфичность у разных ферментов выражена в неодинаковой степени. Различают следующие типы специфичности: Абсолютная — способность фермента катализировать превращение только одного, строго определенного субстрата. Например, каталаза катализирует только расцепление пероксида водорода на воду и кислород Относительная (или групповая) — способность фермента катализировать превращению схожих по строению групп субстратов. К ферментам с групповой специфичностью относятся липазы, катализирующие гидролиз сложных эфиров глицерина и карбоновых кислот; фосфатазы, действующие на эфиры фосфорной кислоты; пептидгидролазы, катализирующие гидролиз пептидных связей в белках и пептидах и др. Стереохимическая — способность фермента катализировать превращения определенных стереоизомеров. Ферменты этого типа специфичности действуют на определенный изомер одного и того же вещества: D- или L-, a- или b- , транс- или цис- . Пептидгидролазы, например, действуют только на пептиды, образованные аминокислотами L-ряда. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ Сейчас известно около 2 тысяч ферментов, но список этот не закончен. Существует несколько систем названий: 1)Тривиальная номенклатура – исторически закрепившиеся, без системы и основания, например, трипсин, пепсин, химотрипсин. 2) Рабочая номенклатура – название фермента формируется из названия субстрата или продукта реакции, типа катализируемой реакции и суффикса –аза, например лактатдегирогеназа. 3) Систематическая, научная - L-лактат-НАД-оксидредуктаза. 4) Все ферменты имеют цифровой шифр, например, ЛДГ - 1.1.1.27. Первая цифра говорит о типе катализируемой реакции, указывая на номер класса. Вторая уточняет действие фермента – номер подкласса. Третья указывает природу разрываемой связи в молекуле субстрата - подподкласс. Четвёртая – порядковый номер фермента. В соответствии со специфичностью действия все ферменты делятся на 6 классов. Классы ферментов обозначаются римскими цифрами. Название каждого класса ферментов соответствует этой цифре. I класс — оксидоредуктазы — ферменты, катализирующие окислительно-восстановительные реакции. При окислении происходит либо отнятие водорода от окисляемого вещества, либо присоединение кислорода к окисляемому веществу. В зависимости от способа окисления различают следующие подклассы: 1) дегидрогеназы — катализируют реакции, при которых происходит отнятие водорода от окисляемого вещества; 2) оксигеназы — катализируют включение кислорода в окисляемое вещество: - монооксигеназы — включают 1 атом кислорода в окисляемое вещество; - диоксигеназы — включают 2 атома кислорода в окисляемое вещество. Часто это сопровождается разрывом циклической структуры. По месту разрыва связи присоединяются атомы кислорода. II класс — трансферазы — катализируют реакции переноса химических групп с молекулы одного вещества на молекулу другого вещества. III класс — гидролазы — катализируют реакции разрушения химических связей с участием воды. IV класс — лиазы — катализируют реакции разрушения химических связей без участия воды. V класс — изомеразы — катализируют реакции изомерных превращений. VI класс — лигазы (сингазы, синтетазы) — катализируют реакции синтеза. ЗАКЛЮЧЕНИЕ В результате проделанной работы я узнала, что ферменты — это белки, катализирующие определённые химические реакции, входящие в процессы обмена веществ, отличаются чрезвычайно высокой эффективностью и специфичностью своего действия. По своему составу ферменты разделяют на простые ферменты, состоящие только из молекул белка, и сложные ферменты, состоящие из белка и небелкового компонента (простетические группы, коферменты). Каталитическое действие ферментов определяется главным образом, частью молекулы - активным центром. Действие всех ферментов происходит через стадию образования промежуточного соединения с молекулой субстрата (фермент—субстратный комплекс). Ферменты играют важную роль в организме, в науке, в хозяйственной деятельности человека. Открытие разнообразных наук позволяет шире использовать ферменты. Список использованных источников Д. Тейлор, Н. Грин, У. Стаут. «Биология» https://biohimist.ru/osnovy-biokhimii/25-specifichnost-fermentov.html https://cribs.me/biokhimiya/spetsifichnost-i-klassifikatsiya-fermentov https://studfile.net/preview/6442759/page:10/ А. Г. Пасынский «Биофизическая химия» В. И. Розенгарт «Ферменты-двигатели жизни» Г.А. Смирнова «Основы биохимии» Приложение 1. «Схема действия ферментов» 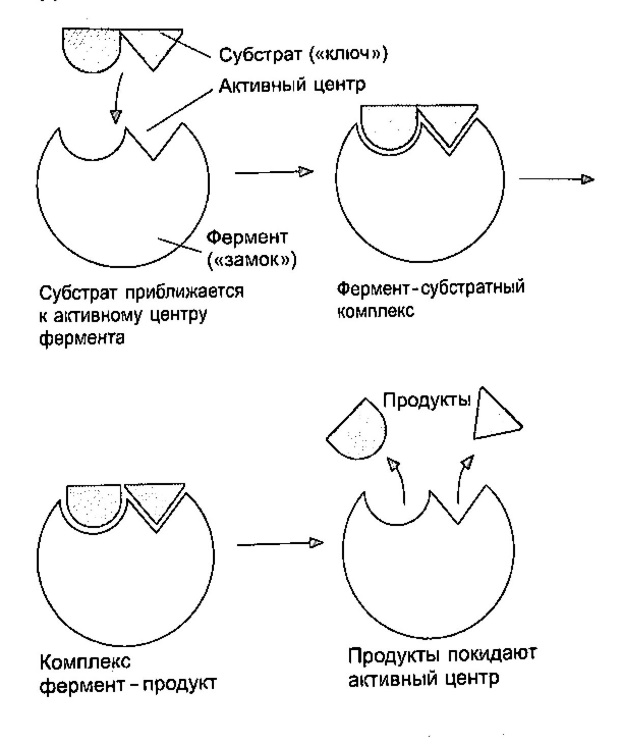 |

