|
|
Швец. Реферат Регуляция трансляции у растений как представителей. Реферат по дисциплине Регуляция экспрессии растительного генома Регуляция трансляции у растений как представителей эукариот
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
«БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
БИОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
Кафедра биохимии и биотехнологии
Реферат по дисциплине: Регуляция экспрессии растительного генома
Регуляция трансляции у растений как представителей эукариот
Выполнила: студентка 4 курса
очной формы обучения
группы Б
Швец Д.Ю.
Проверила:
д.б.н., профессор,
Яруллина Л.Г.
Уфа ˗ 2020
Содержание
Введение…….………………….………………….………………….…………...3
Глава 1. Регуляция трансляции на уровне инициации........................................4
1.1. Дискриминация мРНК...……….……….……….…………….……………..4
1.2. Трансляционная репрессия и маскирование мРНК….……….……….…...9
1.3. Тотальная регуляция….………….………….………….………….……….10
Глава 2. Регуляция на стадии элонгации и терминации………….……..….....11
Заключение…….………………….………………….………………….………16
Список использованной литературы…….………………….………………….17
Введение
Регуляция биосинтеза белка – принципиальный атрибут любой живой клетки. Регуляция необходима для поддержания баланса разнообразных белков в клетке или организме, для изменения этого баланса в меняющихся условиях окружающей или внутриорганизменной среды, для обеспечения смены белков в процессах клеточной дифференцировки и развития организма, для адекватного ответа на специфические внешние сигналы или неблагоприятные воздействия. Механизмы регуляции на стадии трансляции менее экономичны, зато отличаются быстротой реагирования на изменения потребности клетки в данном белке.
Синтез белков в клетке регулируется на трех уровнях:
путем изменения активности генов, то есть через тотальную или избирательную модуляцию продукции мРНК на матрице ДНК (уровень транскрипции);
путем изменения активности мРНК в ее трансляции рибосомами (уровень трансляции);
путем деградации мРНК посредством ее тотального или избирательного расщепления рибонуклеазами;
Знания об особенностях регуляции дают нам важную информацию о размножении, становлении организма, поддержании его жизненных функций. Именно поэтому изучение данной темы представляется особо актуальным.
Целью данной работы является изучение механизмов регуляции трансляции у растений.
Задачи данной работы:
Ознакомление с дискриминацией и маскированием мРНК, тотальной регуляцией и трансляционной репрессией.
Рассмотрение механизмов регуляция на стадии элонгации и терминации.
Глава 1. Регуляция трансляции на уровне инициации
Живые клетки используют несколько различных способов или путей такой регуляции, но практически во всех случаях она осуществляется через регуляцию инициации трансляции. Это означает, что регуляторные механизмы трансляции направлены на то, чтобы разрешить или не разрешить инициацию трансляции данной мРНК, и если разрешить, то с какой эффективностью.
1.1. Дискриминация мРНК
Дискриминация мРНК (discriminate – уметь отличать, распознавать; имеется как у про-, так и у эукариот) - способ позитивной регуляции на основе сродства мРНК к рибосомам и факторам инициации трансляции. Рибосомы либо сами (у прокариот), либо с помощью белковых факторов инициации (у эукариот) “распознают”, с каких мРНК им строить много копий белка, а с каких – мало (Макарова и др., 2017).
Разные мРНК могут сильно отличаться по скорости и частоте “нанизывания” на них рибосом – то есть при инициации трансляции (Спирин, 1986). Одни мРНК – сильные – легко связываются с рибосомой, в единицу времени на них успевает “нанизаться” много рибосом, поэтому и белка синтезируется много (Спирин, 2000). На другие мРНК – слабые – рибосомы нанизываются значительно хуже, поэтому и продукция белка невысока (рис. 1). Структурные белки мембран, рибосомные белки, факторы элонгации, требующиеся в больших количествах кодируются сильными мРНК, а многие специализированные ферменты и регуляторные белки – слабыми мРНК (Спирин, 1996).
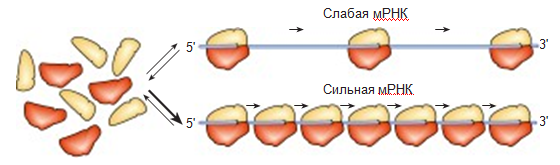
Рис.1. Сборка рибосом из отдельных субъединиц на сильной и слабой мРНК (Стручкова и др., 2011)
На схеме по слабой мРНК движется всего 3 рибосомы, тогда как по сильной – 7 рибосом.
Явление дискриминации мРНК инициирующими рибосомными частицами типично для прокариот, однако, у эукариот в ряде случаев также можно наблюдать дискриминацию мРНК за счет различного сродства 5’- концевых и инициаторных участков мРНК к 40S-рибосомным субъединицам (Спирин, 1999). Классический пример, когда используется этот путь трансляционной диксриминации – различные скорости трансляции мРНК, кодирующих - и β-глобиновые цепи в ретикулоцитах млекопитающих. Было показано, что мРНК β-глобина является более эффективной в трансляции, чем мРНК -глобина. В то же время скорость элонгации на обеих матрицах оказалась одинаковой. Было доказано, что именно «сила» инициации определяет различия в трансляции обеих мРНК: акты инициации на каждой молекуле мРНК β-глобина происходят в 1,7 раза чаще, чем на мРНК -глобина. Другими словами, мРНК β-глобина «сильнее» с точки зрения инициации. Тем не менее в ретикулоцитах количества синтезируемых молекул - и β-глобинов оказывается эквимолярным за счет того, что количество «слабой» -глобиновой мРНК в клетках соотвественно больше, чем «сильной» β-глобиновой мРНК. Предполагается, что 5’- концевая последовательность мРНК β-глобина имеет какие-то структурные характеристики, определяющие ее более сильное сродство к 40S-рибосомным частицам (Спирин, 2019).
Эукариотические факторы инициации могут быть, хотя и несколько условно, подразделены на две группы: рибосомсвязывающие белки и мРНК-связывающие белки. В большинстве эукариотических клеток мРНК-связывающие факторы инициации, elF4F и elF4B, представлены в молярных количествах, меньших, чем молярные количества мРНК; другими словами, имеет место дефицит мРНК-связывающих факторов инициации. Следовательно, существует конкуренция между различными мРНК за связывание с этими белками. У эукариот конкуренция между мРНК за компоненты инициации может иметь место до организации последних в инициирующий рибосомный комплекс. В таком случае, если различные мРНК имеют различную степень сродства к лимитирующему мРНК-связывающему фактору инициации, именно это будет определять «силу» матриц и инициации их трансляции.
Два мРНК-связывающих фоктора инициации, elF4F и elF4B, могут рассматриваться в качестве возможных инициаторных компонентов, осуществляющих дискриминацию матриц. Оба фактора присутствуют в эукариотических клетках в ограниченных количествах; также было показано, что они имеют различную степень сродства к различным мРНК (к их 5’- концевым последовательностям). Во многих случаях (например, в случае неразмножающихся клеток, таких как ретикулоциты) ситуация с белком elF4F особенно напряженна: его кэп-связывающая субъединица elF4E, доступная для формирования elF4F –комплекса, может присутствовать в таких клетках в количествах менее 0,1 молекулы на одну рибосому, и в связи с этим полноценный elF4F представляется наиболее лимитирующим компонентом аппарата инициации трансляции. С другой стороны, elF4B, обладающий неспецифической РНК-связывающей активностью, возможно, необходим для эффективной инициации в количестве многих копий на одну мРНК. (Спирин, 2019).
Примером весьма конкурентоспособной клеточной мРНК может служить мРНК, кодирующая ферретин - белок, формирующий молекулярные «контейнеры» для запасания и хранения ионов трехвалентного железа в клетках эукариот. Когда эта мРНК активируется и транслируется invitro или invivo, она «одерживает победу» в конкуренции с другими клеточными мРНК. Было показано ,что за такую «силу» инициации во многом ответственны специальные вторичная и третичная структуры («FR-элемент») и 5’- нетранслируемой области, вблизи кэп-структуры ферретиновой мРНК. Этот элемент позитивной регуляции ферретиновой мРНК может рассматриваться в качестве избирательного сильного участка связывания лимитирующего мРНК-связывающего фактора инициации.
1.2. Трансляционная репрессия и маскирование мРНК
Трансляционная репрессия (как у про-, так и у эукариот) и маскирование мРНК (только у эукариот) – негативная регуляция либо с помощью белков, либо с помощью особых микроРНК, находящихся в составе белковых комплексов. В первом случае белок-репрессор связывается с определенным участком на мРНК, тем самым, мешая присоединению к мРНК рибосомы. Вещество-эффектор, появляясь в среде, снимает белок-репрессор с мРНК и разблокирует синтез белка. Во втором случае присоединение к мРНК антисмысловой микроРНК также вызывает трансляционную репрессию, причины которой в настоящее время продолжают изучаться (рис. 2).
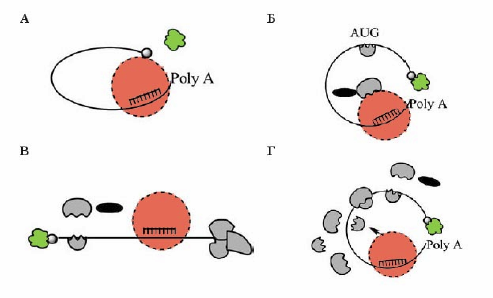
Рис.2. Предполагаемые механизмы трансляционной репрессии, вызываемой микроРНК (Стручкова и др., 2011)
Показано, что miРНК связывается с мРНК-мишенью в ее 3’-концевой области.
А. Конкуренция за связывание кэпа. Присоединяясь к мРНК, miRISC закрывает область кэпа, предназначенную для фактора инициации трансляции eIF4E.
Б. Конкуренция за большую субъединицу рибосомы: miRISC забирает на себя рибосомальную 60S-субъединицу, не давая ей присоединиться к собранному ранее 40S-прединициационному комплексу.
В. Блокирование “закольцовывания” мРНК. Присоединение miRISC не дает мРНК приобрести правильную конформацию, необходимую для трансляции.
Г. Репрессия на стадии элонгации трансляции. Присоединение miRISC к мРНК-мишени приводит к преждевременному отсоединению ее от рибосом.
Механизмы трансляционной репрессии обеспечивают пути модуляции скоростей инициации трансляции в широких пределах либо в зависимости от внешних сигналов (эффекторов), либо по типу обратной связи. Трансляционная репрессия используется для тонкой регуляции белкового синтеза как у про-, так и у эукариот (Стручкова и др., 2011). Трансляционная репрессия может вызываться:
специальными белками-репрессорами (рис. 3);
особыми комплексами, в состав которых входят микроРНК;
комплексы miRISC;
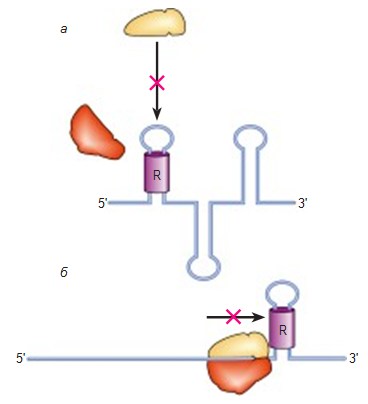
Рис.3. Трансляционная репрессия. Белок-репрессор (R) имеет специфическое сродство к участку мРНК в районе инициации трансляции (часто к участку с нестабильной вторичной структурой) и, связываясь с ним (и стабилизируя его), создает барьер либо для посадки инициирующих рибосомных частиц (а), либо для движения рибосомы к месту инициации (б) (Стручкова и др., 2011)
Трансляционная репрессия с помощью белков заключается в том, что белок-репрессор, связываясь с рибосомсвязывающим участком на 5’-конце мРНК, мешает рибосомной субъединице присоединиться к мРНК (Элиот и др., 2000).
Репрессором может быть:
1) сам синтезируемый по данной мРНК белок. Например, если в бактериальной клетке возникает избыток фермента треонил-тРНК-систетазы, этот фермент становится репрессором, блокируя свой собственный синтез.
2) специальный белок, на данной мРНК не закодированный. Способность такого белка связываться с определенными мРНК зависит от присутствия того или иного низкомолекулярного компонента – эффектора. Например, у животных синтез железозапасающего белка ферритина заблокирован белком-репрессором IRP (iron-regulatory protein) и разблокируется лишь после взаимодействия репрессора с эффектором – ионами железа. Если железа в среде мало, то ферритин – белок для его связывания – не нужен. В этих условиях репрессор IRP присоединен на мРНК, кодирующей ферритин, к специальному регуляторному элементу IRE (iron-responsive element). Если в среде появляется железо, оно связывается с IRP и в 50-100 раз понижает сродство репрессора к мРНК. В результате мРНК разблокируется, и с нее начинается синтез ферритина. Он идет до тех пор, пока не иссякнет запас железа в среде.
Кроме типичной трансляционной репрессии эукариоты выработали интересный механизм маскирования мРНК, когда соответствующая мРНК становится недоступной не только для инициации трансляции, но и фактически выведена из всех других процессов ее возможных превращений или изменений – деградации нуклеазами, ферментативной модификации ее 3'-конца путем полиаденилирования. Маскирование, как и типичная трансляционная репрессия, тоже осуществляется белками и зависит от внешних сигналов (эффекторов). Маскирование и демаскирование мРНК являются особенно характерными для процессов гаметогенеза (оогенеза и сперматогенеза), раннего эмбрионального развития, клеточной дифференцировки, гормонального включения или выключения функций. Например, в оогенезе происходит запасание некоторых материнских мРНК в маскированной форме, и часть этих мРНК демаскируется в ответ на оплодотворение яйцеклетки, обеспечивая белковый синтез на самых ранних стадиях эмбриогенеза: дробления, бластулы и ранней гаструлы.
Наиболее интересным моментом в маскировании мРНК является то, что маскирующий белок связывается не с 5'-проксимальным участком инициации трансляции на мРНК, а с нетранслируемым хвостом мРНК – с 3'-проксимальной некодирующей областью, так называемой 3'-UTR (3'-UnTranslated Region) или 3'-НТО. В пределах 3'-НТО имеется специальная посадочная площадка для маскирующего белка – сегмент маскирования. Связывание маскирующего белка с сегментом маскирования 3'-НТО приводит не только к блокаде событий, развивающихся при 3'-конце мРНК, таких, как 3'-экзонуклеазная деградация и полиаденилирование, но и к репрессии – блокаде – инициации трансляции при 5'-конце мРНК (рис. 4).
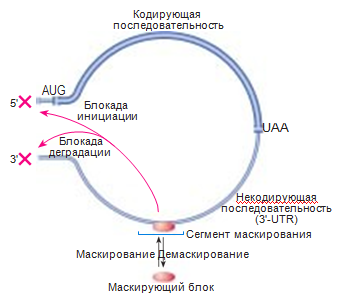
Рис.4. Маскирование мРНК у эукариот (Стручкова и др., 2011)
Связывание маскирующего белка с сегментом маскирования в 3'-нетранслируемой области (3'-UTR) мРНК приводит к инактивации ее функций по всей длине, включая как 3'-концевую деградацию (и полиаденилирование), так и 5'-концевую инициацию трансляции.
Каким же образом воздействие на хвост мРНК может закрыть ей рот? Существуют два, необязательно взаимоисключающих объяснения этого явления. Первое состоит в допущении, что 5'- и 3'-проксимальные нетранслируемые области (5'-UTR и 3'-UTR) эукариотических мРНК пространственно сближены, образуя своего рода циклическую структуру, как показано. Тогда маскирующий белок, сидящий в 3'-НТО, может прямо или через сегмент маскирования блокировать участок инициации трансляции мРНК. Другое объяснение предполагает, что связывание маскирующего белка с 3'-НТО приводит к глобальной структурной перестройке всей молекулы мРНК, делающей ее компактной и недоступной для взаимодействий с другими макромолекулами, включая рибосомные частицы, нуклеазы, ферменты полиаденилирования и деаденилирования. Действительно, маскирование требует не только посадки маскирующего белка на 3'-НТО, но и присутствия большого количества менее специфического РНК-связывающего белка на всей мРНК, с которым мРНК образует рибонуклеопротеидные комплексы, в свое время названные информосомами. Можно полагать, что маскирование мРНК есть компактизация информосом (Спирин, 2000).
1.3. Тотальная регуляция
Тотальная регуляция трансляции всей совокупности мРНК клетки характерна только для эукариот. Она осуществляется через изменение активности факторов инициации трансляции (Овчинников, 1998).
Чаще всего тотальная регуляция осуществляется через фактор инициации трансляции eIF2, активная форма которого нефосфорилирована. Без этого фактора невозможна инициация трансляции любых мРНК клетки. У животных и грибов в определенных условиях активируются специальные ферменты – особые киназы, которые фосфорилируют α-субъединицу белка eIF2, инактивируя его.
Сигналами для активации киназ, фосфорилирующих eIF2, могут быть:
тепловой шок и другие стрессорные воздействия, причем степень подавления белкового синтеза варьирует в зависимости от уровня стресса;
недостаток аминокислот, железа, ростовых факторов;
вирусные инфекции;
По такому же пути осуществляется контроль биосинтеза гемоглобина под действием гема. Трансляция глобиновой мРНК в бесклеточной системе биосинтеза белка из ретикулоцитов кроликов в отсутствие гемина (окисленной формы гема) быстро останавливается. Отсутствие гемина активируют киназу, фосфорилирующую фактор eIF2. Фосфорилированная форма eIF2P связывает eIF2B и в составе комплекса остается в связанном с рибосомами состоянии. В результате трансляция глобиновой мРНК останавливается. Гемин, находящийся в избытке в системе трансляции, взаимодействует с протеинкиназой и инактивирует ее. Протеинкиназа утрачивает способность фосфорилировать фактор eIF2 и, как следствие, блокировать трансляцию (Спирин, 2019).
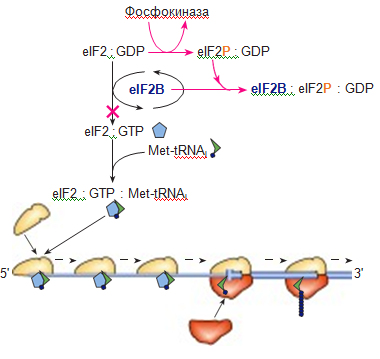
Рис.5. Блокирование трансляции через фосфорилирование белкового фактора eIF2 (Стручкова и др., 2011)
Для инициации трансляции необходимо образование комплекса [eIF2:ГТФ]. При дальнейшей сборке рибосомы на мРНК ГТФ этого комплекса гидролизуется до ГДФ. Получившийся комплекс [eIF2:ГДФ] неактивен и не может принять участие в сборке на мРНК следующей рибосомы. Чтобы его регенерировать до активного [eIF2:ГТФ], необходим другой фактор - eIF2B.
В определенных средовых условиях особая протеинкиназа (фосфокиназа) переходит в активную форму. Активация этой киназы приводит к включению альтернативного пути, мешающего регенерации активной формы фактора eIF2. Под действием фосфокиназы фактор eIF2, не выходя из комплекса с ГДФ, переходит в фосфорилированное состояние (eIF2P). Образовавшийся комплекс [eIF2P:ГДФ] необратимо связывает eIF2B. Запасы eIF2B в клетке истощаются, а без него переход комплекса [eIF2:ГДФ] →[eIF2:ГТФ] становится невозможен. В итоге блокируется сборка всех рибосом и, как следствие, синтез любых белков (Стручкова и др., 2011).
Еще один белковый фактор, через модификацию которого регулируется инициация трансляции – eIF4Е. Он распознает кэп-структуры мРНК, благодаря чему она присоединяся к 40S субъединице эукариотических рибосом. В отличие от eIF2, активность фактора eIF4E в фосфорилированном состоянии увеличивается. Определенные киназы, активируемые в ответ на внеклеточные воздействия гормонами, факторами роста, митогенами, цитокинами, а также в условиях повышенной нагрузки на сердце, фосфорилируют фактор eIF4E (у мышей остаток фосфорной кислоты присоединяется в основном к аминокислоте серину-209). Сродство фосфорилированного eIF4E к кэп-участку мРНК возрастает, что ускоряет инициацию трансляции. Имеется и другой способ регуляции активности фактора eIF4Е – через небольшие белки-ингибиторы (молекулярная масса 12 кДа) 4EBP1, 4E-BP2 и 4E-BP3 (от англ. eIF4E-binding proteins 1, 2 and 3). Если эти белки находятся в фосфорилированном (активном) состоянии, то, связавшись с eIF4Е, мешают ему связаться с другим фактором – eIF4G. Фосфорилирование полипептидных цепей ингибиторов происходит по действием киназ, активируемых в присутствии гормонов (инсулин, ангиотензин, гастрин), факторов роста (EGF, PDGF, NGF,IGFI, IGFII), цитокинов (IL-3, GMCSF), митогенов (TPA) и во время аденовирусной инфекции. Например, ингибиторы 4E-BP1 и 4E-BP2 фосфорилируются протеинкиназой FRAP/mTOR – очень большого белка, принадлежащего к семейству киназ PIK, родственных киназам фосфатидилинозитола. В то же время, в клетках некоторых типов тепловой шок и полиовирусная инфекция сопровождаются, наоборот, снижением уровней фосфорилирования ингибиторов (Спирин, 2019).
Глава 2. Регуляция на стадии элонгации и терминации
Рибосома строит белковую цепь постепенно и неравномерно, с приостановками биосинтеза. Полагают, что соответствие пауз границам структурных доменов полипептидной цепи способствует их нормальному созреванию. На скорость элонгации трансляции действует пространственная укладка мРНК. Для свободного движения рибосомы мРНК должна частично развернуться. Отдельные участки мРНК, обладающие неодинаковой стабильностью, разворачиваются с разной скоростью, что приводит к различиям в скорости трансляции рибосомами разных участков мРНК. Также предполагается возможность изменения пространственной структуры мРНК под действием особых микроРНК и связанных с ними комплексов.
Обнаружен ряд регуляторных белков, которые после взаимодействия с транслирующей рибосомой избирательно временно задерживают трансляцию в определенных местах мРНК. Например, у эукариот есть рибонуклеопротеиновая частица (сигнал-распознающая частица SRP – signal recognition particle), содержащая 7S-РНК, которая узнает особую N-концевую гидрофобную аминокислотную последовательность растущего полипептида, направляемого в ЭПР. Эта частица присоединяется к рибосомам и блокирует трансляцию до тех пор, пока рибосома не вступит во взаимодействие с мембраной эндоплазматического ретикулума. Этот процесс помогает во внутриклеточной сортировке синтезированных белков, направляя нужные белки внутрь (то есть в люмен) ЭПР.
Полная терминация трансляции любого белка требует наличия белковых факторов терминации трансляции. Регуляция этого процесса возможна за счет воздействия на эти белковые факторы (Стручкова и др, 2011).
Заключение
Существует два основных способа регуляции трансляции:
на уровне инициации;
на стадии элонгации и терминации;
Как при транскрипции, в большинстве случаев регуляция трансляции идет через регуляцию ее инициации.
Имеющиеся сведения сводятся в основном к трем группам факторов. Во-первых, известно много случаев, когда имеет место избирательная дискриминация мРНК как результат разной эффективности («силы») инициации благодаря чертам структуры 5'-концевого и инициирующего района матриц. Сюда относятся, по-видимому, также случаи подавления трансляции хозяйских мРНК при одновременной высокоэффективной трансляции вирусных РНК в вирусинфицированных эукариотических клетках. Во-вторых, четко продемонстрирована возможность тотальной регуляции (подавления) синтеза белка в клетке за счет модификации ключевого фактора инициации - eIF2. В-третьих, обнаружена тотальная репрессия, осуществляемая микроРНК и белками, а также маскирование мРНК, обеспечивающее белковый синтез на самых ранних стадиях эмбриогенеза.
Регуляция на стадии элонгации обеспечивается за счет изменения конформации мРНК под действием микроРНК, а также с помощью рибонуклеопротеиновых частиц, блокирующих трансляцию.
На стадии терминации при воздействии на белковые факторы, процесс трансляции может либо ускоряться, либо замедляться.
Список использованной литературы
Овчинников Л.П. Что и как закодировано в мРНК // Соросовский образовательный журнал. 1998. №4. С. 10-18.
Макарова Т.И., Богданов А.А. Рибосома как аллостерически управляемая молеукулярная машина // Успехи биол. химии. 2017. Т. 57. С. 3-32.
Спирин А.С. Молекулярная биология: структура рибосомы и биосинтез белка. М.: Высш. шк., 1986. – 300 с.
Спирин А.С. Регуляция траснляции мРНК-связывающими факторами у высших эукариот // Успехи биол. химии. 1996. Т. 34. С. 3-48.
Спирин А.С. Биосинтез белка: инициация трансляции // Соросовский образовательный журнал. 1999. №5. С. 2-7.
Спирин А.С. Биосинтез белка: элонгация полипептида и терминация трансляции // Соросовский образовательный журнал. 1999. №6. С. 2-6.
Спирин А.С. Биосинтез белка: регуляция на уровне трансляции // Соросовский образовательный журнал. 2000. Т. 6. №5. С. 2-7.
Спирин А.С. Молекулярная биология. Рибосомы и биосинтез белка. М.: Лаборатория знаний, 2019. – 594 с.
Стручкова И.В., Брилкина А.А., Веселов А.П. Регуляция биосинтеза белка: учебно-методическое пособие / И.В. Стручкова, А.А. Брилкина, А.П. Веселов. – Нижний Новгород: Нижегородский госуниверситет, 2011. – 101 с.
Элиот В., Элиот Д. Биохимия и молекулярная биология. – М.: Изд-во НИИ Биомедицинской химии РАМН, 2000. - 366 с.
|
|
|
 Скачать 365.34 Kb.
Скачать 365.34 Kb.




