|
|
Электрофорез. Реферат тема Электрофорез Аркадан Дарин 3 группа 3 курс
Реферат
тема: Электрофорез
Аркадан Дарин
3 группа 3 курс
Электрофорез— это электрокинетическое явление перемещения частиц дисперсной фазы (коллоидных или белковых растворов) в жидкой или газообразной среде под действием внешнего электрического поля. Впервые было открыто профессорами Московского университета П. И. Страховым и Ф. Ф. Рейссом в 1809 году.
С помощью электрофореза удаётся покрывать мелкими частицами поверхность, обеспечивая глубокое проникновение в углубления и поры. Различают две разновидности электрофореза: катафорез — когда обрабатываемая поверхность имеет отрицательный электрический заряд (то есть подключена к отрицательному контакту источника тока) и анафорез — когда заряд поверхности положительный.Электрофорез является одним из наиболее важных методов для разделения и анализа компонентов веществ в химии, биохимии и молекулярной биологии.
Электрофорез в научных исследованиях
В биохимии и молекулярной биологии электрофорез используется для разделения макромолекул — белков и нуклеиновых кислот (а также их фрагментов). Различают множество разновидностей этого метода (см. статью Электрофорез белков). Этот метод находит широчайшее применение для разделения смесей биомолекул на фракции или индивидуальные вещества и используется в биохимии, молекулярной биологии, клинической диагностике, популяционной биологии (для изучения генетической изменчивости) и др.
Электрофорез белков — способ разделения смеси белков на фракции или индивидуальные белки. Электрофорез белков применяют как для анализа компонентов смеси белков, так и для получения гомогенного белка. Наиболее распространенным вариантом электрофоретического анализа белков, является электрофорез белков в полиакриламидном геле по Лэммли.
Варианты метода электрофореза белков
Существует множество разновидностей и модификаций данного метода, которые используются (или использовались в определённые периоды развития биохимии) в различных областях:
Электрофорез в свободных средах (без поддерживающей среды)
Электрофорез с подвижной границей
Зональный электрофорез без поддерживающей среды
Капиллярный электрофорез
Зональный электрофорез в поддерживающей среде с капиллярной структурой
Электрофорез на фильтровальной бумаге
Электрофорез белков на ацетат-целлюлозной мембране
Электрофорез в колонках и блоках гранулированной поддерживающей среды
Электрофорез белков в ПААГ
Электрофроез белков в крахмальном геле
Электрофорез белков в агарозном геле
Электрофорез белков подразделяется также на одномерный и двумерный (2D-) электрофорез, препаративный и аналитический, а также электрофорез нативных белков и электрофорез в присутствии детергента (в денатурирующих условиях). Разновидностью метода электрофореза являются изоэлектрическое фокусирование и изотахофорез.
В случае использования иммунологических методов для выявления разделённых белков говорят про иммуноэлектрофорез.
Иммуноэлектрофорез. Суть метода заключается в следующем:
- проводят электрофоретическое разделение белков вгеле;
- по окончанииэлектрофореза в еле параллельно направлению электрофореза вырезают бороздки;
- в бороздки вносят антитела (антисыворотку), например к тяжелым (альфа, дельта, эпсилон, гамма, мю) или легким (лямбда, каппа) цепям иммуноглобулинов. Эти антитела и разделенные при электрофорезе белки диффундируют навстречу друг другу. В тех местах, где антитела связываются с белками, образуются дуги преципитации
Иммуноэлектрофорез позволяет оценить лишь качественный состав исследуемой смеси белков. Оценка результатов исследования требует высокой квалификации. Чаще всего этот метод применяется для выявления и характеристики моноклональных антител.
Электрофорез с иммунофиксацией. Этот метод основан на электрофоретическом разделении белков сыворотки в геле с последующей инкубацией геля в присутствии антител к тяжелым и легким цепям иммуноглобулинов. При связывании белков с антителами образуются иммунные комплексы, которые можно увидеть после окрашивания. Иммунные комплексы, содержащие нормальные иммуноглобулины, откладываются в виде широкой, размытой полосы, моноклональные - в виде более узкой и четко очерченной. Этот метод также является качественным, однако более чувствителен и прост, чем иммуноэлектрофорез. Электрофорез с иммуно- фиксацией часто применяется в сочетании с иммуноэлектрофорезом для определения моноклональных или олигоклональных иммуноглобулинов.
Зональный электрофорез - полуколичественный метод, позволяющий разделить смесь белков в зависимости от их молекулярной массы и электрического заряда. Суть метода заключается в следующем: исследуемую смесь белков на носителе (например, пластине с гелем) помещают в камеру для электрофореза, заполненную буферным раствором и подключенную к источнику постоянного тока. При электрофорезе белков сыворотки обычно получается 5 основных полос, которые соответствуют фракциям альбумина, альфа1-, альфа2-, бета- и гамма-глобулинов. Иммуноглобулины мигрируют преимущественно во фракцию гамма-глобулинов, хотя также присутствуют во фракциях бета- и альфа2-глобулинов. Относительное содержание каждой фракции сывороточных белков можно оценить с помощью денситометра.
С помощью зонального электрофореза можно исследовать не только сыворотку, но и другие биологические жидкости, например СМЖ и мочу. Этот метод позволяет оценить белковый состав исследуемой пробы и выявить моноклональные антитела, хотя он недостаточно чувствителен для определения моноклональных антител в низкой концентрации на ранних стадиях миеломной болезни.
Электрофорез ДНК — это аналитический метод, применяемый для разделения фрагментов ДНК по размеру (длине) и форме (в случае, если ДНК образует вторичные структуры, например шпильки). Силы электрического поля, прикладываемого к образцам, заставляют фрагменты ДНК мигрировать через гель. Сахарофосфатный остов молекул ДНК заряжен отрицательно и поэтому цепи ДНК двигаются от катода, заряженного отрицательно, к положительному аноду. Более длинные молекулы мигрируют медленнее, так как задерживаются в геле, более короткие молекулы двигаются быстрее.
К образцам обычно добавляют низкомолекулярный кислый краситель (например, динитрофенол, бромфеноловый синий), чтобы визуализировать ход электрофореза в процессе. Краситель также необходим для того, чтобы определить, когда стоит остановить процесс.
Электрофорез проводится в камере, заполненной буферным раствором. Чаще всего используются буферы, содержащие ЭДТА, трис и борную кислоту TAE и TBE. Буфер необходим для повышения ионной силы раствора, в котором будет происходить разделение молекул ДНК под действием приложенного электрического поля.
После разделения (иногда краситель вносят в расплавленную агарозу) фрагменты ДНК разной длины визуализируют при помощи флюоресцентных красителей, специфично взаимодействующих с ДНК, например, агарозные гели обычно красят бромистым этидием, который интеркалирует между азотистыми основаниями дуплекса и флюоресцирует в УФ-лучах.
Определение размеров производят путем сравнения коммерчески доступных фрагментов ДНК (DNA ladder, «линейка»), содержащий линейные фрагменты ДНК известной длины.
Для электрофоретического анализа ДНК обычно используют агарозные (для относительно длинных молекул ДНК) и полиакриламидные (для высокого разрешения коротких молекул ДНК, например, в случае секвенирования) гели.
Электрофорез в медицине (физиотерапии)
Лечебное вещество наносится на прокладки электродов и под действием электрического поля проникает в организм через кожные покровы (в терапии, неврологии, травматологии и др.) или слизистые оболочки (в стоматологии, ЛОР, гинекологии и др.) и влияет на физиологические и патологические процессы непосредственно в месте введения. Электрический ток также оказывает нервно-рефлекторное и гуморальное действие.
Преимущества лечебного электрофореза:
введение малых, но достаточно эффективных доз действующего вещества;
накопление вещества и создание депо, пролонгированность действия;
введение в наиболее химически активной форме — в виде ионов;
возможность создания высокой местной концентрации действующего вещества без насыщения им лимфы, крови и других сред организма;
возможность введения вещества непосредственно в очаги воспаления, блокированные в результате нарушения локальной микроциркуляции;
лечебное вещество не разрушается, как например, при введении per os;
слабый электрический ток благоприятно влияет на реактивность и иммунобиологический статус тканей.
Противопоказания к проведению электрофореза: острые гнойные воспалительные заболевания, СН II—III степени, ГБ III стадии, лихорадка, тяжелая форма бронхиальной астмы, дерматит или нарушение целостности кожи в местах наложения электродов, злокачественные новообразования. Учитываются противопоказания для лечебного вещества. Вещества, используемые при электрофорезе, по способу введения разделяются на:
отрицательно заряженные, вводимые с отрицательного полюса — катода (бромиды, йодиды, никотиновая кислота и другие);
положительно заряженные, вводимые с положительного полюса — анода (ионы металлов — магний, калия, кальция);
вводимые как с анода, так и с катода (гумизоль, бишофит и другие).
Преимущество бишофита — в биполярном введении, так как эффект оказывают одновременно и положительно, и отрицательно заряженные ионы. При назначении семейным врачом лечебного электрофореза при направлении в отделение медицинской реабилитации целесообразно указывать: диагноз, название метода (электрофорез), желаемое лечебное вещество и зоны его воздействия. Физиотерапевт определяет полярность, силу тока, продолжительность в минутах, кратность процедур.
Камера для горизонтального электрофореза серии S-N- идеально подходит для разделения нуклеиновых кислот в погружаемом агарозном геле.
Камера S-2N состоит из корпуса выполненного в виде ванночки(камеры) со стационарно закрепленными платиновыми электродами, каждый из которых соединен на корпусе камеры со своим разъемом, маркированным цветной накладкой (красной или черной), и съемной прозрачной крышки с закреплёнными на ней ответными частями камерных разъемов. Корпус изготовлен методом литья из прозрачного полистирола, что обеспечивает долговечность и безопасность использования камеры. Конструкция крышки обеспечивает автоматическое обесточивание камеры при ее снятии. Подключение камеры к блоку питания осуществляется при помощи сетевых разъемов, закрепленных на свободных концах разноцветных шнуров, берущих начало на ответных частях камерных разъемов на крышке камеры. Положительный вывод блока питания подключается к сетевому разъему, маркированному красным цветом. Отрицательный вывод подключается к разъему, маркированному черным цветом. Для удобства пользователей камеры укомплектована заливочным устройством, с прижимными винтами.
Конструкция гелевой рамки S-2N позволяет устанавливать от 1 до 5 гребенок на гель.
Камера для горизонтального электрофореза S-2N (размер геля 170х120 мм). Конструкция съемной прозрачной крышки обеспечивает автоматическое обесточивание камеры при ее снятии. Камера SE-хорошо подходит для анализа большого количества образцов (18-120).
Технические характеристики
Габаритные размеры 334х196х100мм
Рабочий объем буфера 500мл
Размер геля 170х120мм
Общий вес 700 гр
Максимальное напряжение 250 В
Максимальный ток 150мА
Максимальная мощность не более 20 Вт
Комплектация:
Камера с вмонтированными электродами 1шт
Крышка камеры с разноцветными шнурами 1шт
Столик заливочный SE-2-CT 1шт
Рамка гелевая SE-2-F5 1шт
Держатель гребенок SE- 2-CB 2шт
гребенка ( оргстекло 1 мм, 18 зубцов) SE-2-C181.0 2шт
Рекомендации по эксплуатации:
При проведении электрофореза следите за тем, чтобы температура буферного раствора не превышала 45 градусов
Не допускается падение составляющих прибора с высоты более 100мм
Желательно менять буфер после 2-3 электрофорезов
Не допускается контакт составных частей изделия с органическими растворителями
При подключении к блоку питания соблюдать полярность!
Перед заливкой геля в заливочное устройство дайте остыть раствору агарозы до 60 градусов
Прибор горизонтального электрофореза ЕС 12-13
Приборы для горизонтального электрофореза серии ЕС предназначены для разделения биомолекул в агарозном геле под действием электрического поля, включая разделение продуктов ПЦР.
Две модели, позволяющие формировать гели размером 12х13 см и 8х13 см
Электрофоретическая камера изготовлена из органического стекла и снабжена двумя съемными электродами из электрохимически нейтрального сплава
Конструкция столика для геля позволяет установить от 1 до 7 гребенок.
Конструкция камеры позволяет стандартизировать постоянно повторяющиеся операции по заливке геля и проведению электрофореза
Электронная схема отключения предусматривает автоматическое обесточивание камеры при снятии крышки.
Прибор горизонтального электрофореза ЕС 12-13 Технические характеристики:
Название ЕС 12-13
Объем электродного буфера не более, мл 400
Размер разделяющего геля, мм 120x130
Внешние габариты, мм 240x225x80
Внутренние габариты, мм 180x135x30
Количество гребенок:
на 12 зубцов 2
на 18 зубцов 4
Размер гребенок
Ширина зубцов, мм 3
Толщина зубцов, мм 1,5
Предельно допустимое рабочее напряжение, В 300
Предельно допустимый разогрев прибора при работе,ºС 50
Длина разгона, мм 35 - 130
Масса, кг 1
Агарозный гель-электрофорез
Агароза — получаемый из агара линейный полисахарид, образованный из чередующихся остатков β-D-галактопиранозы и 3,6-ангидридо-α-1-галактопиранозы, объединённых 14 связью. Обладает ярко выраженным свойством к формированию гелей. Точка плавления — 95 °C, точка образования геля — 45 °C.
Для иммуноэлектрофореза и иммунодиффузии используют 2 % гель в веронал-ацетатном буфере.
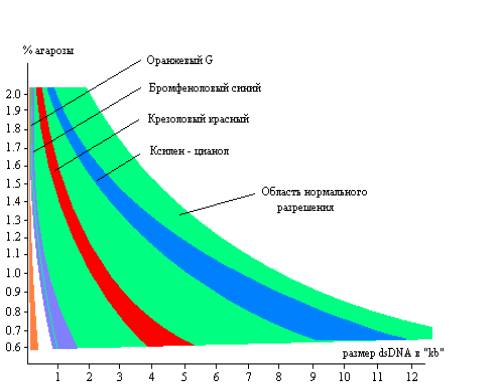
Выбор % геля
Особенности работы с низкопроцентными (0.3%) гелями.
в плашку для электрофореза залить "подложку" — слой агарозы 1.5-2.0% толщиной 2-3 mm, дать застыть;
на этой подложке закрепить гребенку так, чтобы между зубцами и подложкой было расстояние 1-2mm;
залить 0.3% агарозу (лучше в холодной комнате);
гребенку удалять только под слоем буфера, иначе ячейки слипнутся.
Работать в холодной комнате. Гель очень хрупкий, все манипуляции проводить только вместе с 2% подложкой; не лить буфер на поверхность геля. Низкопроцентные гели особенно чувствительны к перегрузке по количеству DNA на дорожку.
Разделение линейных молекул
Диапазон нормального разделения линейных dsDNA молекул для гелей с различной концентрацией агарозы:
% агарозы
|
0.3
|
0.5
|
0.6
|
0.7
|
0.8
|
0.9
|
1.0
|
1.2
|
1.5
|
2.0
|
Размер DNA [kbp]
|
5-60
|
1-30
|
1-20
|
0.8-12
|
0.6-10
|
0.5-8
|
0.5-7
|
0.4-6
|
0.2-3
|
0.1-2
|
Меньший предел определяется (в основном) диффузией полосы в геле. Т.е. в гелях с низкой концентрацией агарозы мелкие фрагменты вполне разделяются, но полосы не четкие.
Верхний предел сильно зависит от напряженности поля, при которой проводится форез. Чем меньше напряженность поля, тем более длинные молекулы можно эффективно разделить.
Разделение суперскрученных и кольцевых молекул
К сожалению относительная подвижность линейных и кольцевых молекул зависит от условий фореза: % геля, скорость фореза (в частности, это означает, что нельзя пользоваться линейным маркером для оценки размера кольцевых молекул).
Приведенная таблица дает некоторое представление о соотношении подвижностей при умеренной (6V/cm) скорости фореза (в скобках - при более быстром разгоне):
Размер суперскруч. DNA [kbp]
|
Размер линейной DNA [kbp] для различных % агарозного геля
|
0.7%
|
1%
|
1.5%
|
2%
|
1
|
1,2
|
1,3
|
1,3(1,6)
|
1,5(1,0)
|
2
|
1,7
|
1,8
|
2 (2,4)
|
2,9( 1,8)
|
3
|
2,2
|
2,3
|
2,7(3,7)
|
-
|
4
|
2,7
|
2,9
|
3,5(5,5)
|
-
|
5
|
3,2
|
3,5
|
5 (8,5)
|
-
|
6
|
3,9
|
4,2
|
8,5(>12)
|
-
|
7
|
4,4
|
5
|
>12
|
-
|
8
|
5,1
|
5,9
|
-
|
-
|
9
|
5,8
|
6,8
|
-
|
-
|
10
|
7
|
8,7
|
-
|
-
|
В присутствии 0.5 µg/ml EtBr разрешение релаксированной и суперскрученной pDNA увеличивается примерно в 20 раз при повышении ионной силы буфера до 4хТАЕ. Того же увеличения можно добиться понижая концентрацию EtBr.
Одноцепочечная DNA
На 1% агарозном форезе ssDNA бежит чуть быстрее (10%), чем dsDNA того же размера. ssDNA окрашивается EtBr заметно слабее, чем ds (разница в 4-5 раз). Tо есть, чтобы полосы имели одинаковую интенсивность окраски, требуется взять в 5 раз больше ssDNA.
Чтобы разделить цепи, нужно либо непосредственно перед форезом прогреть 1' 100oC, либо добавить к образцу NaOH до 0.1 М, 5-10' (NT или 37oC);
Напряжённость поля
При оценке напряженности поля для горизонтального фореза принято пренебрегать конкретной геометрией камеры и измерять расстояние непосредственно между электродами.
На рисунке показана схема форезов, при разном напряжении. Форезы проводились разное время, так, чтобы 0.5kb фрагмент прошел одинаковое расстояние. Видно, что проведение фореза при высоком напряжении эквивалентно уменьшению длины геля.
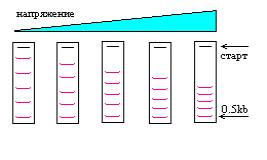
Разумный компромисс между скоростью и качеством фореза для высококачественных или препаративных форезов: 2V/cm(можно меньше для ON форезов). Для аналитических форезов приемлемое качество сохраняется до 6V/cm.
DNA особенно легко теряет EtBr при повышенной температуре (что обычно случается, если гонять форезы при высоком напряжении).
EtBr при форезе движется от (+) к (-). Если хочется, чтобы он не уходил из геля, лучше ввести его и в форезный буфер.
Количество DNA, которое можно наносить на дорожку
Нижний предел определяется используемым методом детекции. Если применяется окрашивание EtBr, то не стоит надеяться увидеть <10ng на 5mm полоску.
Верхний предел: слишком большое количество DNA на дорожке приводит к двум неприятным эффектам:
изменению подвижности полосы в геле (идёт быстрее). Так что не надо сразу паниковать, когда, например, слишком большое количество pDNA идёт быстрее, чем разбавленная исходная плазмида. (к такому же эффекту может привести и слишком большое количество RNA в препарате pDNA).
при визуальной или при денситометрической оценке количества DNA получаются заниженные оценки (точность совсем низкая, начиная приблизительно с 0.5 µg на 5mm дорожку). Оптимальный диапазон для денситометрического определения: 0.02-0.15 µg на полоску.
Буфер для внесения
Присутствие красителя:
облегчает внесение в лунку;
позволяет иметь представление, где в геле находится фрагмент;
но в то же время:
может мешать наблюдению фрагментов под UV;
может оказаться нежелательной примесью при элюции фрагмента из геля.
Подвижность красителей в гелях с различной концентрацией агарозы:
%
|
Подвижность красителей
|
КЦ
|
Крезоловый кр.
|
Бромфен. синий
|
OrangeG
|
0,7
|
10.5 (9-15)
|
3.8 (3.2-4.5)
|
0.8 (0.7-1.2)
|
0.15 (0.1-0.2)
|
0,8
|
8 (7-9)
|
2.9 (2.7-3.2)
|
0.5 (0.4-0.6)
|
< 0.25
|
1,0
|
6 (4.8-7)
|
2.2 (2-2.5)
|
0.5 (0.4-0.6)
|
< 0.25
|
1,5
|
2.2 (1.8-2.6)
|
1.0 (0.9-1.3)
|
0.25
|
<< 0.25
|
2,0
|
0.75 (0.6-0.9)
|
0.35 (0.3-0.4)
|
< 0.25
|
<< 0.25
|
Выбор красителя:
Бромфеноловый синий и ксиленцианол — (стоковые растворы 1% в H2O; рабочая концентрация в 1х буфере 0.005-0.02%) могут заметно мешать наблюдению фрагментов под UV. По нашему опыту, элюция фрагмента в РEG вместе с любым из этих красителей не оказывает заметного влияния на меченье, лигирование и трансформацию.
Cresol red (Na соль) — (стоковый раствор 50mM в H2O; рабочая концентрация в 1х буфере 0.1mM) совместим с ферментативными реакциями, практически не мешает наблюдению под UV.
OrangeG — (стоковый раствор 1% в формамиде; рабочая концентрация в 1х буфере 0.01-0.05%) наиболее подвижный краситель, практически всегда находится вне "рабочей зоны". Заметен под UV.
Краситель в буфере нужен лишь для того, чтобы образец был легко заметен в лунке и в геле. Обычно приводимые в методиках 0.025% для бромфенолового синего и ксиленцианола (в 1х буфере) по нашему мнению слишком большое количество.
Лучше иметь на столе
буфера с различными красителями.
различные разведения буфера для внесения (10х, 2х, 1х). При этом образец любого объема собирается из двух компонентов (буфер+образец), а не из трех (буфер+ вода + образец).
1x если объем образца < 25%
2x ==> 25-75%;
10x ==> 75%
Буфер для загрузки образцов в гели, 6×
(10 мМ Трис-HCl, 0,03% бромфеноловый синий, 0,03% ксиленцианол ФФ, 0,15% Оранжевый Ж, 60% глицерин, 60 мМ ЭДТА, pH 7,6)
Буфер для загрузки образцов в гели c ДСН, 6×
(Применяется для анализа образцов ДНК, содержащих большое количество ДНК-связывающих белков (гель-электрофорез ДНК после рестрикции, лигирования или дефосфорилирования.)
Буферные системы
Для электрофореза белков в полиакриламидном геле в качестве буферных растворов используют: Трис-HCl, Трис-трицин, TBE, TBE с мочевиной, Bis-Tris.
Красители и материалы для визуализации результатов электрофореза:
флуоресцентные красители для белков:
Sypro Ruby
Flamingo
Oriole
колориметрические красители для белков:
Кумасси
окрашивание цинком
окрашивание серебром
окрашивание медью
красители для нуклеиновых кислот:
окрашивание серебром
бромистый этидий
детекция на блоттах
биотиновые комплексы
авидиновые комплексы
комплексы с HRP и AP
Для визуализации результатов электрофореза чаще всего используют окрашивание гелей красителем Кумасси (en:Coomassie blue) или серебром. Для проведения вестерн блоттинга белки переносят из геля на нитроцеллюлозную мембрану. |
|
|
 Скачать 201.42 Kb.
Скачать 201.42 Kb.

