Реферат Количественное определение электролитов в водных растворах. Реферат тема Количественное определение электролитов в водных растворах. Метод нейтрализации способы проведения анализа, практическое применение. Природа индикаторов в методе нейтрализации
 Скачать 0.56 Mb. Скачать 0.56 Mb.
|
LXXVI Московская олимпиада школьников по химии Заключительный этапЭкспериментальный тур 22 марта 2020 годаРЕФЕРАТ Тема «Количественное определение электролитов в водных растворах. Метод нейтрализации: способы проведения анализа, практическое применение. Природа индикаторов в методе нейтрализации». Выполнил ученик 11 класса ГБОУ лицея-интерната «Центр одаренных детей» Мелкумян Ашот Гарунович Нижний Новгород СОДЕРЖАНИЕ Введение 3 Кислотно-основное титрование 4 Классификация индикаторов 5 Как правильно выбрать индикатор 9 Классификация кислот и оснований по силе: 10 Титрование сильных кислот сильными основаниями( и наоборот) 11 Титрование слабых кислот сильными основаниями 13 Титрование солей слабых кислот 14 Посуда для титриметрического анализа 15 Алгоритм проведения эксперимента 17 Практическое применение 17 Список литературы 18 ВВЕДЕНИЕ Еще в далеком прошлом помощник Бойля во время наливания кислоты в бутыль случайно пролил несколько капель на фиалку, которая была на столе. Бойль решив промыть их, опустил цветы в стакан с водой и через некоторое время заметил, что лепестки покраснели. Позже, проведя множество экспериментов, он заметил, что фиалки краснеют под действием любой кислоты, а затем обнаружил, что настой из лакмусового лишайника еще более удивителен: кислоты изменяли его цвет на красный, а щелочи – на синий. Таким образом, было положено начало изучения индикаторов, которые на данный момент является основой количественного анализа. Количественным определением веществ в растворе занимается наука титриметрия, в основе которой лежит титриметрический метод – точное измерение объема раствора реактива, затраченного на реакцию с определяемым веществом. Процесс постепенного приливания раствора титранта к раствору определяемого вещества называется титрованием. В том случае, когда необходимо определить точное содержание в растворе соединений кислотного или основного характера применяют метод нейтрализации, который основывается на нейтрализации определяемого вещества кислотой или щелочью. Помочь определить точку эквивалентности (ТЭ), момент когда кислота и щелочь находятся в растворе в эквивалентном количестве помогают вещества, меняющие цвет в зависимости от pH среды - индикаторы. Рассмотрим подробнее способы проведения данного анализа и его практическое применение, а также подробнее ознакомимся с природой индикаторов в методе нейтрализации . КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ Основу метода кислотно-основного титрования составляет взаимодействие веществ кислотного и основного характера (реакция нейтрализации): H+ + OH- ⇒ H2O Этим методом можно определять концентрацию и количество кислот, оснований, солей, водные растворы которых подвергаются гидролизу, а также смеси этих веществ. Основными титрантами метода нейтрализации являются растворы сильных кислот(например, HCl и H2SO4) и сильных оснований( например, NaOH или KOH). В зависимости от природы титранта различают ацидиметрическое и алкалиметрическое титрование. В ацидиметрии титрантами являются растворы сильных кислот ( обычно HCl, H2SO4), а определяемые вещества – сильные и слабые основания, соли слабых кислот, растворы которых имеют щелочную реакцию среды. Рабочие растворы готовят из выпускаемых в промышленности концентрированных растворов. Для определения точной концентрации титранта проводят стандартизацию: титрование этих растворов растворами первичных стандартов, например Na2B4O7 · 10H2O – десятиводным тетраборатом натрия ( бура). При растворении буры в воде протекает реакция: Na2B4O7 + 7 H2O ⇔ 2NaOH + 4H3BO3 В ходе этой реакции образуется эквивалентное количество щелочи, которая оттитровывается при установлении точной концентрации кислоты в растворе. Суммарный процесс титрования буры соляной кислоты выглядит так: Na2B4O7 + 2 HCl + 5 H2O ⇒ 2 NaCl + 4H3BO3 Титрование проводят в присутствии индикатора метилового оранжевого до изменения окраски раствора с желтой на оранжевую. Зная объем и концентрацию раствора тетрабората натрия и объем, израсходованной на титрование кислоты, рассчитывают концентрацию кислоты в растворе. В алкалиметрии титрантами являются растворы сильных оснований (NaOH, KOH), а определяемыми веществами – сильные слабые кислоты, соли слабых оснований. Растворы титрантов сильных оснований готовят по приближенной навеске. Точную концентрацию устанавливают титрованием растворами первичных стандартов. Наиболее часто встречающимся является H2C2O4·2H2O – щавелевая кислота Щавелевая кислота, как слабая двухосновная кислота, имеет близкие константы диссоциации, поэтому при титровании раствором щелочи происходит одновременная нейтрализация двух протонов кислоты с образованием средней соли: H2C2O4+ 2NaOH ⇒ Na2C2O4 + 2H2O При определении точной концентрации щелочи проводят титрование аликвоты щавелевой кислоты раствором щелочи с применением индикатора фенолфталеин до изменения окраски раствора с бесцветной на бледно-розовую. Поскольку реакция нейтрализации не сопровождается каким-либо внешним эффектом, то для определения точки эквивалентности в кислотно-основном титровании применяют кислотно-основные индикаторы. КЛАССИФИКАЦИЯ ИНДИКАТОРОВ Классификация по цветности. Кислотно-основные индикаторы бывают одноцветные и двухцветные. Одноцветный индикатор окрашен только в одной области кислотности среды( кислой или щелочной среде) и бесцветен в другой. Например, фенолфталеин, пара-нитрофенол, тимолфталеин. Двухцветный индикатор (метиловый оранжевый, метиловый красный) имеет две различные окраски в кислой и щелочной средах Классификация индикаторов по строению. В зависимости от строения молекул кислотно-основные могут быть: Азосоединения (азоиндикаторы), производные пара-аминобензола, и пара-диметиламинобензола. Например, метиловый оранжевый, ализариновый желтый, метиловый красный. 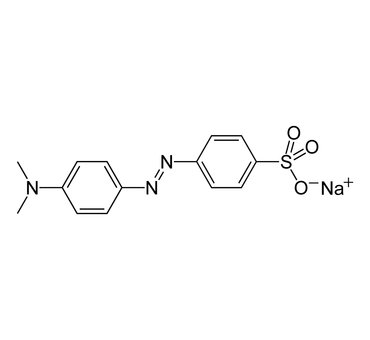 Рис.1 Метиловый оранжевый 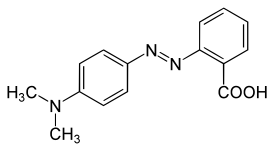 Рис.2 Метиловый красный Трифенилметановые индикаторы. Наиболее распространены фенолфталеин, тимолфталеин и другие:  Рис.3 Фенолфталеин 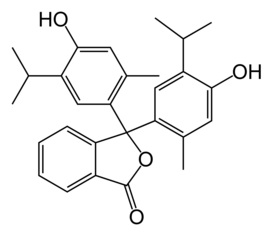 Рис.4 Тимолфталеин Нитроиндикаторы, ароматические нитропроизводные 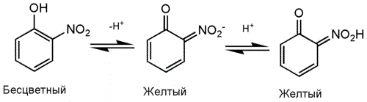 Рис.5 о-нитрофенол в разных средах Индикаторы других структурных типов: 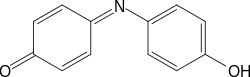 Рис. 6 Индофенол 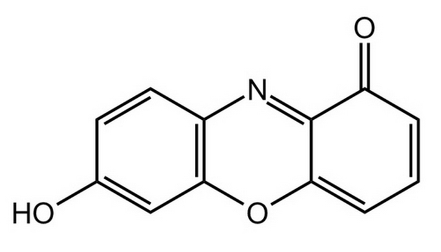 Рис. 7 Лакмус Для объяснения изменения окраски кислотно-основных индикаторов в разных средах используется ионная теория индикаторов, предложенная В. Оствальдом в 1894 г. и основанная на теории электролитической диссоциации С. Аррениуса. Согласно этой теории, кислотно-основные индикаторы ведут себя как слабые кислоты и основания, и в водных растворах могут как диссоциировать, так и протонироваться, причем нейтральная и ионизированная формы индикатора обладают различной окраской. В кислой среде в условиях избытка протонов в растворе индикатор находится в недиссоциированном состоянии HInd, для которой характерна одна окраска. В щелочной среде OH- связывают протоны в воду и смещают равновесие в сторону диссоциации кислоты, что приводит к преобладанию формы Ind-, для которой характерна окраска 2. Согласно хромофорной теории, молекулы кислотно-основных индикаторов содержат так называемые хромофоры (носители цветности), т. е. особые группы атомов с сопряженными двойными связями и неподеленными парами электронов: При изменении рН раствора или при диссоциации индикатора хромофоры могут перегруппировываться. Перемена окраски индикаторов – результат изменений в их внутреннем строении. У одноцветных индикаторов это связано с появлением или исчезновением хромофоров. У двухцветных индикаторов эти изменения обусловлены превращением одних хромофоров в другие, имеющих различную окраску. Этот процесс называется таутомерией. Переход из одной таутомерной формы в другую происходит под действием ионов Н + и ОН– , поскольку одна из форм индикатора является слабой органической кислотой или слабым органическим основанием. На окраску индикаторов влияет также присутствие в соединениях других группировок, называемых ауксохромами. К ним относятся группы –OH, –NH2, –OCH3, –N(CH3)2 и т. д. Ауксохромы сами не сообщают окраску индикаторам, но обладают свойством усиливать действие хромофоров, повышать интенсивность вызываемой ими окраски. Таким образом, в растворах кислотно-основных индикаторов одновременно происходят как равновесные процессы, обусловленные диссоциацией молекул, так и равновесные процессы, связанные с внутримолекулярной группировкой. Однако каждый индикатор изменяет окраску не при одном конкретном значении pH, а в некотором интервале, который называется интервалом перехода окраски индикатора △pH. В таблице приведены значения констант диссоциации и интервалы перехода окраски некоторых индикаторов Таблица.1 Свойства некоторых индикаторов
Титрование с различными индикаторами заканчивают в момент резкого изменения окраски индикатора. Точка перехода окраски каждого индикатора лежит примерно в середине интервала перехода окраски индикатора и эту точку называют показателем титрования (pT). pT определяет pH раствора при котором заканчивают титрование. КАК ПРАВИЛЬНО ВЫБРАТЬ ИНДИКАТОР Для того чтобы ошибка титрования была наименьшей, надо чтобы изменение окраски индикатора происходило как можно ближе к точке эквивалентности (т. е. конечная точка титрования как можно больше соответствовала точке эквивалентности). Неправильный выбор индикатора может исказить результат анализа. Чтобы этого не произошло, необходимо в каждом определении представлять, каким образом происходит изменение рН в процессе титрования, в какой среде лежит точка эквивалентности, как резко изменяется рН вблизи точки эквивалентности. Эти процессы описывают кривые титрования. При выборе индикатора руководствуются следующим правилом: для каждого данного титрования можно применять только те индикаторы, показатели титрования которых лежат в пределах скачка рН на кривой титрования, т. е. у правильно выбранного индикатора интервал перехода полностью или частично перекрывается скачком титрования на данной кривой.. Для кислотно-основного титрования используют очень разбавленные водные растворы или спиртовые растворы индикаторов. Поскольку индикатор сам является кислотой и основанием, следует добавлять его незначительное количество, оптимальный вариант 2-3 капли КЛАССИФИКАЦИЯ КИСЛОТ И ОСНОВАНИЙ ПО СИЛЕ: Способ проведения кислотно-основного титрования зависит от силы определяемого вещества. «Сила» кислоты определяется её константой кислотности:  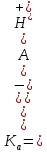 Для наглядности используют показатель константы кислотности: Для наглядности используют показатель константы кислотности: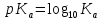 Если pKa ≤ 3, то кислота считается достаточно сильной, а если pKa ˃ 3, то кислота считается слабой. Сила основания определяется его константой основности: 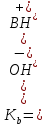 Если pKb ≤ 3, то основание считается сильным, а если pKb ˃ 3, то основание считается слабым . ТИТРОВАНИЕ СИЛЬНЫХ КИСЛОТ СИЛЬНЫМИ ОСНОВАНИЯМИ( И НАОБОРОТ) При титровании сильной кислоты сильным основанием и наоборот можно применять как метиловый оранжевый, так и фенолфталеин. В случае, когда исследуемым веществом является сильная кислота, а титрант- щелочью, более удобно использовать раствор фенолфталеина, так как в процессе титрования бесцветный раствор становится малиновым, что очень хорошо заметно. Переход окраски метилового оранжевого из красной в желтую визуально определяется очень плохо. Методика. В чистую коническую колбу переносят пипеткой 10,0 мл стандартного раствора соляной кислоты, предварительно ополоснув пипетку этим же раствором, добавляют 1-2 капли (не больше !) фенолфталеина. Колбу с раствором соляной кислоты ставят под бюретку и по каплям приливают из бюретки раствор NaOH, непрерывно перемешивая жидкость плавными круговыми движениями колбы. Нужно уловить момент, когда от одной капли щелочи первоначально бесцветный раствор приобретет бледно- розовую окраску, устойчивую в течение 30 с. Титрование проводят до 3-х воспроизводимых результатов. Титровать нужно по возможности быстро, раствор не следует перемешивать слишком интенсивно во избежание поглощения раствором СO2. из воздуха. Рассчитывают средний объем ( VNaOH ), молярную концентрацию эквивалента и титр раствора NaOH. В обратной ситуации, при титровании щелочи кислотой, используют метиловый оранжевый, что обусловлено большей контрастностью перехода желтой окраски индикатора в красную по сравнению с обесцвечиванием малинового раствора. 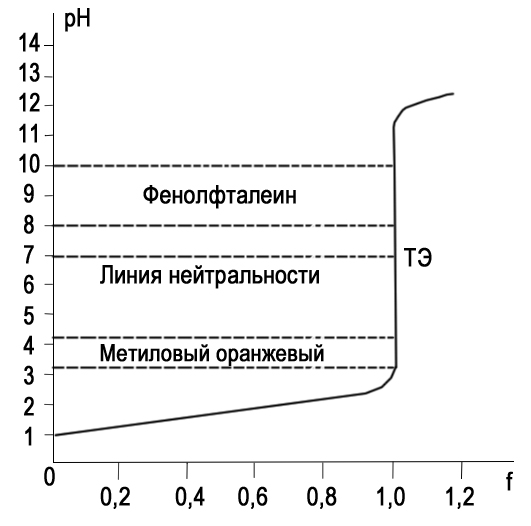 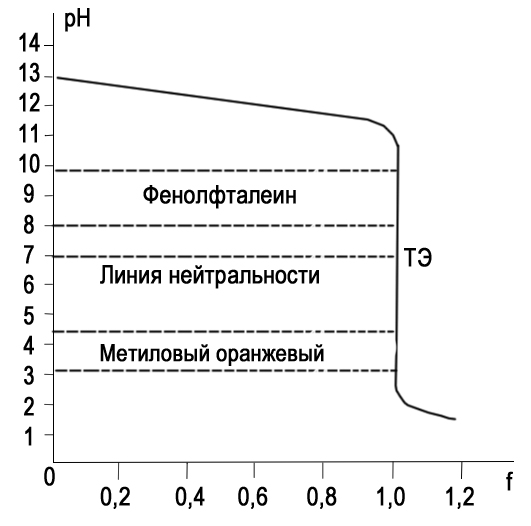   Кривая титрования сильной кислоты сильным основанием Кривая титрования сильного основания сильной кислотой Титрование сильных кислот и оснований можно использовать для определения некоторых веществ, не имеющих кислотно-основных свойств. Например, для определения формальдегида. При взаимодействии формальдегида с сульфитом натрия выделяется сульфопроизводное и также эквивалентное количество гидроксид-ионов, которое можно оттитровать раствором соляной кислоты и в дальнейшем определить количество формальдегида. Данный метод титрования называется косвенное титрование CH2O+ Na2SO3 + H2O⇒ H2C(OH)SO3Na + NaOH ТИТРОВАНИЕ СЛАБЫХ КИСЛОТ СИЛЬНЫМИ ОСНОВАНИЯМИ Для титрования слабой кислоты сильным основанием используется фенолфталеин, для которого показатель титрования pT расположен в области скачка кривой титрования и практически совпадает с точкой эквивалентности. Индикаторы метиловый оранжевый , метиловый красный не могут быть использованы в этом случае, поскольку интервалы перехода окраски расположены вне области скачка кривой титрования. На величину скачка титрования влияет константа диссоциации слабой кислоты: чем меньше константа, тем больше pH на кривой титрования до точки эквивалентности, следовательно, тем меньше скачок титрования. Поэтому для слабых кислот с константой диссоциации меньше 5·108 скачок на кривой титрования отсутствует и такие кислоты определить методом кислотно-основного титрования невозможно Для количественного определения борной кислоты, которая является очень слабой, проводят реакцию образования комплексных соединений борной кислоты с многоатомными спиртами, например с глицерином. При этом образуются соединения с более выраженными кислотными свойствами. Например, у глицеринборной кислоты pKдис.=5,7. Уравнение реакции выглядит следующим образом: 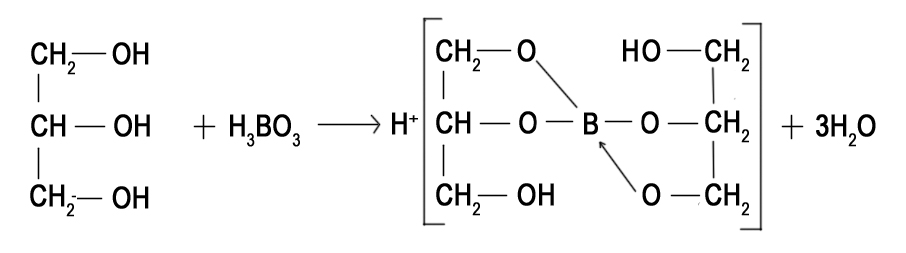 Образовавшаяся комплексная кислота может быть оттитрована щелочью. ТИТРОВАНИЕ СОЛЕЙ СЛАБЫХ КИСЛОТ Определение солей слабых многоосновных кислот. Соли слабых многоосновных кислот при взаимодействии с сильными кислотами ведут себя как слабые основания, и кривые титрования таких веществ тоже имеют несколько точек эквивалентности и скачков титрования вследствие ступенчатого оттитровывания. Например, на кривой титрования карбоната натрия наблюдается два скачка титрования, соответствующие последовательному образованию гидрокарбоната натрия и угольной кислоты: Na2CO3 + HCl ⇒ NaHCO3 + NaCl Таким образом, определяя содержание Na2CO3 в растворе по результатам титрования соляной кислотой в присутствии инидкатора фенолфталеин, находят точку эквивалентности, соответствующую переходу карбоната натрия в гидаркарбонат. При расчете концентрации карбоната натрия в этом случае надо объем затраченного раствора соляной кислоты удвоить. Титрование раствора Na2CO3 до второй точки соответствует полной нейтрализации карбоната и гидрокарбоната натрия, поэтому при расчете содержания Na2CO3 в растворе используется установленный с метиловым оранжевым объем соляной кислоты.  Кривая титрования карбоната натрия соляной кислотой 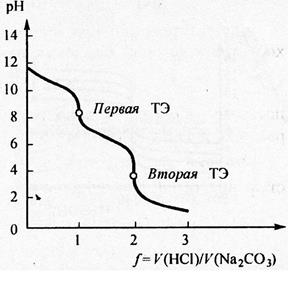 ПОСУДА ДЛЯ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА При кислотно-основном титровании используют: Штатив с бюреткой Служит для точного измерения объема раствора, израсходованного на титрование. Бюретки – стеклянные градуированные трубки с оттянутым концом, имеющие кран или зажим. Часто применяют бюретки объемом 25 или 50 мл.   Пипетки Штатив с бюреткой   Пипетки Для отмеривания небольших объемов растворов применяют пипетки, которые представляют собой узкие стеклянные трубки, оттянутые с одного конца и расширенные посередине. Для точного измерения объема отбираемой жидкости применяют пипетки, имеющие только одну метку. При заполнении пипетки, нижний конец ее опускают в раствор, а через верхний конец засасывают жидкость с помощью резиновой груши и доводят уровень жидкости до метки. В данном лабораторном практикуме применяют пипетки объемом 10, 25 и 50 мл. Мерные колбы Представляют собой плоскодонные сосуды с узким горлом. На горле колбы имеется кольцевая метка, до которой необходимо налить раствор, чтобы его объем был равен обозначенному на колбе. Наиболее часто употребляют колбы на 100, 200 и 500 мл.  Мерные колбы  Конические колбы Широко используемый тип лабораторных колб, который характеризуется плоским дном, коническим корпусом и цилиндрическим горлышком. Наиболее часто используется как сосуд для анализируемого раствора. Бывают объемом 250, 500, 1000 мл.  Коническая колба  АЛГОРИТМ ПРОВЕДЕНИЯ ЭКСПЕРИМЕНТА Перед началом работы тщательно промывают всю посуду, а затем споласкивают дистиллированной водой. Подготовленную к работе бюретку закрепляют вертикально в штативе, и через верхнюю ее часть наливают раствор так, чтобы его уровень был выше нулевой отметки. Удаляют пузырьки воздуха из нижнего оттянутого конца бюретки. Затем опускают капилляр бюретки вертикально вниз и только после этого прекращают подачу раствора. Устанавливают уровень жидкости в бюретке на нулевое деление В коническую колбу отбирают аликвоту анализируемого раствора и добавляют 2-3 капли индикатора. Для титрования опускают оттянутый конец бюретки (капилляр) в коническую колбу с анализируемым раствором. Проводят титрование, для чего, нажимая левой рукой на резиновую трубку сбоку от шарика, сливают жидкость из бюретки в колбу, вращая последнюю правой рукой. Титрование прекращают, когда наступает резкое изменение окраски индикатора от приливания одной капли титранта, и записывают объем израсходованного раствора. Проводить эксперимент многократно до того момента, пока не будет 3 похожих результата( разница не более 0,1 мл). Провести расчеты в зависимости от цели эксперимента. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ В основном метод нейтрализации применяют в лабораториях для анализа неизвестных растворов . Также с помощью кислотно-основного титрования определяют жесткость воды. Список литературы Щеглова Н.В Основы титриметрии: Учебное пособие. – Йошкар-Ола: ГБОУ РМЭ «Многопрофильный лицей-интернат», 2017. 83 с. Основы аналитической химии. Практическое руководство. Под ред. Ю.А. Золотова. – М.: Высш. шк., 2001. – 403 с. Харитонов Ю.Я. Аналитическая химия ( аналитика). Кн.2 –М.: Высш. шк., 2001. – 615 с. Кристиан Г. Аналитическая химия: в 2 томах. Т. 1. – М.: БИНОМ. Лаборатория знаний, 2009. -623 с. Титриметрические методы анализа: учебно-методическое пособие / Н.М. Дубова, Т.М. Гиндуллина – Томск: Изд-во Томского политехнического университета, 2011. – 100 с. Интернет-ресурсы: https://studopedia.info/2-124781.html https://studfile.net/preview/5363024/page:7/ https://505days.com/metod-neytralizatsii/sushhnost-metoda-nejtralizatsii/ | |||||||||||||||||||||||||||||||||||||
