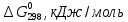контрольная. 2 задачи. Решение а 2no 2 2no o 2 Термодинамические свойства веществ
 Скачать 23.63 Kb. Скачать 23.63 Kb.
|
|
Вариант 11 Задача 1. Вычислите изменение энтальпии и внутренней энергии для реакции при 298 К. Энтальпии образования веществ при стандартных условиях найти по справочнику. Укажите, какая это реакция – экзотермическая или эндотермическая. а) 2NO2 → 2NO + O2 б) MgCO3 → MgO + CO2 Решение: а) 2NO2 → 2NO + O2 Таблица 1 - Термодинамические свойства веществ
Рассчитаем энтальпию химической реакции 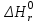 (тепловой эффект химической реакции), используя следствие из закона Гесса. (тепловой эффект химической реакции), используя следствие из закона Гесса.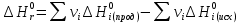 где, прод – продукты реакции; исх – исходные вещества; ni – стехиометрические коэффициенты в уравнении реакции. Учитывая значения 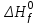 (298) и стехиометрические коэффициенты для всех веществ, участвующих в реакции, получаем: (298) и стехиометрические коэффициенты для всех веществ, участвующих в реакции, получаем: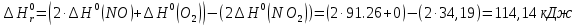 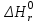 >0, реакция протекает с поглощением теплоты, т. е. является эндотермической. >0, реакция протекает с поглощением теплоты, т. е. является эндотермической.По уравнению Гиббса-Гельмгольца находим изменение энергии Гиббса реакции при 298 К. ΔG0298 реакции =ΔH°298реакции- T* ΔS°298реакции Рассчитаем энтропию химической реакции, используя значения S0(298) для всех веществ, участвующих в реакции. Значения  можно рассчитать по уравнению: можно рассчитать по уравнению: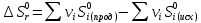 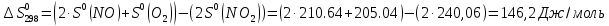 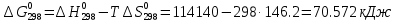 G > 0 – процесс самопроизвольно не протекает, протекает обратная реакция (←). б) MgCO3 → MgO + CO2 Таблица 1 - Термодинамические свойства веществ
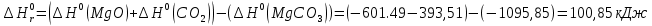 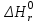 >0, реакция протекает с поглощением теплоты, т. е. является эндотермической. >0, реакция протекает с поглощением теплоты, т. е. является эндотермической. 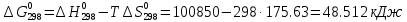 Ответ: а) ∆Н=114,14 кДж, ∆G=70,572 кДж; б) ∆Н=100,85 кДж, ∆G=48,512 кДж. Задача 2 Вычислите энтальпию образования вещества А из простых веществ, если известна его энтальпия сгорания при 298 К и стандартном давлении. Сгорание происходит до СО2(г) и Н2О(ж) и N2(г). Вещество А – глицерин Формула – С3Н8О3 (ж) Решение: Теплоты образования СО2(г), Н2О(ж) равны соответственно -393,51 и -285,83 Дж/моль. Записываем реакцию образования глицерина из простых веществ: ЗС + 4Н2 +3/2О2 = С3Н8О3(ж) Записываем реакции сгорания простых веществ и глицерина: С + О2 = СО2 -393,795 кДж/моль Н2 + 1/2О2 = Н2О(ж) -285,83 кДж/моль С3Н8О3(ж) + 3,5O2 = 3CO2 + 4H2O(ж) - 1661,05 кДж/моль ΔНсгор(С3Н8О3) = - 1661,05 кДж/моль ΔНʄ298 = 3ΔНсгор.(С) + 4ΔНсгор.Н2 ) - ΔНсгор(С3Н8О3) тогда ∆Нʄ298 = [3·(-393,51) + 4·(-285,83)] - (-1661.05) = -662.8 кДж/моль Ответ: энтальпия образования глицерина С3Н8О3 (ж) при 298 К и стандартном давлении Нообр С3Н8О3 = - 622,8 кДж/моль. |

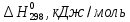
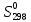 , Дж/моль*К
, Дж/моль*К