химия. 2 вариант. Решение Дано m(koh)140 г n экв. (Кон) n экв. (NaОН) m(NaOH) Решение
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
КОНТРОЛЬНЫЕ ВОПРОСЫВариант 2 В какой массе NaOH содержится то же количество эквивалентов, что и в 140 г КОН. Ответ: 100 г. Решение: Дано: m(KOH)=140 г nЭКВ.(КОН)= nЭКВ.(NaОН) m(NaOH) - ? Решение: Находим молярные массы эквивалентов гидроксида калия и гидроксида натрия: 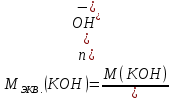 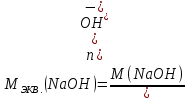 Находим количество вещества эквивалентов гидроксида калия: 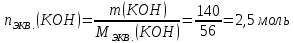 Так как nЭКВ.(КОН)= nЭКВ.(NaОН), nЭКВ.(NaОН)=2,5 моль. Находим массу гидроксида натрия, в котором содержится 2,5 моль его эквивалентов: 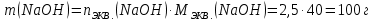 Ответ: m(NaOH)= 100 г. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? Решение: Электронное строение атома серы: 16S 1s2 2s2 2p6 3s2 3p4 Электронно-графическая формула атома серы:
Так как у атома серы последним заполняется 3р-энергетический подуровень, то сера принадлежит к р-электронному семейству. Электронное строение атома железа: 26Fe 1s2 2s2 2p6 3s2 3p6 4s2 3d6 Электронно-графическая формула атома железа:
Так как у атома железа последним заполняется 3d-энергетический подуровень, то сера принадлежит к d-электронному семейству. Исходя из положения германия, молибдена и рения в периодической системе, составьте формулы водородного соединения германия, оксида молибдена и рениевой кислоты, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически. Решение: Германий находится в четвёртом периоде, четвёртой группе, главной подгруппе. Следовательно, у него 4 валентных электрона. Поэтому для германия характерна высшая степень окисления +4, а низшая степень окисления -4. Германий образует летучее водородное соединение – GeH4. 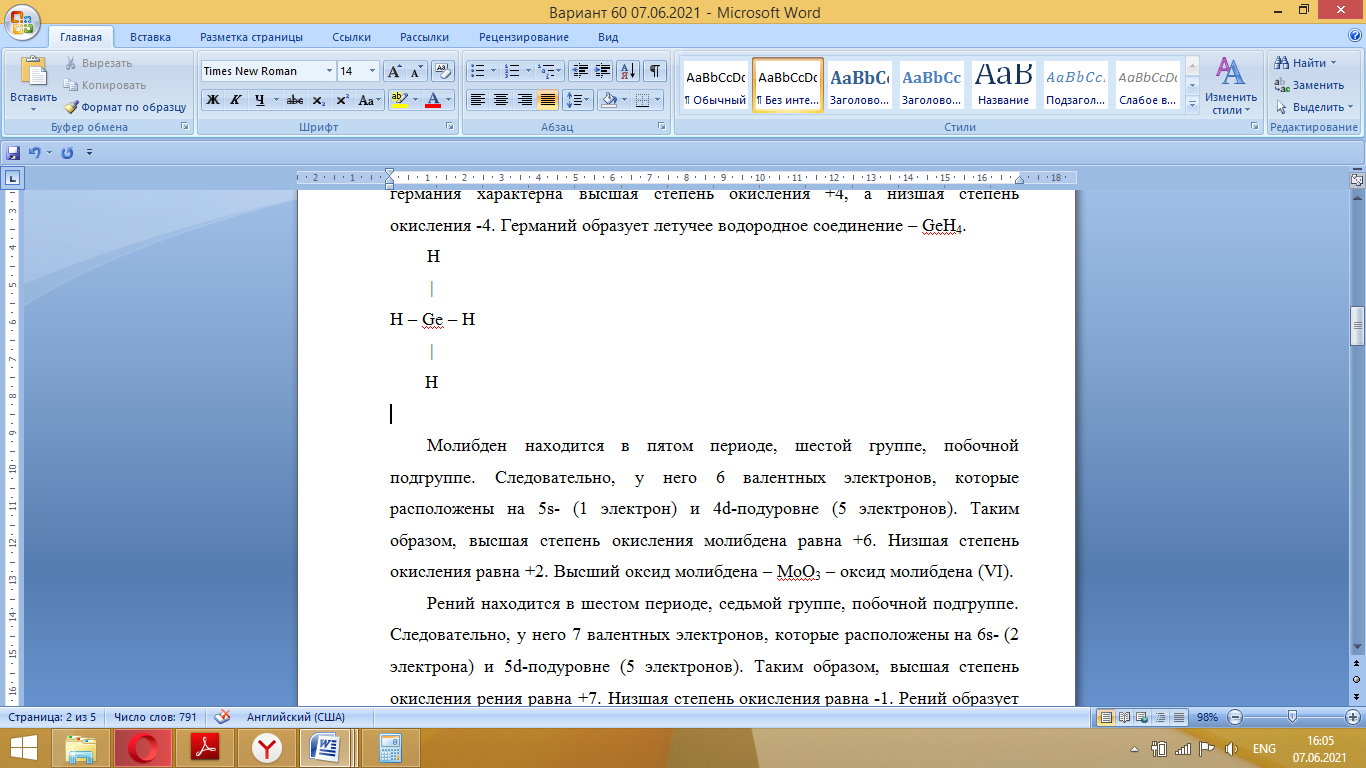 Молибден находится в пятом периоде, шестой группе, побочной подгруппе. Следовательно, у него 6 валентных электронов, которые расположены на 5s- (1 электрон) и 4d-подуровне (5 электронов). Таким образом, высшая степень окисления молибдена равна +6. Низшая степень окисления равна +2. Высший оксид молибдена – MoO3 – оксид молибдена (VI). 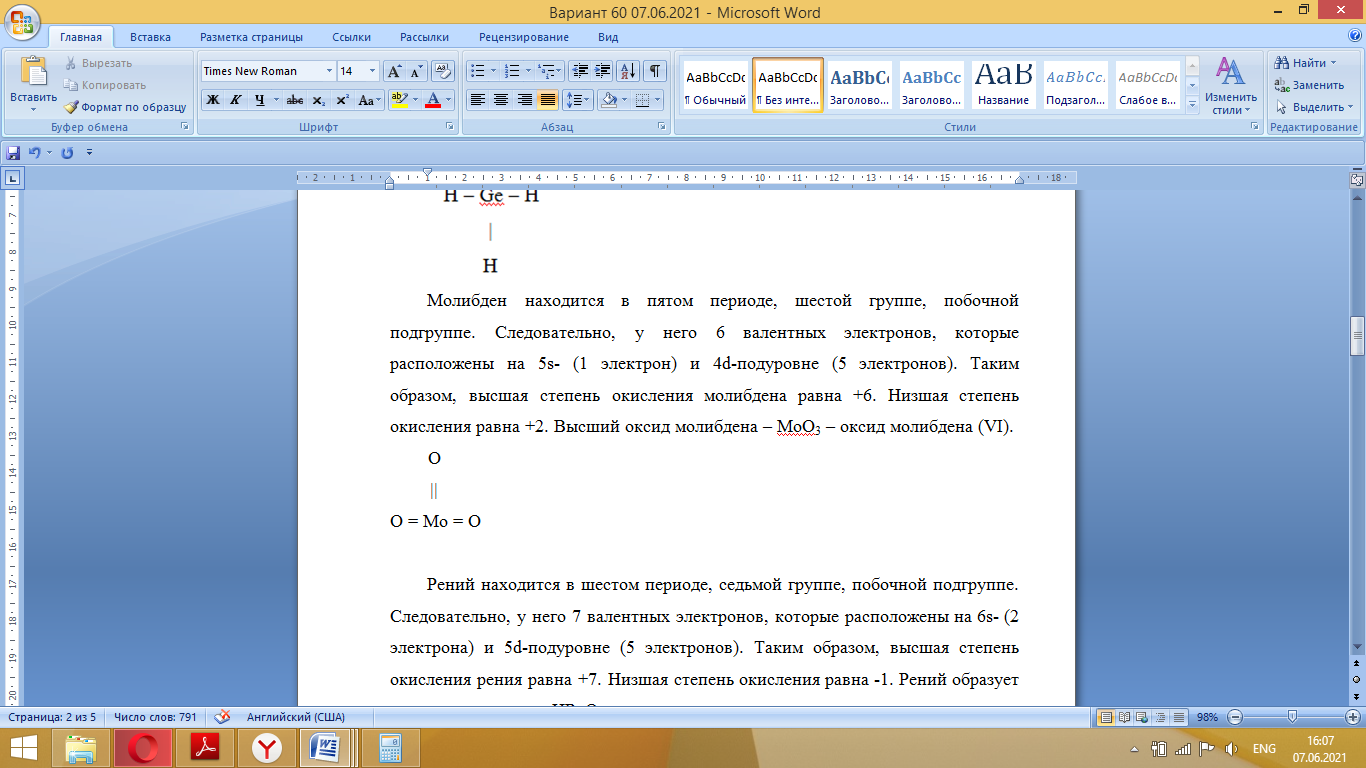 Рений находится в шестом периоде, седьмой группе, побочной подгруппе. Следовательно, у него 7 валентных электронов, которые расположены на 6s- (2 электрона) и 5d-подуровне (5 электронов). Таким образом, высшая степень окисления рения равна +7. Низшая степень окисления равна -1. Рений образует рениевую кислоту – HReO4. 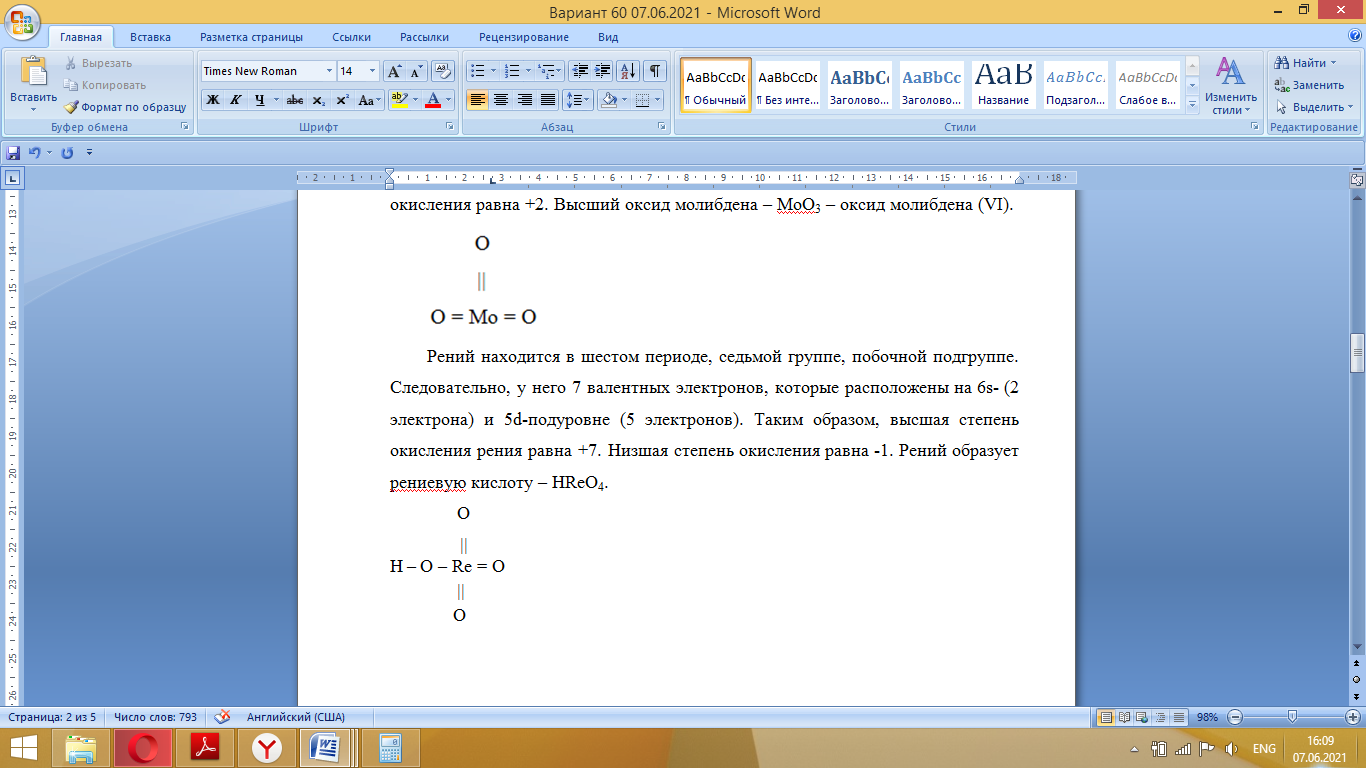 Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена C2H4 (r) и водяных паров. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Ответ: -45,76 кДж. Решение: С2Н4 (г) + Н2О (г) = С2Н5ОН (г) Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю находим тепловой эффект вышеуказанной химической реакции, используя следствие из закона Гесса: ∆H0(С2Н5ОН)= -235,1 кДж/моль ∆H0(С2Н4)= 52,28 кДж/моль ∆H0(Н2О)=-241,83 кДж/моль ∆Hх.р. =(1∙∆H0(С2Н5ОН))-(1∙∆H0(С2Н4)+1∙∆H0(Н2О))=(1∙(-235,1))-(1∙(52,28)+1∙(-241,83))=-45,76 кДж Термохимическое уравнение реакции: Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. С2Н4 (г) + Н2О (г) = С2Н5ОН (г); ∆Hх.р. =-45,76 кДж Ответ: ∆Hх.р. =-45,76 кДж. П  ри какой температуре наступит равновесие системы ри какой температуре наступит равновесие системы4 НС1(г) + О2(г) 2 Н2О(г) + 2 Сl2(г); H = -114,42 кДж? Хлор или кислород в этой системе является более сильным окислителем и при какой температуре? Ответ: 891 К. Решение: Находим изменение энтропии системы в ходе реакции: ΔS0(HCl(г))= 186,8 Дж/моль∙К ΔS0(O2(г))=205 Дж/моль∙К ΔS0(Cl2(г))= 222,9 Дж/моль∙К ΔS0(H2O(г))= 188,7 Дж/моль∙К ΔS0х.р.=(2∙ΔS0(H2O(г))+2∙ΔS0(Cl2(г))) – (4∙ΔS0(HCl(г))+1∙ΔS0(O2(г)))= =(2∙188,7+2∙222,9) – (4∙186,8+1∙205)=-129 Дж/К=-0,129 кДж/К Находим изменение энергии Гиббса реакции: ΔG0х.р.= ΔH0-T∙ ΔS0=-116,4-298∙(-0,129)≈-78 кДж ΔG0х.р. < 0, поэтому при стандартных условиях прямая реакция протекает самопроизвольно. Следовательно, более сильным окислителем является кислород. Находим температуру, при которой наступит химическое равновесие: Если пренебречь зависимостями 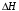 и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS » и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS » 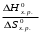 = =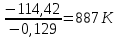 Следовательно, химическое равновесие устанавливается при 887 К. В интервале температур 0 – 887 К DG < 0, следовательно, прямая реакция протекает самопроизвольно и более сильным окислителем будет кислород; выше 887 К DG > 0, то есть прямая реакция не протекает самопроизвольно, а протекает обратная и более сильным окислителем будет хлор. Напишите выражение для константы равновесия гомогенной системы N  2 + 3 H2 2 NН3. 2 + 3 H2 2 NН3. Чему равна молярная концентрация эквивалента 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую (процентную) долю полученного раствора. Ответ: 9,96 н.; 6,3%. Решение: Дано: W1(NaOH)=30 % ρ1(p-pa)=1,328 г/см3V1(p-pa)=1 л=1000 мл V(H2O)=5 л=5000 мл или m(H2О))=5000 г, так как ρ(H2О)=1 г/см3 ρ2(p-pa)=1,054 г/см3 СЭКВ.1(NaOH) - ? W2(NaOH) - ? Решение: Находим молярную массу эквивалента гидроксида натрия: 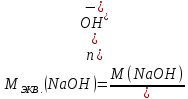 Находим нормальность исходного раствора: 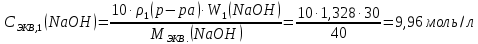 Находим массу исходного раствора: 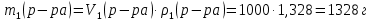 Находим массу гидроксида натрия в исходном растворе: 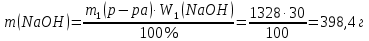 Находим объём конечного раствора: 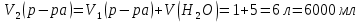 Находим массу конечного раствора: 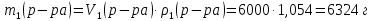 Находим массовую долю гидроксида натрия в конечном растворе: 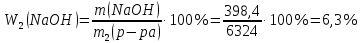 Ответ: СЭКВ.1(NaOH)=9,96 моль/л; W2(NaOH)=6,3 %. 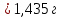 Ответ: СЭКВ.(AgNO3)=0,1 моль/л; m(AgCl)=1,435 г. Вычислите массовую долю (%) водного раствора сахара C12H22O11, зная, что температура кристаллизации раствора - 0,93 °С. Криоскопическая константа воды 1,86. Ответ: 14,6%. Решение: Дано: tкрист.(р-ра)=-0,93ºС КК=1,86º W(C12H22O11) - ? Решение: Для решения данной задачи используем второй закон Рауля, согласно которому понижение температуры кристаллизации и повышение температуры кипения раствора прямо пропорционально моляльной концентрации раствора: 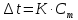 Также можно закон Рауля выразить и по-другому (выражение запишем для нашей задачи, то есть для расчёта изменения температуры кристаллизации раствора): 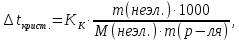 где КК – криоскопическая константа растворителя (воды); m(неэл.) - масса растворенного вещества – неэлектролита (в нашей задаче это глюкоза); М(неэл.) – молярная маса неэлектролита; m(р-ля) – масса растворителя (в нашей задаче – это вода). Исходя из данной формул можем вывести формулу для нахождения массы глюкозы в растворе: 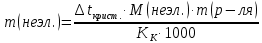 Находим понижение температуры кристаллизации раствора по сравнению с чистым растворителем (водой): 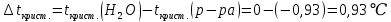 Находим массу сахарозы, которую необходимо растворить в 100 г воды: 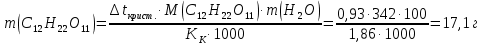 Находим массу раствора сахарозы в воде: 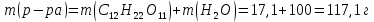 Находим массовую долю глюкозы в растворе: 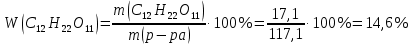 Ответ: W(С12Н22O11)=14,6 %. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) K2S и НС1; б) FeSО4 и (NH4)2S; в) Сг(ОН)3 и КОН. Решение: а) K2S+2HCl=2KCl+H2S↑ 2K++S2-+2H++2Cl-=2K++2Cl-+H2S↑ 2H++S2-=H2S↑ б) FeSO4+(NH4)2S=FeS↓+(NH4)2SO4 Fe2++SO42-+2NH4++S2-= FeS↓+2NH4++ SO42- Fe2++S2-= FeS↓ в) Cr(OH)3+KOH=K[Cr(OH)4] Cr(OH)3+K++OH-=K++[Cr(OH)4]- Cr(OH)3+OH-=[Cr(OH)4]- Во сколько раз концентрация ионов водорода в крови (рН = 7,36) меньше, чем в желудочном соке (рН = 1,00)? Ответ: В 2,3∙10 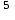 раз. раз.Решение: рН1=7,36 рН2=1,00 [H+]1 - ? [H+]2 - ? [H+]1: [H+]2 – ? Решение: Находим концентрации ионов Н+ в крови и желудочном соке: рН=-lg[H+]1 7,36=-lg[H+]1 [H+]1=4,365∙10-8 моль/л рН=-lg[H+]2 1,00=-lg[H+]2 [H+]2=10-1 моль/л Находим во сколько раз концентрация ионов Н+ в желудочном соке больше, чем в крови: 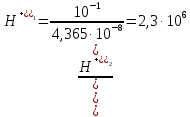 Ответ: в желудочном соке концентрация ионов Н+ больше, чем в крови в 2,3∙106 раз. К раствору FеС13 добавили следующие вещества: а) НС1; б) КОН; в) ZnCl2; г) Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. Решение: а) FеС13 – соль слабого основания и сильной кислоты, поэтому гидролизуется по катиону, а НС1 диссоциирует в водном растворе: FeCl3 ↔ Fe3+ + 3Cl-; Fe3+ + H2O ↔ FeOH2+ + H+; HCl ↔ H+ + Cl-. Если растворы этих веществ находятся в одном сосуде, то идёт угнетение гидролиза соли FeCl3, ибо образуется избыток ионов водорода Н+ и равновесие гидролиза сдвигается влево. б) KOH диссоциирует в водном растворе: FeCl3 ↔ Fe3+ + 3Cl-; Fe3+ + H2O ↔ FeOH2+ + H+; KOH ↔ K+ + OH-. Если растворы этих веществ находятся в одном сосуде, то идёт гидролиз соли FeCl3 и диссоциации КОН, ибо ионы Н+ и ОН-, связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н+ + ОН- = Н2О). При этом гидролитическое равновесие соли FeCl3 и диссоциация КОН сдвигаются вправо и гидролиз соли и диссоциация основания идут до конца с образованием осадка Fe(OH)3. Таким образом, при смешивании FeCl3 и КОН протекает реакция обмена. Ионно-молекулярное уравнение процесса: 2Fe3+ + 6OH- = 2Fe(OH)3↓ Молекулярное уравнение процесса: FeCl3 + 6KOH = 2Fe(OH)3↓ + 6KCl в) Соль FeCl3 и соль ZnCl2 гидролизуются обе по катиону: Fe3+ + H2O ↔FeOH2+ + H+ Zn2+ + H2O ↔ZnOH+ + H+ Если растворы этих солей находятся в одном сосуде, то идёт взаимное угнетение гидролиза каждой из них, ибо избыточное количество ионов Н+ вызывает смещение гидролитического равновесие влево, в сторону уменьшения концентрации ионов водорода Н+. г) Соль FeCl3 гидролизуется по катиону, а Na2CO3 – соль сильного основания и слабой кислоты, поэтому гидролизует по аниону: Fe3+ + H2O ↔ FeOH2+ + H+ CO32- + H2O ↔ HCO3- + ОH- Если растворы этих солей находятся в одном сосуде, то идёт взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН-, связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н+ + ОН- = Н2О). При образовании дополнительного количества воды гидролитическое равновесие обеих солей сдвигается вправо, и гидролиз каждой соли идёт до конца с образованием осадка Fe(OH)3 и слабого электролита H2CO3, то есть протекает совместный гидролиз солей: 2Fe3+ + 3CO32- + 6H2O ↔ 2Fe(OH)3 ↓ + 3H2CO3 2FeCl3 + 3Na2CO3 + 6H2O ↔ 2Fe(OH)3↓ + 3H2CO3 + 6NaCl или 2FeCl3 + 3Na2CO3 + 3H2O ↔ 2Fe(OH)3↓ + 3CO2 + 6NaCl Реакции выражаются схемами: Р + НIO3 + Н2О Н3PO4 + НI; H2S + Cl2 + H2O H2SО4 + НСl. Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое— восстановителем; какое вещество окисляется, какое —восстанавливается. Решение: Р0 + НI+5O3 + Н2О → Н3P+5O4 + НI- Р0-5е-→Р+5 6 восстановитель; процесс окисления 30 I+5+6e-→I- 5 окислитель; процесс восстановления 6Р + 5НIO3 + 9Н2О = 6Н3PO4 + 5НI Р – восстановитель, фосфор отдаёт пять электронов и окисляется. НIO3 – окислитель, иод присоединяет шесть электронов и восстанавливается. H2S-2 + Cl20 + H2O → H2S+6О4 + НСl- S-2-8е-→S+6 1 восстановитель; процесс окисления 8 Cl20+2e-→2Cl- 4 окислитель; процесс восстановления H2S + 4Cl2 + 4H2O = H2SО4 + 8НСl H2S – восстановитель, сера отдаёт восемь электронов и окисляется. Cl2 – окислитель, каждый атом хлора присоединяет один электрон и восстанавливается. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuS04; б) MgS04; в) Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций. Решение: а) CuSО4 Сравним стандартные электродные потенциалы цинка и меди: E0Zn2+/Zn=-0,762 B E0Cu2+/Cu=0,337 B Поскольку медь имеет больший электродный потенциал, то она менее активна, чем цинк и реакция протекает. Определим как будет изменяться масса цинковой пластинки: CuSO4 + Zn → ZnSO4 + Cu↓ Zn0 - 2e → Zn+2 | 1 | 1 Cu+2 + 2e → Cu0 | 1 | 1 M(Zn) = 65 г/моль M(Cu) = 64 г/моль Из уравнения реакции видно, что когда растворится 1 моль цинка (или 65 г), то на пластину осядет 1 моль меди (или 64 г). В итоге масса пластины уменьшится. б) MgSO4 Сравним стандартные электродные потенциалы магния и цинка: E0Mg2+/Mg=-2,38 B E0Zn2+/Zn=-0,762 B Поскольку магний имеет меньший электродный потенциал, то он активнее, чем цинк и реакция протекать не будет. Следовательно, масса цинковой пластинки не изменяется. в) Рb(NО3)2 Сравним стандартные электродные потенциалы свинца и цинка: E0Pb2+/Pb=-0,126 B E0Zn2+/Zn=-0,762 B Поскольку свинец имеет больший электродный потенциал, то он менее активен, чем цинк и реакция протекает. Определим как будет изменяться масса кадмиевой пластинки: Pb(NO3)2 + Zn → Zn(NO3)2 + Pb↓ Zn0 - 2e → Zn+2 | 1 | 1 Pb+2 + 2e → Pb0 | 1 | 1 M(Zn) = 65 г/моль M(Pb) = 207 г/моль Из уравнения реакции видно, что когда растворится 1 моль цинка (или 65 г), то на пластину осядет 1 моль свинца (или 207 г). В итоге масса пластины увеличится. При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла. Ответ: 17,37 г/моль. Решение: Дано: τ=1,5 ч=5400 с m(Me)=1,75 г I=1,8 A МЭКВ.(Ме) - ? Решение: Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока: 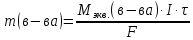 , ,m - масса образовавшегося вещества , г; Мэкв.- молярная масса эквивалента вещества, г/ моль; I - сила тока, А; t - время электролиза, с; F - константа Фарадея (96500 Кл/моль). Отсюда, 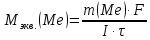 Находим молярную массу эквивалента металла, который выделится на катоде в процессе электролиза: 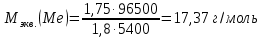 Ответ: 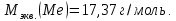 Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции. Решение: Медь не вытесняет водород из разбавленных кислот потому, что в электрохимическом ряду напряжений металлов медь стоит после водорода , то есть её стандартный электродный потенциал больше, чем у водорода). Если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода, потому что образуется гальванопара. E0Cu2+/Cu=0,337 B E0Zn2+/Zn=-0,762 B Цинк имеет стандартный электродный потенциал равный -0,762 В. Он меньше, чем стандартный электродный потенциал медного электрода, поэтому цинк выступает в роли анода, а медный электрод в роли катода. Схема коррозионного гальванического элемента с водородной деполяризацией: А(-) Zn|H2O,Н+|Cu (+)K Электродные процессы, протекающие в кислой среде: А(-): Zn0 – 2ē → Zn2+ 1 процесс окисления 2 K(+): 2Н+ + 2ē → Н2 1 процесс восстановления Суммарная реакция коррозии: Zn0 + 2H+→ Zn2+ + Н2↑ Поскольку не указана кислота, в которую погружена гальванопара цинк-медь, то будем считать, что продуктом коррозии в кислой среде является соль цинка (Zn2+ ). Например, Zn+2HCl→ZnCl2+H2↑ Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 14, 632 г гидрокарбоната магния? Ответ: 2 ммоль/л. Решение: Жесткость природной воды обуславливают соли кальция и магния. Карбонатная жесткость обусловлена солями Ca(HCO3)2 и Mg(HCO3)2. Карбонатная (временная) жесткость воды может быть устранена кипячением, так как гидрокарбонаты кальция и магния при кипячении разлагаются. Ca(HCO3)2 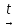 CaCO3↓+CO2↑+H2O CaCO3↓+CO2↑+H2OMg (HCO3)2 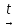 MgCO3↓+CO2↑+H2O MgCO3↓+CO2↑+H2OНекарбонатная жесткость воды обусловлена присутствием растворимых солей кальция и магния, которые не образуют осадок при кипячении. Чаще всего это хлориды и сульфаты кальция и магния. Некарбонатную (постоянную) жесткость воды устраняют химическими способами. Например, добавление Na2CO3 к жесткой воде приводит к устранению её жесткости: CaSO4+Na2CO3=CaCO3↓+Na2SO4 MgSO4+Na2CO3=MgCO3↓+Na2SO4 Временную жесткость воды также можно устранить при помощи добавления Na2CO3, но чаще применяют Са(ОН)2, так как этот способ дешевле: Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O Дано: V(H2O)=100 л m(Mg(HCO3)2)=14,632 г=14632 мг Ж - ? Решение: Находим молярную массу эквивалента гидрокарбоната магния: 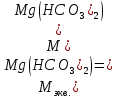 Находим жесткость воды: 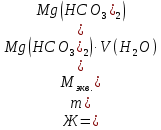 Ответ: Ж=3,2 ммоль/л. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
