Контрольная по химии. Химия. Решение Дано z (Me) 3 m (Me) 24г. V(H2) 03л. Найти Мэ (Ме) М (Ме) Аr (Me) Решение
 Скачать 64.85 Kb. Скачать 64.85 Kb.
|
|
При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу эквивалента, молярную и относительную атомную массы металла. Решение: Дано: z (Me) = 3; m (Me) = 3.24г.; V(H2) = 4.03л. Найти: Мэ (Ме) -? М (Ме) -? Аr (Me) -? Решение: Молярный объем эквивалента водорода равен Vэ(Н2) = 11,2 л/моль-экв.  = =  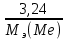 = = 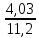 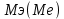 = =  = 9 г / моль-экв. = 9 г / моль-экв.М(Ме) = z (Me) * Мэ(Ме) = 3 * 9 = 27 г/ моль Ar (Me) = 27 a.e.м. Ответ: Мэ (Me) = 9 г / моль-экв. М(Ме) = 27 г/моль Ar (Me) = 27 а.е.м. Задание 2 Сколько миллилитров раствора 0,1н К2SO4 потребуется для осаждения сульфата бария из 50 г 5%-го раствора? Решение: Предположим, что для реакции взят хлорид бария. Запишем уравнение реакции: 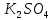 + Ba + Ba = 2KCl + Ba = 2KCl + Ba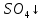 Из уравнения следует n ( 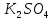 ) = n (Ba ) = n (Ba  ) )Количества вещества равно относительно массы вещества к молярной массе вещества. n = 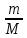 ω (Ba  ) = ) =  Находим массу хлорида бария в растворе: M (Ba  ) = ) = 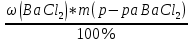 = = 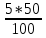 = 2.5 г. = 2.5 г.Находим количество вещества хлорида бария: n(Ba  ) = ) = 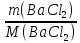 = = 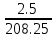 = 0.012 моль = 0.012 мольЗадание 3 Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных 3d-орбиталей у атомов последнего элемента? Ответ: 14 элемент – это кремний Si. 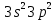 40 элемент – это цирконий Zr. 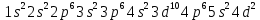 На 4d-орбиталях (всего 5) данного элемента находятся 2 электрона, то есть на 2-х 4d-орбиталях имеется по 1 электрону и ещё 3 4d-орбитали свободны. Задание 4 Какой из элементов четвертого периода - ванадий или мышьяк -обладает более выраженными металлическими свойствами? Какой их этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов. Ответ: Ванадий - химический элемент с символом V и атомным номером 23. Это твердый, серебристо-серый, ковкий переходный металл. Элементарный металл редко встречается в природе, но после выделения искусственно образование оксидного слоя (пассивация) несколько стабилизирует свободный металл от дальнейшего окисления. Мышьяк - химический элемент 15-й группы, четвёртого периода периодической системы, с атомным номером 33. На внешнем энергетическом уровне у атома ванадия два электрона, а у мышьяка - пять электронов. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют отрицательные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка, проявляющего слабые восстановительные свойства, более свойственны окислительные. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия сильнее выражены, чем у мышьяка. Мышьяк относится к p-элементам поэтому с водородом он образует соединение с ковалентно-полярной связью (мышьяковистый водород – AsH3) такая связь практически всегда образует молекулярную кристаллическую решетку (связи в молекулах прочные, но между молекулами связи очень слабые), поэтому мышьяк способен образовывать газообразное соединение с водородом. Задание 5 Нарисуйте энергетическую схему образования молекулы Не2 и молекулярного иона Не2+ по методу молекулярных орбиталей. Как метод МО объясняет устойчивость иона Не2+ и невозможность существования молекулы Не2? Ответ: Схема образования молекулы Не2 имеет вид: Молекулярные орбитатели   σ1S σ1S     Атомные орбитатели Не Атомные орбитатели Не Атомные орбитатели Не Атомные орбитатели Не  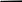 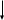    1S 1S   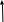 1S 1Sσ1S Определим порядок связи:  = 0 = 0Следовательно, порядок связи равен нулю, то молекула Не2 должна быть энергетически неустойчивой, поскольку здесь из четырёх электронов, которые должны разместиться на МО, два займут связывающую (1s), а два - разрыхляющую (* 1S) МО. Следовательно, образование молекулы Не2 не будет сопровождаться выделением энергии. Действительно молекулы Не экспериментально не получены. Схема образования иона Не2+ имеет вид: Молекулярные орбитатели 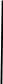   σ1S σ1S   Атомные орбитатели Не Атомные орбитатели Не Атомные орбитатели Не Атомные орбитатели Не      1S 1S    1S 1Sσ1S Определим порядок связи: ω = 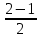 = 0,5 = 0,5В молекулярном ионе Не2+ порядок связи равен 0,5, следовательно, образование данного иона будет сопровождаться выделением энергии. При его образовании два электрона занимают связывающую МО, а третий электрон – занимает разрыхляющую МО, что и приводит данную частицу к устойчивому существованию. Действительно существование иона Не2+ экспериментально подтверждено и установлено, что при его образовании выделяется энергия. Задание 6 Почему π-нитрофенол имеет намного более высокую температуру кипения, чем о-нитрофенол? Ответ: Высокая температура кипения π-нитрофенола обусловлена наличием межмолекулярных водородных связей. Из-за межмолекулярных связей м- и π -нитрофенолы образуют ассоциаты и поэтому их нельзя перегнать с водяным паром. У о-нитрофенола образуется в большей степени внутримолекулярная водородная связь, поэтому он не обладает свойствами ассоциированных жидкостей. Задание 7 На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите Δ 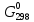 реакции, протекающей по уравнению 4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(г). Возможна ли эта реакция при стандартных условия. реакции, протекающей по уравнению 4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(г). Возможна ли эта реакция при стандартных условия.Ответ: 4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(г) Δ  = ∑ Δ = ∑ Δ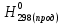 - ∑ Δ - ∑ Δ = 4 * 90,37 + 6 * (-241,83) – 4 * (-46,19) = - 904, 74 кДж = 4 * 90,37 + 6 * (-241,83) – 4 * (-46,19) = - 904, 74 кДжΔ 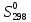 = ∑ Δ = ∑ Δ - ∑ Δ - ∑ Δ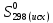 = 4 * 210,2 + 6 * 188,72 – (4 * 192,5 + 5 * 205,03 = 177,97 Дж/моль*К = 0,17797 кДж/моль*К = 4 * 210,2 + 6 * 188,72 – (4 * 192,5 + 5 * 205,03 = 177,97 Дж/моль*К = 0,17797 кДж/моль*КΔ 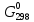 = Δ H – T * Δ S = - 904, 74 – 298 * (0, 17797) = - 957,78 кДж/моль = Δ H – T * Δ S = - 904, 74 – 298 * (0, 17797) = - 957,78 кДж/мольСледовательно, Δ 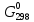 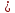 0, то данный процесс при стандартных условиях может протекать самопроизвольно. 0, то данный процесс при стандартных условиях может протекать самопроизвольно.Задание 8 Подсчитав тепловой эффект и изменение энергии Гиббса при 25°C для реакции CO2(г) + 4H2(г) = CH4(г) + 2H2O(ж), определите ΔS0 для этой реакции. Ответ: CO2(г) + 4H2(г) = CH4(г) + 2H2O(ж) Δ  = ∑ Δ = ∑ Δ 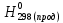 - ∑ Δ - ∑ Δ 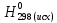 = - 74,85 + (2 * -285,84) – (- 393,51) = -253,02 кДж = - 74,85 + (2 * -285,84) – (- 393,51) = -253,02 кДжΔ 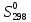 = ∑ = ∑  - ∑ - ∑ 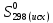 = 186,19 + 2 * 69,94 – (213,65 + 4 * 130,59) = - 409,94 Дж/моль*К = - 0,40994 кДж/моль*К = 186,19 + 2 * 69,94 – (213,65 + 4 * 130,59) = - 409,94 Дж/моль*К = - 0,40994 кДж/моль*КΔ 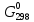 = ΔH – T * ΔS = - 253,02 – 298 * (- 0,40994) = - 130,86 кДж/моль = ΔH – T * ΔS = - 253,02 – 298 * (- 0,40994) = - 130,86 кДж/мольТак как Δ 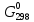 < 0, то данный процесс при стандартных условиях может протекать самопроизвольно. < 0, то данный процесс при стандартных условиях может протекать самопроизвольно.Задание 9 В газовой фазе протекают две реакции: основная А +В  C +D (1) и побочная А C +D (1) и побочная А  Е (2). Как изменится соотношение скоростей основной и побочной реакций при увеличении давления в 3 раза, если скорость реакций (1) и (2) описывается уравнениями Е (2). Как изменится соотношение скоростей основной и побочной реакций при увеличении давления в 3 раза, если скорость реакций (1) и (2) описывается уравнениями  = =  ; ;  = =  ? ?Решение: Скорости реакций до изменения давления равны: Изменения давления в 3 раза равнозначно увеличению концентрации реагентов в 3 раза. Находим скорости реакций после увеличения давления:  = =  = 9 = 9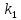 * * 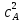  = = 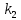 * *  = 3 = 3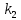 * * 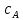 Ответ: (1) = 9 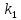 * * 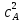 ; (2) = 3 ; (2) = 3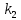 * * 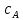 Задание 10 В гомогенной газовой системе А + 2В  С + D равновесие установилось при концентрациях (моль/л): [В] = 0,06 и [С] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. С + D равновесие установилось при концентрациях (моль/л): [В] = 0,06 и [С] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В.Решение: А + 2В  С + D С + D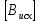 = 2*0,06 + 0,02 = 0, 0012 моль/л = 2*0,06 + 0,02 = 0, 0012 моль/л = = 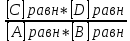 0,04 = 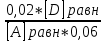  = 0,12 = 0,12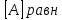 = 12 * = 12 *   = [А]равн * 0,02 = [А]равн * 0,02[D]равн = [С]равн = 0,02 моль/л [А]исх = 12 * 0,02 +0,02 = 0,26 моль/л Ответ: [А]исх = 0,26 моль/л; [В]исх = 0,0012 моль/л |
