Решение Иодхлорметрическое титрование титриметрический метод анализа, в котором в качестве титранта используется монохлорид иода
 Скачать 42.02 Kb. Скачать 42.02 Kb.
|
|
47. Окислительно-восстановительное титрование: йодхлорометрия. Основа метода. Условия проведения. Химизм. Титрант. Индикаторы. Привести примеры. Решение: Иодхлорметрическое титрование – титриметрический метод анализа, в котором в качестве титранта используется монохлорид иода. В фармацевтическом анализе обычно используется такое титрование, при котором продуктом восстановления ICl является I-. Иодхлорметрическое титрование, в целом, похоже на иодометрическое. Хлорид иода является более сильным окислителем, чем иод и более сильным электрофилом, что позволяет использовать его в качестве реагента в реакциях иодирования органических соединений. Растворы ICl более устойчивы, чем растворы иода. Стандартный раствор ICl является вторичным. Это вещество получают окислением иодида калия иодатом калия в присутствии HCl: 2KI + KIО3 + 6 НCl → 3ICl + 3KCl + 3Н2О Стандартизацию раствора ICl обычно проводят способом иодометрического титрования. К стандартизируемому раствору прибавляют избыток KI и оставляют в защищённом от света месте на 15 минут. ICl + KI → I2 + KCl Выделившийся иод титруют стандартным раствором Na2S2O3. Конечную точку хлориодометрического титрования обнаруживают с помощью электрохимических методов (потенциометрия, амперометрия) либо визуально. Хлориодометрическое титрование проводится в кислой, нейтральной или слабощелочной среде и может быть прямым или обратным. В случае прямого титрования определяемое вещество титруют стандартным раствором ICl. Таким образом можно определять, например, аскорбиновую кислоту, а также As(III), Sb(III), Sn(II) и т.д: 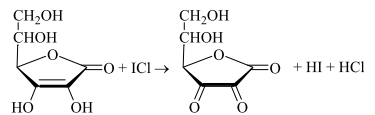 При обратном титровании к определяемому веществу добавляют точное количество взятого в избытке стандартного раствора ICl. После протекания реакции (если необходимо реакционную смесь нагревают) избыток ICl восстанавливают иодидом калия до I2, который титруют стандартным раствором Na2S2O3. Таким образом можно, определять различные органические вещества, способные вступать в реакцию SE с I+ : фенолы, сульфаниламиды, производные п-аминобензойной кислоты, гетероциклические соединения (этакридина лактат) и т.п. Примеры 1. Обратное иодхлорметрическое определение фенилсалицилата проводят после предварительного гидролиза: 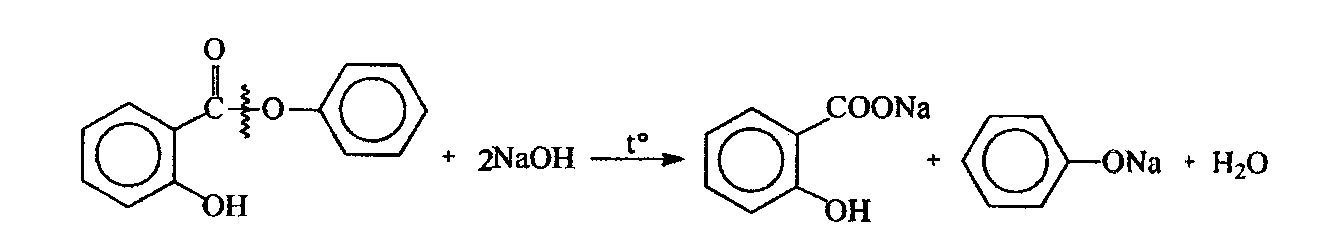 К продуктам гидролиза добавляют избыток солянокислого титрованного раствора йодмонохлорида при этом по реакции электрофильного замещения происходит йодирование салициловой кислоты и фенола с образованием соответственно дийодсалицилата и трийодфенола: 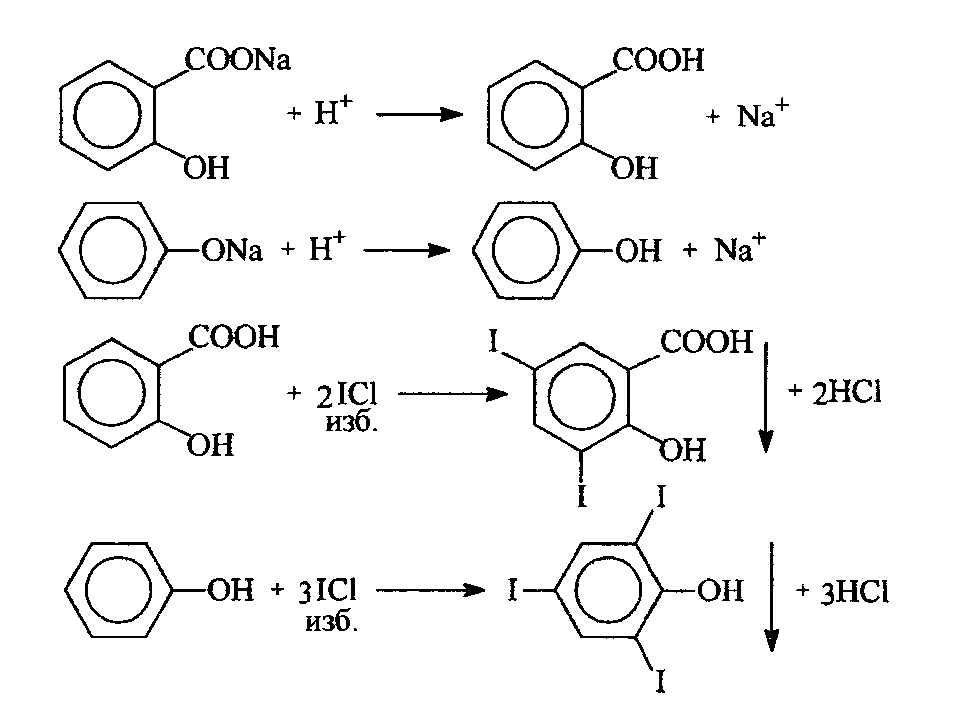 Избыток йодмонохлорида определяют йодометрически. Для этого добавляют калия иодид и выделяющийся в результате реакции йод титруют титрованным раствором натрия тиосульфата до обесцвечивания по крахмалу: 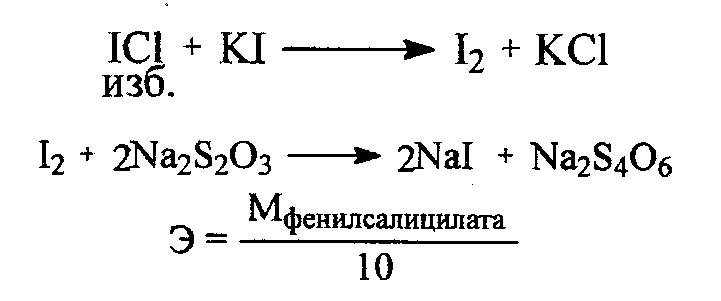 Каждая молекула иодмонохлорида эквивалентна двум атомам иода. Поэтому эквивалент фенола при иодировании составляет: 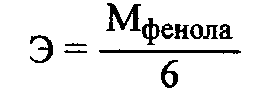 а эквивалент салициловой кислоты |
