тапсырма. тапсырма 11. Решение Плотность воды 1гмл, значит, масса воды m(H 2 O) . V 200 200 г
 Скачать 103.23 Kb. Скачать 103.23 Kb.
|
|
В 200 мл воды растворено 50 граммов хлорида ка- лия. Вычислите массовую долю вещества в растворе. 
Решение: Плотность воды ρ = 1г/мл, значит, масса воды m(H2O) = ρ . V = 1 . 200 = 200 г. Общая масса раствора складывается из массы воды и массы растворенного вещества: m(р-ра) = m(H2O) + m(в-ва) = 200 + 50 = 250 г. Теперь можно рассчитать массовую долю хлорида калия в растворе: ω =Ответ: ω = 20%. m(KCl ) m( раствора) ·100% = 50  250 250100% = 20%. . Какой объем аммиака (измеренный при нормальных условиях) израсходуется при приготовлении 1 кг 10%-ного раство- ра? Сколько воды надо взять для приготовления этого раствора? 
Решение: Из формулы m(NH) 3 ω = m ·100% ( раствора) можно найти массу растворенного аммиака. При этом масса раствора должна быть выражена в граммах: m(раствора) = 1кг = 1000 г, 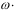 m(NH3) = m(NH3) =m(раствора) 100% = 10 1000 = 100 г. Аммиак в обычных условиях находится в газообразном состоя- нии. Для определения объема газообразного вещества можно вос- пользоваться следствием из закона Авогадро, согласно которому один моль любого газа при нормальных условиях занимает объем 22,4 литра. M(NH3) = 17 г/моль. 1 моль NH3 имеет массу 17 граммов и занимает объем 22,4 литра, 100 граммов ----------------------- Х литров  Х = 100 22,4 Х = 100 22,417 = 132 литра. V(NH3) = 132 литра. Зная массу раствора и массу растворенного вещества, можно найти массу воды: m(H2O) = m(раствора) − m(NH3) = 1000 – 100 = 900 г. Для того чтобы найти объем воды, надо использовать ее плот- ность ρ(H2O) = 1 г/мл: V(H2O) = = 900 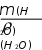 1 1= 900 мл. Ответ: V(NH3) = 132 литра; V(H2O) = 900 мл. Вычислите молярность раствора, содержащего 25,4 г FeCl2 в 500 мл раствора. 
Решение: Используем формулу для расчета молярной концентрации 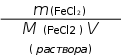 CM = . CM = .Молярная масса FeCl2 равна 127 г/моль. V(р-ра) = 500 мл = 0,5 л. 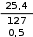 Ответ: СМ = 0,4М. Ответ: СМ = 0,4М.CM = = 0,4М. Вычислите нормальность 50%-ного раствора серной кислоты, плотность которого 1,5 г/мл. 
Решение: Для расчета нормальной концентрации по формуле 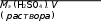 CН = CН =m(H2SO4 ) надо знать массу H2SO4, молярную массу ее эквивалента и объем раствора. Определим объем раствора. Очевидно, что 50%-ному раствору серной кислоты соответ- ствует какая-то вполне определенная нормальная концентрация, которая не зависит от количества раствора. Поэтому для выполне- ния расчета можно взять любое количество этого раствора. Для удобства вычислений возьмем 1 литр раствора: V(р-ра) = 1 л = 1000 мл. Определим массу H2SO4. Масса взятого раствора m(раствора) = V(раствора) · ρ(раствора) = 1000 . 1,5 = 1500 г. Из формулы для расчета массовой доли можно найти массу растворенного вещества: m(H SO ) m(р ра) = 1500 50 = 750 г. Определим молярную массу эквивалента серной кислоты. Ее можно рассчитать по формуле эквивалента сложного веще- ства: 49 г/моль. 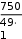 Ответ: СН = 15,3н. СН = 15,3н . Определите моляльную концентрацию 10%-ного раствора нитрата натрия. 
Решение: Для расчета моляльной концентрации ис- пользуем формулу m Cm = M (NaNO3) 1000 , M(NaNO3) = 85 г/моль. (NaNO3) m(H2O) Так же, как в предыдущем примере, для перехода от одного способа выражения концентрации раствора к другому можно взять любое количество этого раствора. В данном случае удобно взять 100 граммов раствора. Так как ω(NaNO3) = 10%, то по определению процентной концен- трации можно сказать, что в 100 граммах раствора содержится 10 граммов NaNO3 и 90 граммов воды, то есть m(NaNO3) = 10 г, m(H2O) = 90 г. 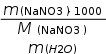  C = 0,13моль / кг . m Ответ: Cm = 0,13 моль/кг. 85 90  |
