Шутов А.А._Биотехнологии_ПР2. Решение. Сначала вычислим коэффициент диффузии при 20 С по формуле Для сероводорода Для воды
 Скачать 414.53 Kb. Скачать 414.53 Kb.
|
 МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «Тольяттинский государственный университет» Институт химии и энергетики (институт) ______«Химическая технология и ресурсосбережение» (кафедра) Практическое задание № 2 «Схема биотехнологического производства» по учебному курсу «Биотехнология» Вариант ____ (при наличии)
Тольятти 2022 ПРАКТИЧЕСКОЕ ЗАДАНИЕ № 2. ЗАДАЧИ ПО РАСЧЕТУ АДСОРБЦИОННОГО ОБОРУДОВАНИЯ Пример 1. Вычислить коэффициент диффузии сероводорода в воде при 50 °С. Решение. Сначала вычислим коэффициент диффузии при 20 °С по формуле: 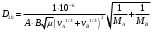 Для сероводорода Для воды А=1 В=4,7, 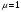 мПа с мПа с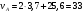 табл. 6.3 табл. 6.3 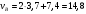 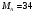 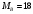 Подставляем эти значения в формулу: 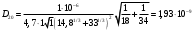 м²/с. м²/с.Вычисляем температурный коэффициент b по формуле 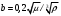 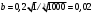 Искомый коэффициент диффузии по формуле равняется 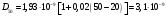 м²/с. м²/с.Пример 2. Определить коэффициент массопередачи в водяном скруббере при поглощении из газа диоксида углерода по следующим данным. В скруббер поступает 6000 м3/ч газовой смеси, считая при атмосферном давлении и при рабочей температуре. На скруббер подается 700 м3/ч чистой воды. Начальное содержание диоксида углерода в газе 30% (об.), конечное (в верху скруббера) 0,3% (об.). Давление в скр.уббере рабо = 20 кгс/см2. Температура 20 °С. В нижнюю часть скруббера загружено 4 т керамических колец 50x50X5 мм. Выше загружено 20 т колец 35x35x4 мм. Коэффициент смоченности считать равным единице. Решение. Вычислим суммарную поверхность всех колец. Поверхность колец 50x50x5 мм: 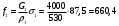 м²; м²;где 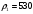 к/м³ - насыпная плотность насадки из колец 50X50X5 мм, к/м³ - насыпная плотность насадки из колец 50X50X5 мм, 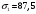 м²/м³ - удельная поверхность насадки (табл. XVII). м²/м³ - удельная поверхность насадки (табл. XVII).Аналогично вычисляем поверхность колец 35x35x4 мм: 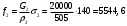 м²; м²;Суммарная поверхность всех колец: 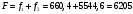 м²; м²;Определим количество диоксида углерода, поглощенного водой. Начальное количество диоксида углерода в газе (в низу скруббера): 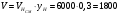 м³/ч; м³/ч;Количество диоксида углерода в выходящем газе (в верху скруббера): 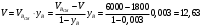 м³/ч; м³/ч;Поглощается водой: 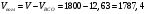 м³/ч; м³/ч;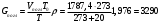 кг/ч т.е 3290/44=748 кмоль/ч кг/ч т.е 3290/44=748 кмоль/чгде 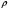 - 1,976 кг/м3 - плотность СО2 при нормальных условиях; 44 кг/кмоль - мольная масса диоксида углерода - 1,976 кг/м3 - плотность СО2 при нормальных условиях; 44 кг/кмоль - мольная масса диоксида углеродаНаходим движущую силу процесса абсорбции в низу скруббера. Парциальное давление диоксида углерода на входе в скруббер 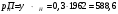 кПа кПагде 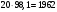 кПа - общее давление в скруббере. кПа - общее давление в скруббере.Мольная доля СО2 в воде, вытекающей из скруббера: 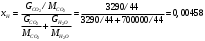 Коэффициент Генри Е для диоксида при 15 °С равен 0,93·106 мм рт. ст. (табл. ХLI), или 0,124·106 кПа; отсюда парциальное давление диоксида углерода в газе, равновесном с жидкостью, вытекающей из скруббера [уравнение (6.2)]: 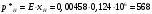 кПа; кПа;Движущая сила процесса абсорбции в низу скруббера: 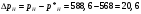 кПа; кПа;Определяем движущую силу процесса абсорбции на верху скруббера. Парциальное давление диоксида углерода в газе, выходящем вверху из скруббера: 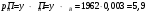 кПа; кПа;Так как вода на орошение скруббера подается чистая, то парциальное давление диоксида углерода в равновесном с водой газе равно нулю; отсюда движущая сила процесса абсорбции на верху скруббера: 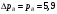 кПа; кПа;Средняя движущая сила для всего процесса: 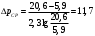 кПа; кПа;Коэффициент массопередачи: 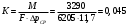 кг/м²·ч·кПа кг/м²·ч·кПаПример 3. Из критериального уравнения (6.45) вывести расчетную формулу для определения числа единицы переноса по газовой фазе. Решение. Из уравнения 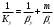 в котором 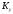 , , 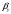 и и 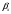 выражены в кмоль/(м2-с), получаем выражены в кмоль/(м2-с), получаем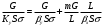 или в соответствии с уравнением (6.43) при 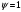 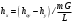 Пример 4 Определить коэффициент массоотдачи для газовой фазы в насадочном абсорбере, в котором производится поглощение диоксида серы из инертного газа (азота) под атмосферным давлением. Температура в абсорбере 22°С, он работает в пленочном режиме. Скорость газа в абсорбере (фиктивная) 0,5 м/с. Абсорбер заполнен кусками кокса ( 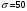 м2/м3, м2/м3, 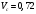 м3/м3) м3/м3)1. По уравнению для Нуссельта 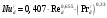 где: 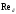 - постоянная Рейнольдса, - постоянная Рейнольдса, 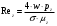 где г = 0,017710-6 Пас – вязкость воздуха (рис. VI) 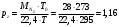 кг/м³ - плотность воздуха; кг/м³ - плотность воздуха;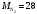 - молярная масса азота кг/кмоль - молярная масса азота кг/кмоль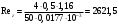 Коэффициент диффузии берем такой же, как в воздухе 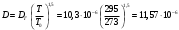 м2/с м2/сPrг = Г / (гDг) = 0,017710-3/(1,1611,5710-6) = 1,32 Где Dг = 10,310-6 м2/с – коэффициент диффузии при стандартных условиях 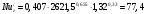 Определяем коэффициент массоотдачи в газовой фазе 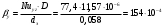 м/с м/с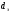 - эквивалентный диаметр, мм. - эквивалентный диаметр, мм.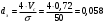 м мПример 6.4. В массообменном аппарате, работающем под давлением рабс = 4 кгс/см2, коэффициенты массоотдачи имеют следующие значения: 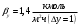 , , 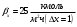 . Равновесные составы газовой и жидкой фаз характеризуются законом Генри . Равновесные составы газовой и жидкой фаз характеризуются законом Генри 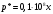 . Определить: а) коэффициенты массопередачи Ку и Кх; б) во сколько раз диффузионное сопротивление жидкой фазы отличается от диффузионного сопротивления газовой фазы: . Определить: а) коэффициенты массопередачи Ку и Кх; б) во сколько раз диффузионное сопротивление жидкой фазы отличается от диффузионного сопротивления газовой фазы:Решение. Приведем уравнение равновесия к виду у* = тх: 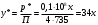 Находим коэффициенты массопередачи 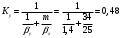 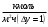 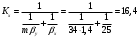 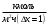 Проверка 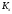 / /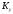 = 16,4/0,48 = 34 =m; = 16,4/0,48 = 34 =m;Отношение диффузионных сопротивлений жидкой и газовой фаз при движущей силе 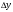 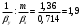 Такое же отношение будет и при движущей силе Ад;. Диффузионное сопротивление жидкой фазы в 1,9 раза больше сопротивления газовой фазы. Пример 5. Воздух атмосферного давления при температуре 40 °С насыщен водяным паром. Определить парциальное давление воздуха, объемный и массовый % пара в воздушно-паровой смеси и его относительную массовую концентрацию, считая оба компонента смеси идеальными газами. Атмосферное давление 750 мм рт. ст. Определить также плотность воздушно- паровой смеси, сравнить ее с плотностью сухого воздуха. Решение. По табл. XXXVIII находим, что при t = 34 °С давление насыщенного водяного пара составляет 55,32 мм рт. ст. Это давление является парциальным давлением водяного пара 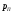 в воздушно-паровой смеси, а парциальное давление воздуха равняется: в воздушно-паровой смеси, а парциальное давление воздуха равняется: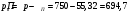 мм рт. ст мм рт. стМольная (объемная) доля водяного пара в смеси: у = Рп/П = 55,32/750 = 0,0738. Массовая доля пара: 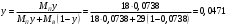 Относительная массовая концентрация: 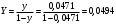 кг пара/кг воздуха; кг пара/кг воздуха;Плотность воздушно-паровой смеси рассчитываем как сумму плотностей компонентов, взятых каждая при своем парциальном давлении: 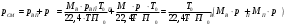 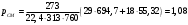 кг/м³; кг/м³;Можно рассчитать плотность смеси иначе. Мольная масса смеси: 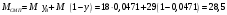 кг/кмоль; кг/кмоль;Плотность смеси при П = 745 мм рт. ст. и t=40ºC 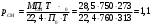 кг/м³; кг/м³;Плотность сухого воздуха при тех же давлении и температуре: 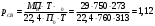 Пример 6. Жидкая смесь содержит 65% (мол.) толуола и 35% (мол.) четыреххлористого углерода (ч. х. у.). Определить относительную массовую концентрацию толуола 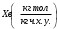 и его объемную массовую концентрацию и его объемную массовую концентрацию 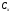 , (в кг/м3). , (в кг/м3).Решение: Относительная массовая концентрация толуола: 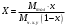 где 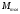 - мольная масса толуола (92 кг/кмоль); - мольная масса толуола (92 кг/кмоль); 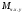 то же четыреххлористого углерода (154 кг/кмоль); х - мольная доля толуола. то же четыреххлористого углерода (154 кг/кмоль); х - мольная доля толуола.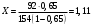 кг тол/ кг ч. х. у кг тол/ кг ч. х. уЧтобы рассчитать объемную массовую концентрацию толуола Си, необходимо знать плотность смеси рсм. Для расчета плотности предварительно найдем массовую долю толуола х. По табл. 6.2: 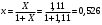 Далее по табл. IV находим: плотность толуола ртол = 875 кг/м3, плотность четыреххлористого углерода рч х у = 1640 кг/м3. Считая, что изменение объема при смешении не происходит, т. е. объем смеси равен сумме объемов компонентов, находим объем 1 кг смеси 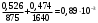 кг/м³; кг/м³;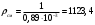 кг/м³; кг/м³;Можно рассчитать рсм и так: 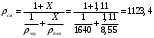 кг/м³; кг/м³;Объемная массовая концентрация толуола: 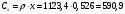 кг/м³; кг/м³;Пример 7. В массообменном аппарате - абсорбере коэффициент массопередачи 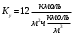 Инертный газ (не переходящий в жидкость) - азот. Давление рабс в аппарате 750 мм рт. ст., температура 30 °С. Определить значения коэффициента массопередачи Инертный газ (не переходящий в жидкость) - азот. Давление рабс в аппарате 750 мм рт. ст., температура 30 °С. Определить значения коэффициента массопередачи 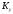 в следующих единицах: 1) в следующих единицах: 1) 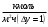 ; 2) ; 2)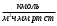 ; 3) ; 3)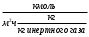 Решение Напишем равенства 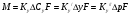 где М - мольный расход переходящего в жидкость компонента, кмоль/ч. Тогда 1) 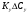 = =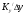 , т.е , т.е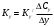 Из табл. 6.2 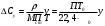 В данном примере 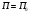 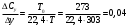 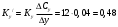 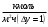 ; ;2) по уравнению 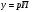 ; ; 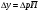 ; ;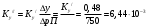  или или 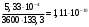 3) из равенств 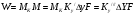 где W – массовый расход переходящего компонента, кг/ч 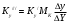 По табл. 6.2 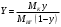 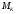 , , 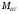 - молярные массы переходящего компонента и инертного газа. При малых значениях: - молярные массы переходящего компонента и инертного газа. При малых значениях: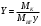 Отсюда 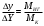 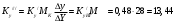 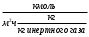 Пример 8. Определить теоретически минимальный расход жидкого поглотителя с мольной массой 260 кг/кмоль, необходимый для полного извлечения пропана и бутана из 2000 м³/ч (считая при нормальных условиях) газовой смеси. Содержание пропана в газе 20% (об.), бутана 15% (об.). Температура в абсорбере 40°С, абсолютное давление 3 кгс/сма (294 кПа). Растворимости бутана и пропана в поглотителе характеризуются законом Рауля. Решение: Максимальная концентрация (мольная доля) пропана в поглотителе, вытекающем из скруббера (равновесная с входящим газом), определяется по уравнению (6.8): 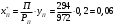 где 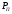 = 972 кПа (9,9 кгс/см'2) - давление насыщенного пара пропана при 40°С. = 972 кПа (9,9 кгс/см'2) - давление насыщенного пара пропана при 40°С.Количество содержащегося в газовой смеси пропана, которое требуется поглощать: 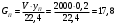 кмоль/ч; кмоль/ч;Минимальный расход поглотителя для поглощения пропана определяется из уравнения: 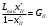 где 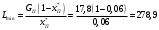 кмоль/ч; кмоль/ч;Или 278,9· 260 = 72505 кг/ч Наибольшая возможная концентрация бутана в поглотителе, вытекающем внизу из скруббера: 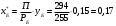 где 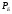 = 255 кПа (2,6 кгс/см2) - давление насыщенного пара бутана при 40 °С, = 255 кПа (2,6 кгс/см2) - давление насыщенного пара бутана при 40 °С,Количество поглощаемого бутана: 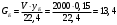 кмоль/ч; кмоль/ч;Минимальный расход поглотителя для поглощения бутана: 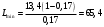 кмоль/ч; кмоль/ч;Минимальный расход поглотителя для полного поглощения бутана значительно меньше, чем для поглощения пропана, следовательно, найденным выше количеством поглотителя (278,9 кмоль/ч) бутан будет полностью уловлен. Пример 6.2. Воздух атмосферного давления при температуре 50 °С насыщен водяным паром. Определить парциальное давление воздуха, объемный и массовый % пара в воздушно-паровой смеси и его относительную массовую концентрацию, считая оба компонента смеси идеальными газами. Атмосферное давление 740 мм рт. ст. Определить также плотность воздушно- паровой смеси, сравнить ее с плотностью сухого воздуха. Решение. По табл. XXXVIII находим, что при t = 50 °С давление насыщенного водяного пара составляет 92,51 мм рт. ст. Это давление является парциальным давлением водяного пара 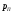 в воздушно-паровой смеси, а парциальное давление воздуха равняется: в воздушно-паровой смеси, а парциальное давление воздуха равняется: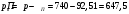 мм рт. ст мм рт. стМольная (объемная) доля водяного пара в смеси: у = Рп/П = 92,51/740 = 0,125. Массовая доля пара: 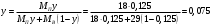 Относительная массовая концентрация: 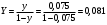 кг пара/кг воздуха; кг пара/кг воздуха;Плотность воздушно-паровой смеси рассчитываем как сумму плотностей компонентов, взятых каждая при своем парциальном давлении: 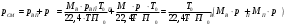 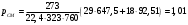 кг/м³; кг/м³;Можно рассчитать плотность смеси иначе. Мольная масса смеси: 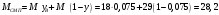 кг/кмоль; кг/кмоль;Плотность смеси при П = 740 мм рт. ст. и t=50ºC 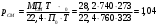 кг/м³; кг/м³;Плотность сухого воздуха при тех же давлении и температуре: 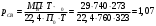 кг/м³; кг/м³; |
