Химия. Решение Уравнение реакции CuO х х2НCl СuCl х хH 2 O
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
75,0 г оксида меди прореагировало без остатка с 68,7 г соляной кислоты. Вычислите молярную массу эквивалента оксида меди. Напишите уравнение реакции, если одним из продуктов является хлорид меди.
Запишите в тетрадь уравнение реакции CO(r)+H2(r)=C(k)+H2O(r): 1. Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции. 2. Покажите, какой из факторов процесса, энтальпийный или энтропийный, способствует, самопроизвольному протеканию процесса в прямом направлении. 3. Определите, в каком направлении (прямом или обратном) при 298 K будет протекать реакция, если все ее участники находятся в стандартном состоянии. 4. Рассчитайте температуру, при которой равновероятны оба направления реакции. При каких температурах, выше или ниже рассчитанной, более вероятно протекание указанной реакции в прямом направлении? Решение: CO(r)+H2(r)=C(k)+H2O(r) Табличные данные: ΔН0298(CO(r)) = -110,53кДж/моль ΔН0298 (H2(r)) = 0 ΔН0298 (С(к)) = 0 ΔН0298 (H2O(r)) = -241,84 кДж/моль Следствие из закона Гесса: изменение энтальпии химической реакции равно разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов: ΔН0298х р. = (n * ΔН0298прод. ) – (m * ΔН0298 исх), где n, m – стехиометрические коэффициенты. Аналогичным образом можно рассчитывать изменение и других функций – энтропии (ΔS0298х р.), энергии Гиббса (ΔG0298х р.). ΔН0298х р. = ΔН0298 (H2O(r)) - ΔН0298(CO(r)) = -241,84-(-110,53) = -131,31кДж (реакция экзотермическая). ΔS0298(CO(r)) = 197,40 Дж/(моль*К) ΔS0298 (H2(r)) = 130,60 Дж/(моль*К) ΔS0298 (С(к)) = 5,74 Дж/(моль*К) ΔS0298 (H2O(r)) = 188,74 Дж/(моль*К) ΔS0298х р. = (ΔS0298 (H2O(r)) + ΔS0298 (C(к)) – (ΔS0298(CO(r) + ΔS0298(H2(r))) = (188,74+5,74) – (197,40+130,60) = 194,48 – 328,0 = -133,52 Дж/К ΔG0298х р. = ΔH0298х р. – T* ΔS0298х р. При самопроизвольном протекании процесса в прямом направлении ΔG0298х р. должна быть <= 0. Вклады энтальпийного и энтропийного факторов существенно зависят от температуры. Если Т > 0 К, то больший вклад вносит энтальпийный фактор, ΔG0298х р —> ΔН0298х р. При низких температурах значение и знак ΔG0298х р. определяются значением и знаком ΔH0298х р. и самопроизвольно протекают, как правило, экзотермические реакции. Рассчитаем стандартное изменение энергии Гиббса реакции по уравнению из п.(2) ΔG0298х р. = ΔH0298х р. – T* ΔS0298х р. = -131310 – 298 * (-133,52) = -91521 Дж = -91,52 кДж Так как ΔG0298х р. <0, при 298 K будет протекать прямая реакция. Оба направления реакции равновероятны при ΔG0298х р. =0 Рассчитаем температуру: ΔH0298х р. – T* ΔS0298х р. = 0 -131310 – Т * (-133,52) =0 133,52Т = 131310 Т = 983 К В интервале температур 0-983К протекает прямая реакция, при температурах выше 983 протекает обратная реакция. Вычислите: константу равновесия обратимой реакции, исходные и равновесные концентрации компонентов в системах (величины, которые нужно вычислить, обозначены в таблице через x)
Решение: Константа равновесия данной реакции выражается уравнением: К = 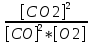 = = 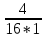 = 0,25 = 0,25 Исходные концентрации угарного газа и кислорода находим на основе уравнения реакции. Согласно уравнению реакции на образование 2 моль CO2 расходуется 1 моль O2. По условию задачи образовалось 2 моль CO2, на что израсходовалось 1 моль O2. Учитывая равновесную концентрацию кислорода, находим его исходную концентрацию: С(O2) = 1 + 1 = 2 моль/л. По уравнению реакции на образование 2 моль CO2 необходимо 2 моль CO. Исходная концентрация оксида углерода (II) С(CO) = 4 + 2 = 6 моль/л. Как изменится скорость прямой и обратной реакции, если объем газовой смеси увеличить (уменьшить) в n раз?
Решение: Согласно закону действия масс скорости (ν) прямой и обратной реакции до изменения объема будут равны: - скорость прямой реакции: υ пр = k*[N2]*[Н2]3 - скорость обратной реакции: υ обр = k*[NН3]2 После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [N2]’= 3[N2], [H2] = 3[H2]; [NH3] = 3[NH3]. При этих концентрациях скорости (ν2) прямой и обратной реакции примут значения:  = k*3[N2]*27[Н2]3 = 81* k*[N2]*[Н2]3 = k*3[N2]*27[Н2]3 = 81* k*[N2]*[Н2]3υ2 обр = k*9[NН3]2 = 9* k*[NН3]2 Тогда: 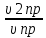 = 81 = 81 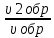 = 9 = 9При уменьшении объема гомогенной системы в 3 раза скорость прямой реакции возрастет в 81 раз, скорость обратной – в 9 раз Рассчитайте : а) массовую долю ω(%) растворенного вещества; б) молярную концентрацию СM(X); в) молярную концентрацию эквивалента Сэк ; г) титр Т; д) молярную долю χ растворенного вещества раствором, полученных при растворении вещества в воде (плотность раствора см. в приложении).
Решение: примем плотность воды равной 1 г/см3 (1 г/мл) А) массовая доля ω (%) растворенного вещества W (HNO3) = m(HNO3) / m(смеси) *100% m(смеси) = m(HNO3) + m(воды) m(воды) = V(воды) * ρ (воды) тогда: m(воды) = 192*1 = 192 г m(смеси) = 108+192 = 300г W (HNO3) = 108/300*100% = 36% Б) молярная концентрация СM(X) СM (HNO3) = υ(HNO3) / V(раствора) υ(HNO3) = m(HNO3) / M(HNO3) = 108/ 63 = 1,71 моль V(раствора) = m(раствора) / ρ(раствора) (где m(раствора) это m(смеси) из п.А, из того же пункта известно, что массовая доля азотной кислоты 36%). Справочно: ρ(раствора) 36% азотной кислоты 1,2205 г/см3 V(раствора) = 300/1,2205 = 245,8 см3 = 0,2458 дм3 СM (HNO3) = 1,71 / 0,2458 = 6,96 моль/дм3 (или моль/л) В) молярная концентрация эквивалента Сэк Сэкв (HNO3) = υ экв(HNO3) / V(раствора) υ экв(HNO3) = Э* υ(HNO3) Так как азотная кислота – одноосновная, Э=1 Тогда υ экв(HNO3) = υ(HNO3) Следовательно, Сэкв (HNO3) = СM (HNO3) = 6,96 моль-экв/дм3 (моль-экв/л) Г) титр Т; Титр - масса растворённого вещества (в граммах), содержащаяся в одном миллилитре раствора. Т (HNO3) = m(HNO3) / V(раствора) = 108 / 245,8 = 0,4394 г/см3 (г/мл) Д) молярная доля χ растворенного вещества Мольная доля – это отношение количества растворенного вещества к общему количеству вещества всех компонентов раствора: χ(HNO3) = υ (HNO3) /(υ (HNO3) + υ (H2O)) υ (H2O) = m(H2O) / M(H2O) = 192 / 18 = 10,7 моль χ(HNO3) = 1,71 / (1,71+10,7) = 0,138 или 13,8% Окислительно-восстановительные реакции протекают по приведенным схемам. Для каждой реакции укажите: а) окислитель и восстановитель; б) какое вещество окисляется, какое веществ восстанавливается. Составьте электронные уравнения и на их основании расставьте коэффициенты в уравнении реакции.
Решение: Ge+2KOH+O2=K2GeO3+H2O
12HCl+2CrO3=3Cl2+2CrCl3+6H2O
Составьте схему гальванического элемента из двух полуэлементов, напишите уравнение токообразующей реакции, рассчитайте ЭДС, Е и изменение свободной энергии Гиббса ΔG для составленного элемента.
Решение: В гальваническом элементе анодом становится металл, обладающий меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала. Кадмий имеет большее значение электродного потенциала восстановления (-0,40В), чем цинк (-0,763В). Значит, в данном гальваническом элементе кадмиевый электрод будет катодом, а цинк – анодом. На аноде протекает процесс окисления металла, а на катоде – процесс восстановления металла. Процессы окисления-восстановления на электродах: Анод (-) Zn0 - 2е → Zn2+ │1 - процесс окисления на аноде Катод (+) Cd2+ + 2е → Cd0 │1 - процесс восстановления на катоде Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме выражает происходящую в элементе реакцию: Zn + Cd2+ → Cd0 + Zn2+ Схема гальванического элемента А (-) | Zn | Zn2+ || Cd2+ | Cd | К (+) Для определения ЭДС гальванического воспользуемся уравнением Нернста: 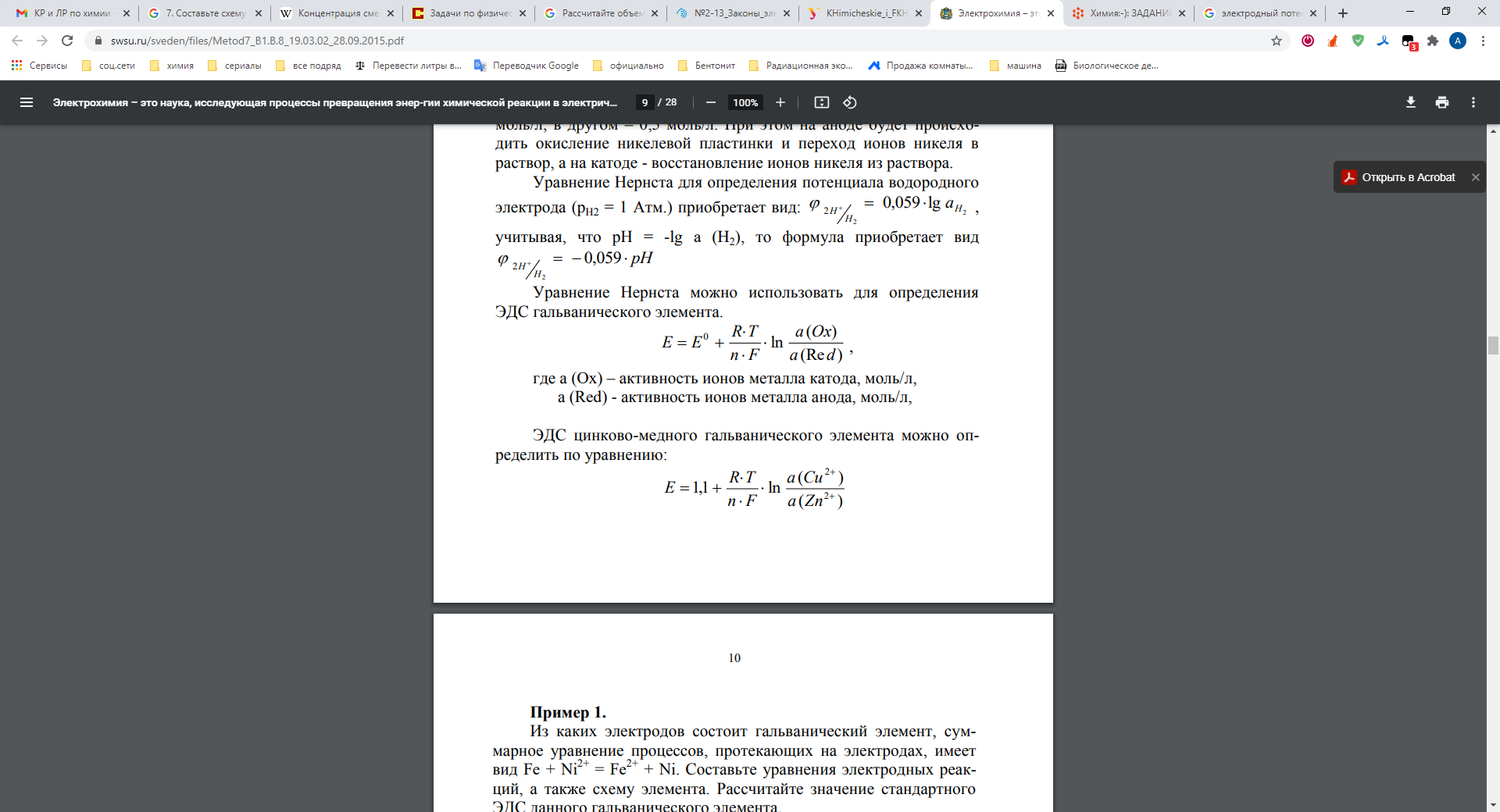 Е0 = ϕ°(Cd2+ / Cd) – ϕ°( Zn2+ / Zn) = -0,40- (-0,763) = 0,363 В Е = 0,363 +0,059/ 2 * Ln (0,02/0,05) = 0,363+0,0295*(-0.91) = 0,336 В Изменение энергии Гиббса Энергия Гиббса химической реакции в гальваническом элементе и его ЭДС связаны соотношением ΔG = −nFE, где n – число электронов, которые переходят от окислителя к восстановителю в стехиометрическом уравнении реакции. ΔG = − 2*96500*0,336 = - 64848 Дж = -64,8 кДж Напишите схемы катодного и анодного процессов при электролизе раствора соли с инертными элетродами. Рассчитайте массу (для газа – объем при н.у.) выделяющегося на катоде вещества при заданных условиях.
Решение: NiC2 – скорее всего, опечатка, так как соединение никеля с углеродом – карбид никеля Ni3C Примем соль как хлорид никеля NiCl2 Схема электролиза водного раствора хлорида никеля с инертным анодом: Уравнение диссоциации соли: NiCl2 → Ni2+ + 2Cl- Катод: Так как в ряду напряжений металлов никель расположен после алюминия и до водорода, то на катоде ионы никеля восстанавливаются вместе с водой: Ni2+ + 2е- = Ni0 2Н2О + 2е- = Н2 + 2ОН- Анод: Бескислородные анионы в водных растворах окисляются на аноде до галогенов: 2Cl- - 2е → Cl2 Добавим в обе части уравнения недостающие противоионы: 2Н2О + 2Cl- + Ni2+ = Н2 + 2ОН- + Cr + Cl2 Теперь можно записать уравнение в молекулярном виде: электролиз 2NiCl2 + 2H2O ======== 2Cl2 + H2 + Ni(OH)2 + Ni Рассчитаем объем водорода (при н.у.), выделяющегося на катоде: Время электролиза выражают в секундах: 0,5ч = 30 минут = 1800с Из закона Фарадея:  m(H2) = 3*1800*2 / (2* 96485) = 0,056 г 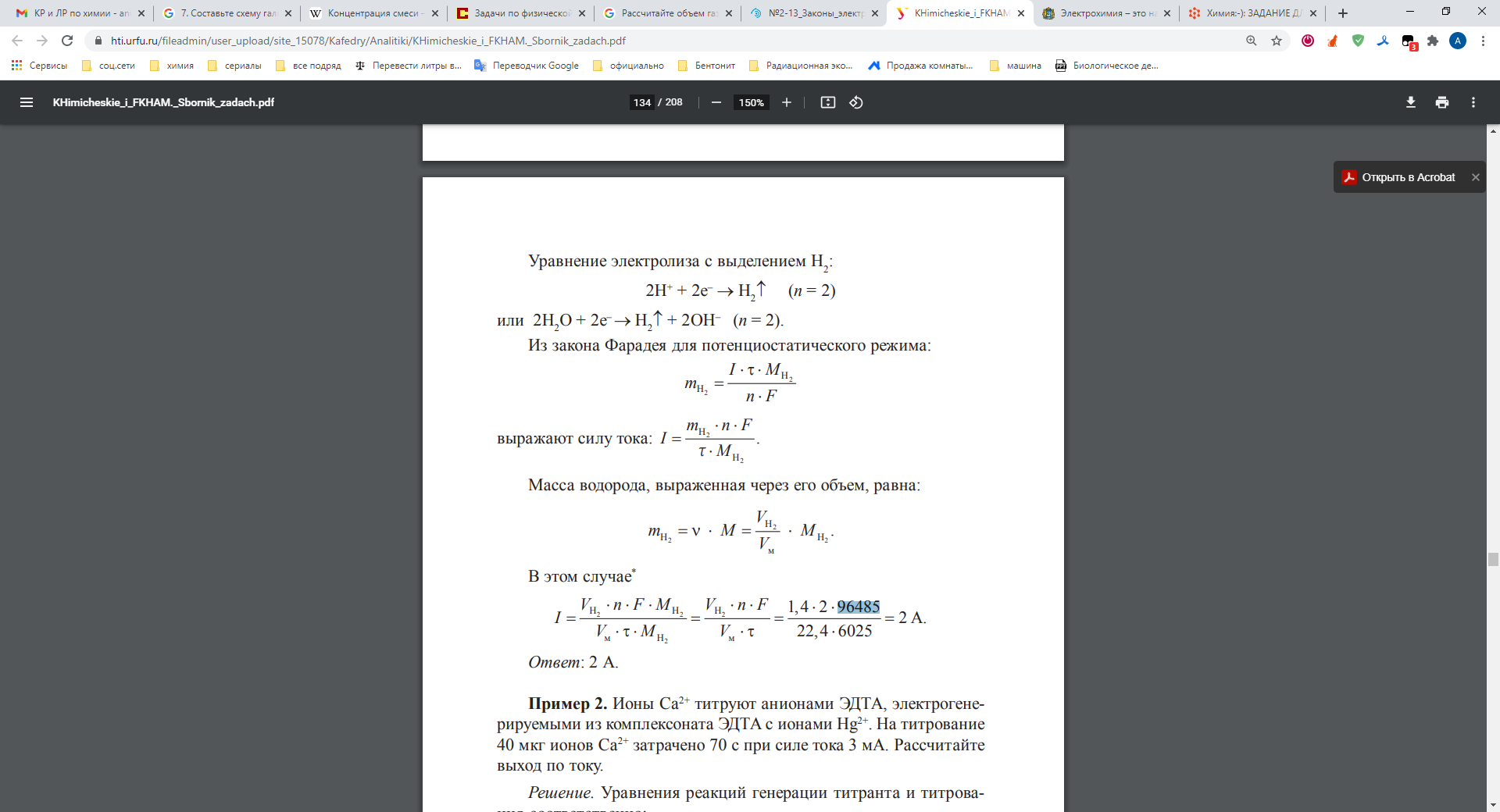 тогда V(H2) = m(H2) * Vm / M(H2) = 0,056*22,4/2 = 0,627дм3 Какие коррозионные процессы могут протекать при контакте двух металлов? Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии в заданных условиях. Если коррозия невозможна, то объясните почему.
Решение: По условиям протекания коррозии при контакте двух металлов, различают несколько видов коррозии: - контактную – электрохимическую коррозию, вызванную контактом металлов, имеющих разные электродные потенциалы в данном электролите; - щелевую – коррозию в щелях и зазорах между металлами. Рассмотрим варианты металлов и среды по заданию. ϕ°(Cu2+ / Cu) = 0,345В ϕ°(Ag+ / Ag) = 0,799В Оба представленных металла находятся в ряду напряжений после водорода и имеют положительный потенциал, что говорит о преимущественной роли окислительных свойств, кроме того, на оба металла разбавленные кислоты не действуют. Разница в значении потенциала в данной паре невелика: данные металлы, находясь в контакте, очень мало подвержены контактной коррозии, а их соединение в технике (металлических конструкциях) проверено и одобрено в нормативной документации (ГОСТ 9.005). Контакт меди с серебром разрешен даже в условиях влажных и аэрируемых сред. Из вышеперечисленного следует, что данная пара металлов подвергаться значимой коррозии в указанных средах не будет. | |||||||||||||||||||||||||||||||||||||||||||||||||

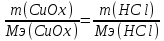
 CO + O2 2 CO2
CO + O2 2 CO2
 2 + 3H2 2 NH3
2 + 3H2 2 NH3