Решение Вычислим критические параметры исходя из уравнения ВандерВаальса УравнениеМенделееваКлайперона
 Скачать 112.14 Kb. Скачать 112.14 Kb.
|
|
Контрольная работа 1 1. Полагая, что углекислый газ подчиняется уравнению Ван-дер-Ваальса, вычислите критические параметры СО2 – температуру, давление и мольный объём. Примите, что постоянные уравнения Ван-дер-Ваальса для СО2 следующие: a = 3.592 л2·атм·моль−2, b = 0.04267 л·моль−1 . Приведите аналогичные расчеты для: температуры 298К; при условии что газ описывается уравнением Менделеева-Клапейрона. Решение: Вычислим критические параметры исходя из уравнения Ван-дер-Ваальса 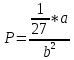 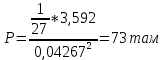 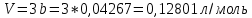 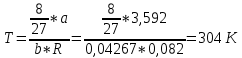 УравнениеМенделеева-Клайперона 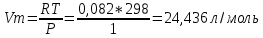 2. В цилиндр поместили пять молей газа - неона и было совершенно адиабатическое расширение. В результате расширения высота цилиндра увеличилась на 25 см относительно исходного положения. Примите, что трение отсутствует, а исходные данные следующие поперечное сечение цилиндра 25 см2, температура стандартная, давление в шесть раз выше нормального. Определите температуру неона. Решение: Воспользуемся формулами для адиабатического процессе и найдем неизвестные нам параметры T0 = 298 К P1 = 1 атм P2 = 6 атм T2 = T1*(V1/V2)1/y y= 5+2/5 = 7/5 = 1,4 T2 = T1*(P2/P1)1.4-1/1,4 T2 =298*(6/1)0,714 T2 = 298*3,6 = 1072,8 К 3. Приведена реакция, протекающая при температурах T1 = 750К и T2 = 920К: СO(г) + H2O(г) = H2(г) + CO2(г) Для данной реакции выполните следующие задания: а) приведите аналитическую зависимость изменения теплового эффекта реакции от температуры Сор = f(T) (тепловой эффект реакции при 298К выписать из табличных данных);
Теплоемкость химической реакции найдем по формуле: 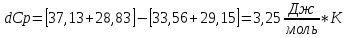 Для расчета теплоемкости по каждому реагенту воспользуемся формулой 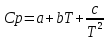 При 298 К Ср = 3,25 Дж/моль*К При 750 К Cp = 10,273 Дж/моль*К При 920 К Сp = 10,318 Дж/моль*К Используем данные значения для построения графика: Cp=f(T) 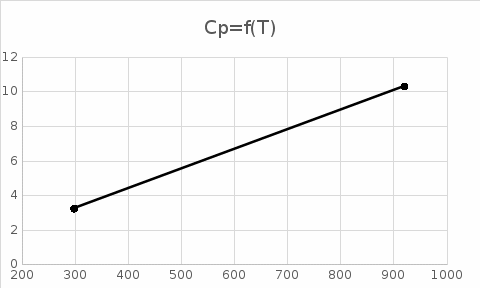 б) Вычислите тепловой эффект реакции при температурах Т1 и Т2;
Для вычисления теплового эффекта реакции воспользуемся формулой: dHp = [H0(CO2) + H0(H2)] – [H0(H2)+H0(CO)] 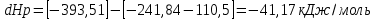 Для других температур энтальпию найдем по формуле: dH(T2) = dH(T1) + (T2-T1)*dCp dH(T2) = -41,17 + (750-298)*0,010273 =-36,527 кДж/моль dH(T3) = -41,17 + (920-298)*0,010318 = -34,752 кДж/моль в) Определите график зависимостей ∑∆Ср,кон = f(T); ∑∆Ср,исх= f(T); ∆НоТ = f(T)    г) Для температуры Т2 определите графически (𝑑∆𝐻/𝑑𝑇) и вычислите значение ∆Cp при заданной температуре. 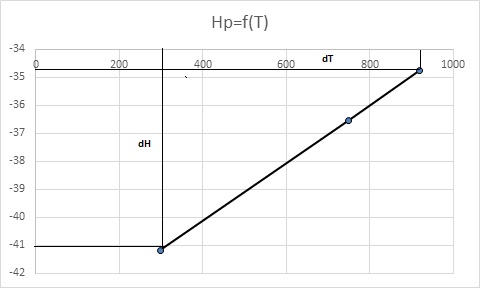 Графически определим dH/dT: dH/dT = -41000+34800/920-310 = -10,16 Дж/моль*К dCp = dH/dT = -10,16 Дж/моль*К 4. Аргон, n моль которого занимают объём V1 при температуре T1, изохороно нагрели до температуры T2, затем изобарно охладили и сжали до температуры T3 и объёма V3 и вернули в исходное состояние путем изотермического расширения до объёма V1. Изобразите цикл в координатах V(T) и T(S) и найдите изменение энтропии на всех участках цикла и в цикле в целом. При этом опирайтесь на табличные значения. Решение: 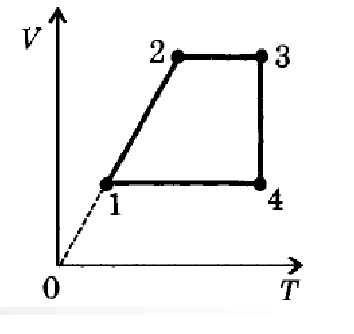 Участки: 1-2 изобарное расширение 2-3 изохорное нагревание 3-4 изотермическое сжатие 4-1 изобарное охлаждение Энтропия в изобарном процессе: dS = m/M*Cp*lnT2/T1 Энтропия в изохорном процессе: dS = m/M*Cv*lnT2/T1 Энтропия в изотермическом процессе dS = m/M*R*lnV2/V1 5. 12 г газа, взятого при давлении 1500 торр и температуре 300К, подвергли адиабатическому обратимому расширению до 1 атм. Определите конечную температуру и объём газа, A, Q, ∆U и ∆S процесса для газ – водород. Решение: у = 5+2/5 = 1,4 T2/T1 = (P2/P1)1,4-1/1,4 T2/300 = (1,98/1)0,286 T2= 365 К A = -m/M*R/(1,4-1)*(T1-T2) A = -12/2*8,314/0,4*(300-364) = 7981,44 Дж Так как процесс адиабатный, то в данном процессе не происходит теплообмена с внешней средой, поэтому Q=0 , то соответственно и S = 0 Q = A + U = 0 A = -U = -7981,44 Дж |
