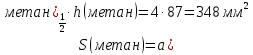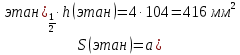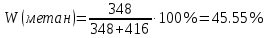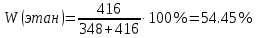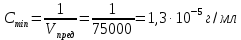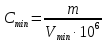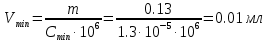контрольная. контр по химии. Решение Вычислим предельную концентрацию по формуле
 Скачать 60.8 Kb. Скачать 60.8 Kb.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| № | Титруемое вещество | Рабочий р-р | |||
| название | формула | концентрация | Кд | | |
| 48 | Циановая кислота | HСNО | 0,15 М | 3,5∙10-4 | 0,15 М КОН |
Решение:
Циановая кислота - слабая одноосновная кислота.
Для построения кривой титрования слабой кислоты и сильным основанием рассчитаем значения рН, соответствующие различным моментам титрования.
Рассчитаем значение рН исходного раствора циановой кислоты с молярной концентрацией эквивалента 0,15 моль/л по формуле

K – константа диссоциации кислоты НА;
С – концентрация кислоты (основания, соли), моль/л.
Это значение соответствует первой точке при построении кривой титрования.
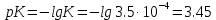
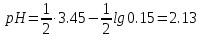
Допустим, приливают 50 мл 0,15 молярного раствора KOH:
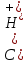
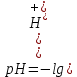
Приливают 90 мл 0,15 молярного раствора KOH:
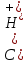
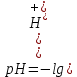
Приливают 99 мл 0,15 молярного раствора KOH:
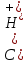
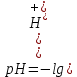
Приливают 99.9 мл 0,15 молярного раствора KOH:
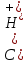
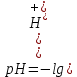
В точке эквивалентности вся кислота будет нейтрализована и в растворе будет находиться только продукт её нейтрализации – цианид калия.
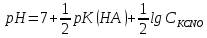
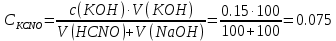
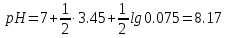
При добавлении избытка KOH величина рН определяется концентрацией присутствующей в титруемом растворе свободной щёлочи.
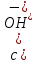
Допустим, приливают 100,1 мл 0,15 молярного раствора KOH:
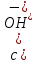
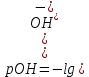

Приливают 101,0 мл 0,15 молярного раствора KOH:
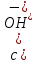
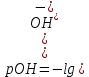
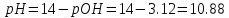
На основании полученных данных строим кривую титрования циановой кислоты сильным основанием (рис.1).
Таблица 1 - Данные для построения графика
| № | V(KOH) | pH |
| 1 | 0 | 2.13 |
| 2 | 50 | 3.45 |
| 3 | 90 | 4.41 |
| 4 | 99 | 5.45 |
| 5 | 99.9 | 6.45 |
| 6 | 100 | 8.17 |
| 7 | 100.1 | 9.88 |
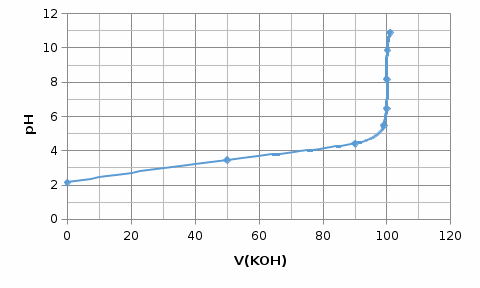
Рисунок 1 - Кривая титрования слабой кислоты сильным основанием
Скачок кривой на титровании 6,45-9,88. Точка эквивалентности находится в щелочной среде.
Точка эквивалентности 8,17, в качестве индикатора может быть взят крезоловый красный с или куркумин рТ 8,3 (справ. данные).
Задание 79
В следующих примерах рассчитать и построить кривую титрования 100 мл указанного вещества. Разбавление раствора при титровании в расчетах можно не учитывать. Концентрацию ионов водорода принять равной 1 моль/л (молярная концентрация эквивалента).
| № | Титруемое вещество | Рабочий раствор |
| 79 | FeSO4 0.10 M | KMnO4 0.10 M |
Решение:
Взаимодействие FeSO4 с KMnO4 протекает по уравнению:
10 FeSO4 + 2 KMnO4 + 8 H2SO4 → 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + 8 H2O
MnO4- + 5e +8H+ = Mn2+ + 4H2O (восстановление)
Fe2+ - 1 e- → Fe3+ (окисление)
KMnO4 является окислителем, FeSO4 является восстановителем.
Выпишем из справ.данных электродные потенциалы окислителя и восстановителя:
Е0MnO4-/ Mn2+ = 1,51 В
Е0Fe3+/Fe2+ = 0,77 В
Если для титрования взято 100 мл 0,1 М раствора соли железа (II), то при прибавлении первой капли (0,001 мл) 0,1 М стандартною раствора сульфата церия образуется эквивалентное количество Fe2+ -ионов. Поэтому в начале титрования отношение концентраций ионов [Fe3+]/[Fe2+], определяющее потенциал системы, можно считать равным:
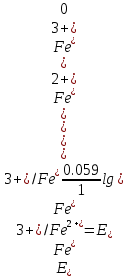
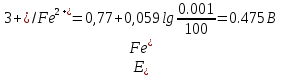
Расчет величины потенциала в процессе титрования до точки эквивалентности
При приливании к 100 мл 0,1 н. раствора соли железа (II) 0,1 мл 0,1 М раствора KMnO4 происходит окисление ионов Fe2+ в Fe3+ в количестве, эквивалентном его количеств содержащемуся в 0,1 мл 0,1 M раствора. В этот момент, если не учитывать разбавление раствора, отношение:

Следовательно:
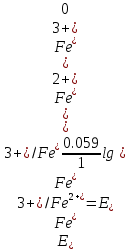
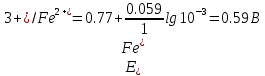
При приливании 1 мл стандартного раствора KMnO4 образуется эквивалентное количество ионов Fe3+ и
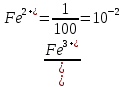
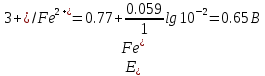
При приливании к 100 мл 0,1 M раствора соли железа(II) 10 мл 0,1 M раствора KMnO4
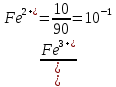
Следовательно
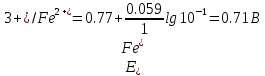
После добавления 50 мл раствора KMnO4 половина ионов железа (II) будет окислена и [Fe3+] = [Fe2+]; тогда
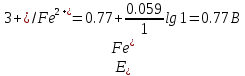
После прибавления 90 мл раствора KMnO4 неокисленными останутся ионы железа (II) в количестве, соответствующем 10 мл раствора:
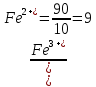
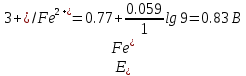
После прибавления 99 мл раствора KMnO4:
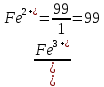
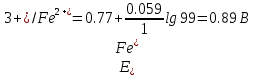
После прибавления 99,9 мл раствора KMnO4:
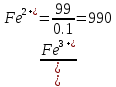
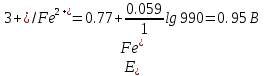
Расчет величины потенциала в точке эквивалентности
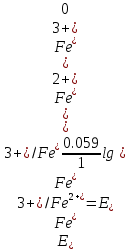
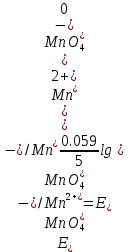
В точке эквивалентности, т.е.в момент, когда 100 мл 0,1 M раствора KMnO4 прибавлено к 100 мл 0,1 M раствора соли железа(II), в растворе устанавливается равновесие.
Тогда
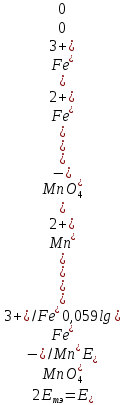


Расчет величины потенциала после точки эквивалентности.
Расчет производят, пользуясь уравнением:
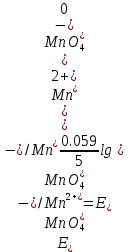
Прибавление избытка 0,1 мл 0,1 М раствора KMnO4 создает отношение
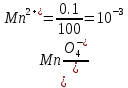

Прибавление 1 мл 0,1 М раствора KMnO4 создает отношение
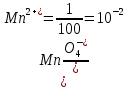
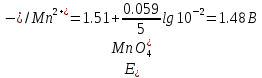
Прибавление 10 мл 0,1 М раствора KMnO4 создает отношение
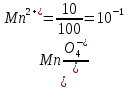

Полученные данные расчетов приведены в табл. 1.
Таблица 1 - Титрование 100 мл, 0,1 М раствора ионов железа(II) 0,1 М раствором перманганата калия
| Прибавлено 0,1 М раствора KMnO4, мл | Осталось ионов Fe2+, % | Соотношение концентраций ионов | Значение потенциала Е,В | |
| | До точки эквивалентности [Fe3+]/[Fe2+] | | ||
| 1 капля 0,001 мл | 100 | 0,001/100 = 10-5 | 0,475 | |
| 0,1 | 99,9 | 0,1/99,9 = 10-3 | 0,59 | |
| 1 | 99 | 1/99 = 10-2 | 0,65 | |
| 10 | 90 | 10/90=10-1 | 0,71 | |
| 50 | 50 | 50/50 = 1 | 0,77 | |
| 90 | 10 | 90/10 10 | 0,83 | |
| 99 | 1 | 99/1 102 | 0,89 | |
| 99,9 | 0,1 | 99,9/0,1 103 | 0,95 | |
| | | | | |
| 100 | 0 | 105 | 1,14 | |
| | | | | |
| 100,1 | 0,1 | 0,1/100,1 10-3 | 1,47 | |
| 101,0 | 1 | 1/101,0 10-2 | 1,48 | |
| 110 | 10 | 10/110 10-1 | 1,50 | |
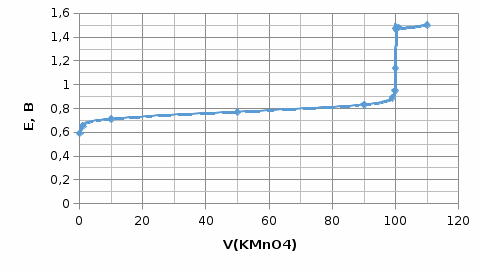
Рисунок 1 - Кривая титрования 100 мл 0,1 М раствора FeSO4 0,1 М раствором KMnO4
Интервал перехода 0,95 – 1,47 В. Потенциал в точке эквивалентности равен 1,14, следовательно, можно подобрать индикатор крезоловый красный.
ЧАСТЬ 2
Задача 163
1 мл раствора препарата платифилина гидротартрата в колбе на 50 мл довели до метки хлороформом и измерили оптическую плотность Ах. Затем измерили оптическую плотность Аст раствора, полученного разбавлением 1мл в 50 раз стандартного раствора платифилина гидротартрата. Отношение оптических плотностей нашли равным Ах/Аст=0,995. Рассчитайте содержание платифилина гидротратрата в миллиграммах в 1 мл препарата, если 1мл стандартного раствора содержит 0,0020г чистого платифилина гидротратрата.
Решение:
В соответствии с основным законом светопоглощения можно записать для измеряемого и стандартного растворов соответственно:
Аx = Сx·ℓ и Аст = Сст·ℓ,
где Сх, Сст – молярная концентрация измеряемого и стандартного растворов соответственно.
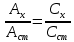
Вычислим концентрацию стандартного раствора платифилина гидротратрата C22H33NO11. Его молярная масса равна 487,5 г/моль.
Тогда вычислим количество вещества:
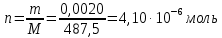
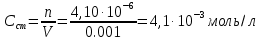
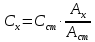
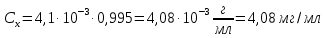
Задача 251
При определении содержания примеси ацетона в воде получены следующие значения показателей преломления стандартных растворов:
| Содержание ацетона,% | 100 | 90 | 80 | 70 | 60 | 50 | 40 | 30 | 20 | 10 | 0 |
| n | 1,3640 | 1,3675 | 1,3690 | 1,3685 | 1,3665 | 1,3610 | 1,3550 | 1,3485 | 1,3410 | 1,3340 | 1,3330 |
Построить калибровочную кривую и определить процентное содержание ацетона при n=1,3500 и n=1.3450.
Решение:
Строим график зависимости показателя преломления n от концентрации (%)(рисунок 1).
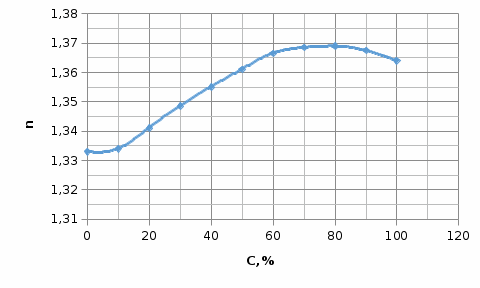
Рисунок 1 - зависимости показателя преломления n от концентрации С (%)
1. Уравнение калибровочного графика определяем методом избранных точек. Для этого выбираем на концах прямой точки: для концентрации 10 % n= 1,3344 и для концентрации 90 % n= 1,3675.
Составим два уравнения:
1,3675 = А + В90,
1,3344 = А + В10.
Решаем эти уравнения и получаем:
А=1,3344-В10
1,3675=1,3340-В10+В90
0,0331=В80
А = 1,3279 и В = 4,14∙10–4.
А=1,3344-4,14∙10–4 ∙10=1,3303
Следовательно, искомое уравнение имеет вид
n =1,3303 + 4,14∙10–4
2. По калибровочному графику находим, что показателю преломления 1,3500 соответствует концентрация 34 %. Подставив значение показателя преломления в наше уравнение, получаем:
1,3500 = 1,3303 + 4,14∙10–4
Отсюда находим массовую долю ацетона в водно-ацетоновой смеси:
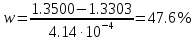
Показателю преломления 1,3450 соответствует концентрация 25 %. Подставив значение показателя преломления в наше уравнение, получаем:
1,3450 = 1,3303 + 4,14∙10–4
Отсюда находим массовую долю ацетона в водно-ацетоновой смеси:

Задача 263
Растворяют 0,1 г металлического цинка, содержащего примесь кадмия, в 50 мл соляной кислоты с молярной концентрацией эквивалента 6 моль/л и разбавляют раствор водой до 250 мл. Переносят в электролизер 25 мл полученного раствора и снимают полярограмму. При потенциале –0,65в высота пика кадмия составляла 60 мм. К этому раствору добавляют 5 мл раствора хлорида кадмия с молярной концентрацией эквивалента 0,00005 моль/л, после чего высота пика кадмия увеличивается до 140 мм. Определить содержание кадмия в металлическом цинке (в %).
Решение:
Для решения задачи воспользуемся известной формулой метода добавок
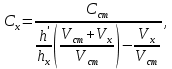
где
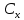 - концентрация определяемого вещества в пробе;
- концентрация определяемого вещества в пробе;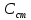 – концентрация определяемого вещества в стандарте;
– концентрация определяемого вещества в стандарте;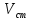 – объем стандартного раствора;
– объем стандартного раствора;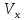 – объем пробы;
– объем пробы;hх – высота волны в пробе;
h’ - высота волны в пробе с добавкой.
Тогда концентрация кадмия в полярографируемой пробе будет равна

Определим содержание кадмия в металлическом цинке:
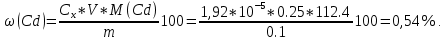
Задача 332
Определить концентрацию NH4Cl в растворе (г/л), если при потенциометрическом титровании 20,0 мл раствора NH4Cl раствором Hg2(NO3)2 с молярной концентрацией эквивалента 0,0500 моль/л получили следующие результаты:
| V(Hg2(NO3)2 | 10,0 | 15,0 | 17,0 | 17,5 | 17,9 | 18,0 | 18,1 | 18,5 | 19,0 |
| Е, мВ | 382 | 411 | 442 | 457 | 498 | 613 | 679 | 700 | 709 |
Конечную точку титрования определить расчетным способом и графически по первой производной.
Решение:
| V(Hg2(NO3)2 | 10,0 | 15,0 | 17,0 | 17,5 | 17,9 | 18,0 | 18,1 | 18,5 | 19,0 |
| Е, мВ | 382 | 411 | 442 | 457 | 498 | 613 | 679 | 700 | 709 |
| ∆Е/∆V | | 5.8 | 15.5 | 30 | 102.5 | 1150 | 660 | 52.5 | 18 |
Построим график зависимости потенциала от объема.
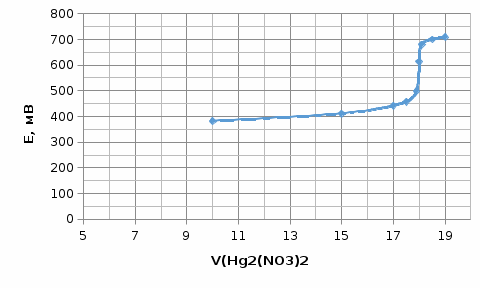
Рисунок 1 - График зависимости потенциала от объема


Рисунок 2 - График зависимости изменения производной ∆Е/∆V от объема
Точка эквивалентности V=18 мл
Тогда определим концетрацию NH4Cl в растворе (г/л):

Задача 350
Провели газожидкостной хроматографический анализ смеси, состоящей из метана и этана, с использованием заполненной колонки длиной L=1000мм, на полученной хроматограмме определили характеристики пиков обоих компонентов – расстояние удерживания ℓ, высоту h, полуширину а1/2 пика и нашли:
| Компонент | h, мм | ℓ, мм | a, мм |
| Метан | 87 | 35 | 4 |
| Этан | 104 | 48 | 4 |
Рассчитайте параметры, характеризующие эффективность хроматографической колонки, - число теоретических тарелок n, величину Н (ВЭТТ). Вычислите степень разделения RS для пары компонентов: метан – этан. Определите массовую долю W (в %) каждого компонента в смеси методом внутренней нормализации.
Решение:
Число теоретических тарелок вычисляем по формуле
n=5,545∙la1/2 /2,
где l – расстояние удерживания, мм;
а1/2 – полуширина пика, мм.
Для метана число теоретических тарелок равно
n=5,545∙35∙4/2=388
Для этана
n=5,545∙48∙4/2=532
Высота, эквивалентная теоретической тарелке, равна
Н = L/n,
где L – длина хроматографической колонки, равна 1000 мм;
n – число теоретических тарелок.
Для метана ВЭТТ равно
Н = 1000/388 = 2,58 (мм)
Для этана
Н = 1000/532 = 1,88 (мм).
Степень разделения рассчитываем по формуле
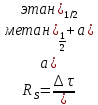
где
Заменяем время удерживания на расстояние удерживания l, мм
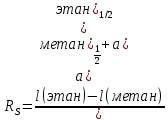
значит, пики разделяются.
Массовую долю компонентов находим по методу внутренней нормализации:
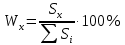
Найдем площадь каждого пика: