Решение Задание 1
 Скачать 209.5 Kb. Скачать 209.5 Kb.
|
Задание 1. Напишите уравнения диссоциации и константы диссоциации для сла-бых электролитов. Задание 2. По заданным ионным уравнениям напишите соответствующие молеку-лярные уравнения. Задание 3. Напишите в молекулярной и ионной формах уравнения реакций для сле-дующих превращений. Решение: Задание 1. HI – сильный электролит. Сильные электролиты диссоциируют в водном растворе практически полностью: HI = H+ + I- Потому для них термин «константы диссоциации» лишен смысла. Sn(OH)2 – слабый амфотерный электролит, диссоциирует и как кислота, и как основание. Диссоциацию слабых электролитов характеризует константа равновесия, называемая константой диссоциации (ионизации) – Кд, причем для многокислотных оснований каждую ступень равновесного состояния характеризует своя константа диссоциации. по основному типу: 1 ступень: Sn(OH)2 ↔ SnOH+ + ОН–, 2 ступень: SnOH+ ↔ Sn2+ + ОН–, и кислотному: Н2SnО2 → Н+ + НSnО2- ; НSnО2- → Н+ + SnО22- ; 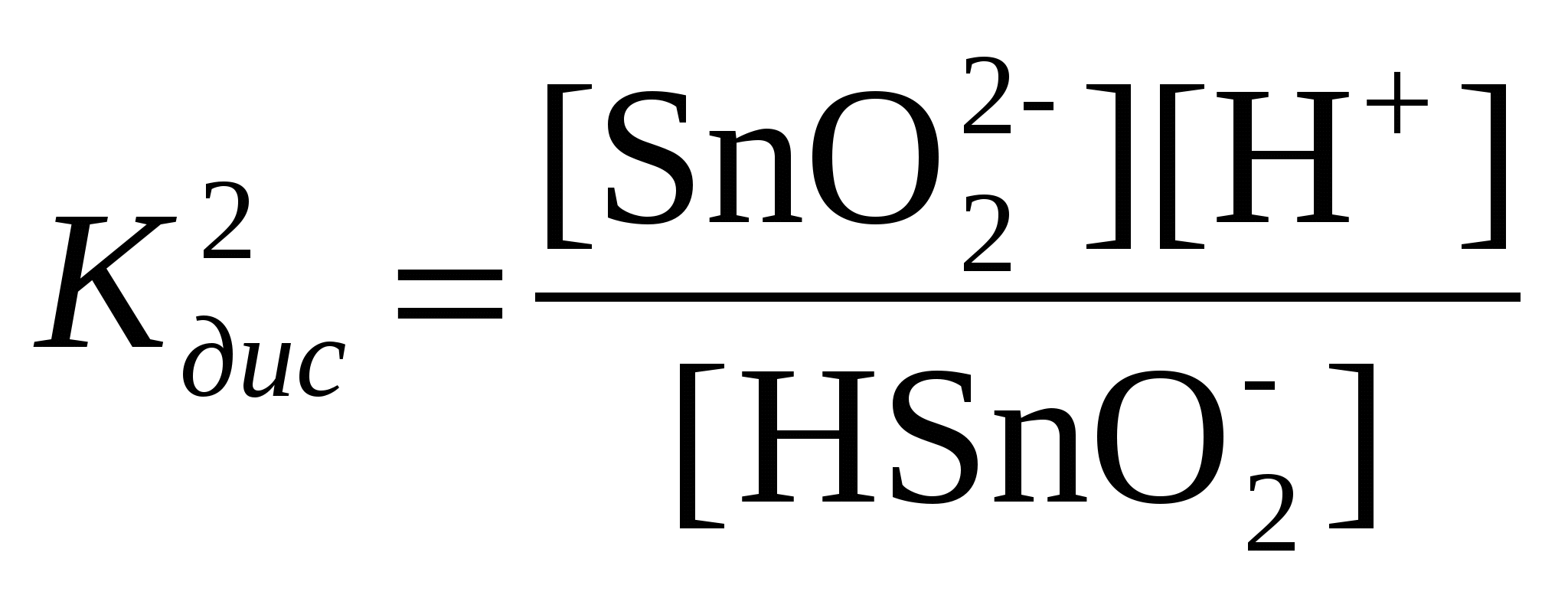 Задание 2. Cr3+ + OH– + SO42– = CrOHSO4 Cr3+ + OH– + SO42–+ 2ОН- +2Н+ = CrOHSO4 + 2ОН- + 2Н+ Cr(ОН)3 + Н2SO4 = CrOHSO4 + 2H2O Задание 3. Al2(SO4)3 [Al(OH)2]2SO4 Al(OH)3 NaAlO2
2Al3+ + 3SO42- + 4K+ + 4OH- = 2[Al(OH)2]+ + SO42- + 4K+ + 2SO42- Al3+ + 2OH- = [Al(OH)2]+
2[Al(OH)2]+ + SO42 + 2K+ + 2OH- = 2Al(OH)3 + 2K+ + SO42- [Al(OH)2]+ + OH- = Al(OH)3
HAlO2 + NaOH = NaAlO2 + H2O H+ + AlO2- + Na+ + OH- = Na+ + AlO2- + H2O H+ + OH- = H2O
Задание 1. Написать уравнения гидролиза солей в молекулярной и ионной формах, указать рН растворов (рН > 7 или рН < 7). Задание 2. Написать уравнения реакций, протекающих между веществами в водных растворах. Решение: Задание 1. FeCl3 — соль cильной кислоты и слабого основания. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза Fe3+ + Н2О ↔ FeOH2+ + Н+ или в молекулярной форме FeCl3 + Н2О ↔ FeOHCl2 + HCl В растворе появляется избыток ионов Н+, поэтому раствор FeCl3 имеет кислую реакцию (рН < 7). Ba(CH3COO)2 — соль слабой и сильного основания. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза CH3COO- + Н2О ↔ CH3COOH + ОН- или в молекулярной форме Ba(CH3COO)2 + 2Н2О ↔ 2CH3COOH + Ba(OH)2 В растворе появляется избыток ионов ОН-, поэтому раствор Ba(CH3COO)2 имеет щелочную реакцию (рН > 7). Задание 2. Соль Na2S образована слабой кислотой и сильным основанием гидролизуется по аниону: S2- + H2O ↔ HS- + OH-. Соль AlBr3 образована сильной кислотой и слабым основанием, гидролизуется по катиону: Al3+ + H2O ↔ AlOH2+ + Н+ При смешении растворов этих солей идет взаимное усиление гидролиза каждой из них, ибо ионы H+, образующиеся в результате гидролиза AlBr3 и ионы OH−, образующиеся в результате гидролиза Na2S, образуют молекулу слабого электролита H2O. Ввиду этого гидролиз обеих солей идет необратимо до конца с образованием соответствующих кислоты и основания. Ионно-молекулярное уравнение гидролиза имеет вид: Al3+ + S2- + 3H2O → Al(OH)3 + H2S + H+ молекулярное уравнение: 2AlBr3 + 3Na2S + 6H2O → 2Al(OH)3 + 3H2S + 6NaBr Соль FeCl3 образована сильной кислотой и слабым основанием, гидролизуется по катиону: Fe3+ + H2O ↔ FeOH2+ + Н+ Соль Na2CO3 образована слабой кислотой и сильным основанием гидролизуется по аниону: CO32- + H2O ↔ При смешении растворов этих солей идет взаимное усиление гидролиза каждой из них, ибо ионы H+, образующиеся в результате гидролиза FeCl3 и ионы OH−, образующиеся в результате гидролиза Na2CO3, образуют молекулу слабого электролита H2O. Ввиду этого гидролиз обеих солей идет необратимо до конца с образованием соответствующих кислоты и основания. Ионно-молекулярное уравнение гидролиза имеет вид : 2Fe3+ + 3 молекулярное уравнение: 2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2 + 6NaCl 234. Na3AsO3 + I2 + H2O Mn(NO3)2 + NaBiO3 + HNO3 Решение: а) Электронные уравнения:
б) Электронные уравнения:
254. Укажите направление движения электронов в гальваническом элементе, используя значения электродных потенциалов. Напишите уравнения анодного и катодного процессов, суммарное ионное и молекулярное уравнения реакции. Рассчитайте ЭДС; если концентрация раствора не указана, используйте значение стандартного потенциала Cu | CuSO4, 0,1M || Al2(SO4)3, 0,5M | Al Решение: 1. Схема гальванического элемента: Cu | CuSO4 , 0,1 M || Al2(SO4)3, 0,5 M | Al Е° (Cu2+/Cu) = +0,337 B Е° (Al3+/Al) = -1,662 B 2. Вычисление электродных потенциалов по уравнению Нернста: где E0 – стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; С – концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/л 3. Направление движения электронов по внешней цепи от Al3+ электрода к Cu2+, так как E(Al3+/Al) < Е(Cu2+/Cu)
4. Уравнения электродных полуреакций: Al (–): Al – 3 е = Al3+ – процесс окисления, Cu (+): Cu2+ + 2е = Cu – процесс восстановления. 5. Расчёт величины ЭДС: ЭДС = Е(Cu2+/Cu) – E(Al3+/Al) = +0,3075 – (–1,668) = 1,98 В. 274. Рассмотрите коррозию гальванопары, укажите анод и катод соответствующей гальванопары, рассчитайте ЭДС, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе. Mg/Cd Решение: 1. Схема гальванопары: Mg / NaOH / Cd. 2. Потенциалы: Е° (Mg(ОН)2/Mg) = -2,69 B Е° (Cd2+/Сd) = -0,40 B Е° (2H2O/Н2) = -0,827 B. то в данной гальванической паре восстановитель – магний, окислитель – кадмий. 3. Уравнения процессов окисления и восстановления анод Mg + - 2 катод(Cd) 2Н2О + 2 Mg + 2Н2О = Mg2+ + 2ОН− + H2 Mg + 2Н2О = Mg(OH)2 + H2 Разрушается магний. 4. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:
5. ЭДС = Е°катода – Е°анода = – 0,40 – (–2,69) = 2,29 В Т.к. ЭДС > 0, то реакция осуществима. 294. Рассмотрите катодные и анодные процессы при электролизе водных растворов веществе инертными электродами. Рассчитайте массу или (и) объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А: BeSO4 Решение: Электролиз водного раствора сульфата бериллия с инертными электродами: BeSO4 = Be2+ +SO42-
Количественные соотношения при электролизе определяют в соответствии с обобщённым законом Фарадея, который связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока: где V – объём газа, выделяющегося на электроде; V0– объём 1 моль газообразного вещества при нормальных условиях (22,4 л/моль; n – количество электронов, участвующих в электродном процессе; I – сила тока, А; t – время электролиза, с; F – постоянная Фарадея (96500 Кл / моль). Объем кислорода, выделившегося на аноде равен: Объем водорода, выделившегося на катоде равен:
Решение: Каждый из этих комплексных ионов подвергается диссоциации и характеризуется своей константой нестойкости: а) 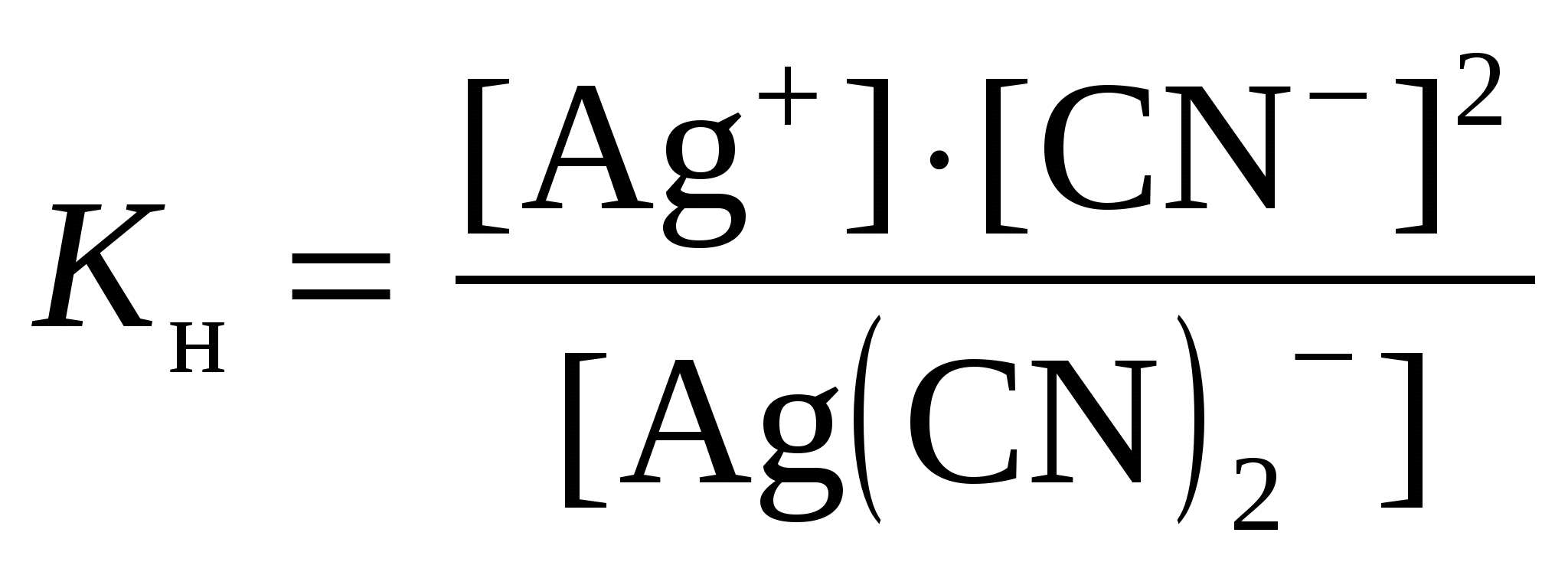 = 1,0·10-21 = 1,0·10-21б) 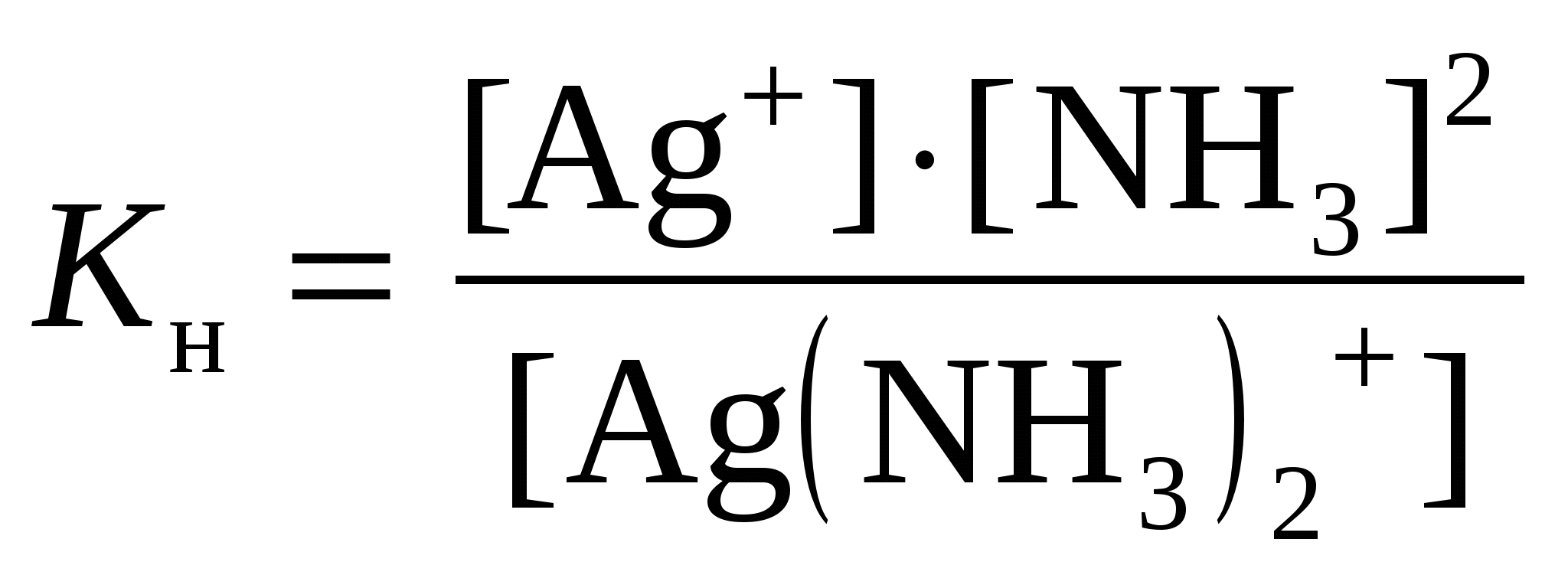 = 6,8·10-8 = 6,8·10-8в) 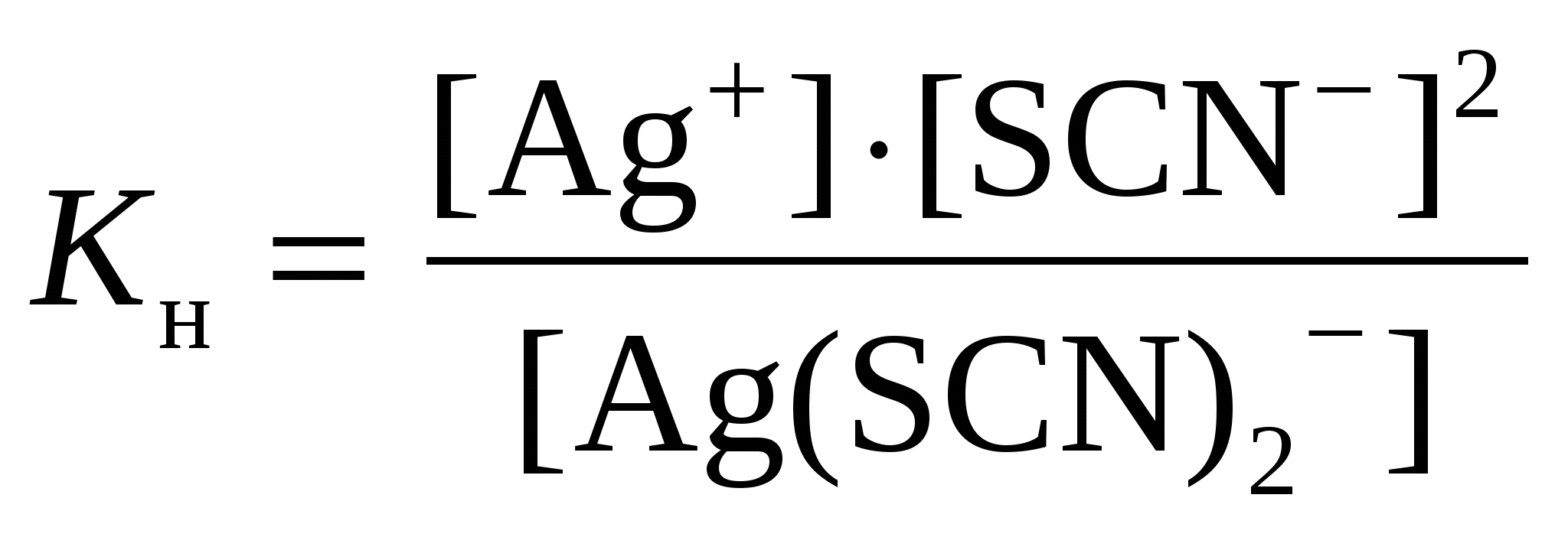 = 2,0·10-11 = 2,0·10-11Константа нестойкости – мера устойчивости комплекса: чем она меньше, тем устойчивее ион. Т.о. среди наших комплексных ионов наиболее устойчивым является 334. Какая масса CaSO4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 мэкв? Решение:
Жесткость воды обуславливается присутствием солей кальция и магния и определяется по формуле: 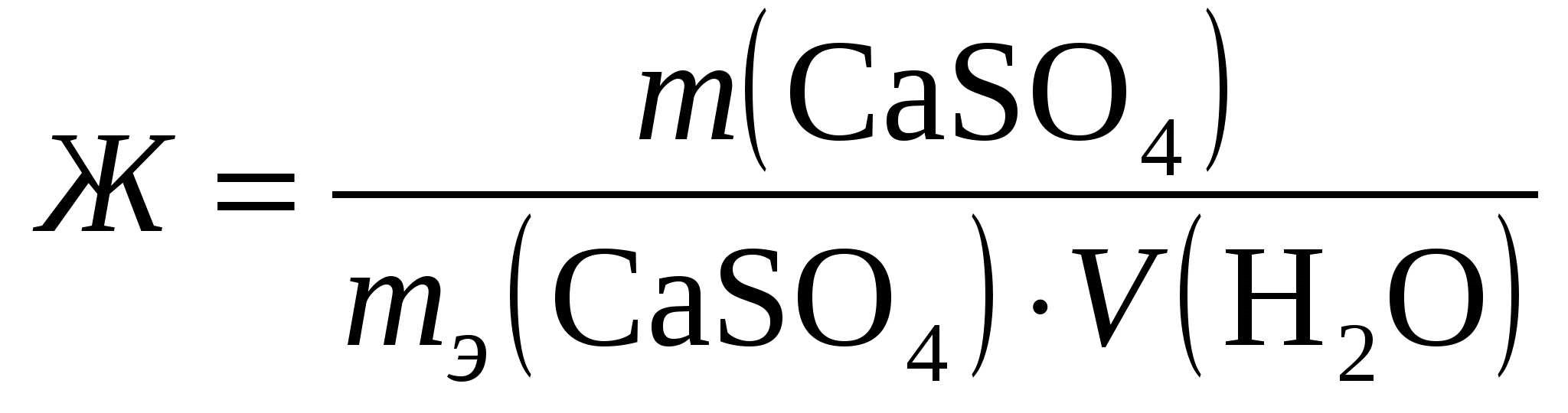 М(СaSO4) = 40 + 32 + 16*4 = 136 г/моль mэ(СaSO4) = ½∙М(СaSO4) = ½∙136 = 68 г/моль Отсюда: 354. Как называют углеводороды, представителем которых является изопрен? Составьте схему сополимеризации изопрена и изобутилена. Решение: Изопрен (2-метилбутадиен-1,3) является представителем диеновых углеводородов СН2 = С – СН = СН2 │ СН3 Схема сополимеризации изобутилена и изопрена: СН3 │ СН2 = С + СН2 = С – СН = СН2 + …… → │ │ СН3 СН3 СН3 │ │ │ → … – СН2 – С – + – СН2 – С – СН – СН2 – + …… → │ │ СН3 СН3 СН3 │ → … – СН2 – С – СН2 – С = СН – СН2 – …. и т.д. → │ │ СН3 СН3 В сокращенном виде: СН3 │ │ │ СН3 СН3 СН3 │ → ( – СН2 – С – СН2 – С = СН – СН2 –)n │ │ СН3 СН3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||