Получение и применение кислорода и азота. Рождающий кислоты
 Скачать 44.24 Kb. Скачать 44.24 Kb.
|
|
Кислород ("рождающий кислоты") открыл в 1774 г. Дж. Пристли. Это самый распространенный химический элемент на Земле - массовая доля кислорода в земной коре составляет 47,2%. В атмосферном воздухе доля кислорода составляет 21%, что связано с деятельностью зеленых растений. Кислород входит в состав многих, как неорганических, так и органических соединений. Кислород необходим для жизнедеятельности всех высокоорганизованных живых организмов: человека, зверей, птиц, рыб. Кислород составляет от 50 до 85% массы тканей животных и растений. Известны три стабильных изотопа кислорода: 16O, 17O, 18O. В свободном состоянии кислород существует в двух аллотропных модификациях: O2 - кислород; O3 - озон. Кислород в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "8", относится к 16(VIa) группе (См. Атомы 16(VIa) группы). 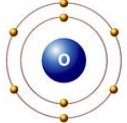 Рис. Строение атома кислорода. Атом кислорода содержит 8 электронов: 2 электрона находятся на внутренней s-орбитали и еще 6 на внешнем энергетическом уровне - 2 (спаренных) на s-подуровне и 4 (два спаренных и два неспаренных) на p-подуровне (см. Электронная структура атомов). 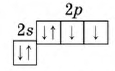 За счет двух неспаренных p-электронов внешнего уровня кислород образует две ковалентные связи, принимая два электрона и проявляя степень окисления -2 (H2O, CaO, H2SO4). В соединениях с кислородной связью О-О атом кислорода проявляет степень окисления -1 (H2O2). С более электроотрицательным фтором кислород отдает свои валентные электроны, проявляя степень окисления +2 (OF2). O2 Двухатомная молекула кислорода образована двойной связью двух атомов кислорода. По этой причине молекулярный кислород при нормальных условиях является устойчивым соединением. Энергия диссоциации молекулы кислорода примерно в 2 раза ниже, чем в молекуле азота (см. Кратность ковалентной связи), поэтому кислород по сравнению с азотом обладает более высокой реакционной способностью (но, гораздо меньшей по сравнению, например, с фтором). Реакционная способность кислорода увеличивается по мере нагревания. Кислород реагирует со всеми элементами за исключением инертных газов. По причине своей высокой электроотрицательности (см. Что такое электроотрицательность) в химических соединениях (за исключением фтора) кислород выступает в роли окислителя со степенью -2 (только фтор окисляет кислород с образованием дифторида кислорода OF2). Свойства газа кислорода: газ без цвета, запаха и вкуса; в жидком или твердом виде кислород имеет голубую окраску; умеренно растворим в воде: массовая доля кислорода при 20°C составляет 0,004%. Химические свойства кислорода Во всех реакциях кислород играет роль окислителя, соединяясь со всеми элементами (за исключением гелия, аргона и неона) непосредственным взаимодействием (кроме фтора, хлора, золота и платиновых металлов). С металлами и неметаллами (простыми веществами) кислород образует оксиды: 2Cu + O2 = 2CuO 4Li + O2 = 2Li2O 2Ca + O2 = 2CaO S + O2 = SO2 C + O2 = CO2 При окислении щелочных металлов натрия и калия образуются пероксиды: 2Na + O2 = Na2O2 Практически все реакции с участием кислорода являются экзотермическими, но есть и исключения: N2+O2 ↔ 2NO-Q Многие вещества реагируют с кислородом с большим выделением тепла и света, такой процесс называется горением. Реакции горения: горение аммиака на воздухе с образованием воды и азота: 4NH3+3O2 = 2N2+6H2O каталитическое окисление аммиака: 4NH3+5O2 = 2NO+6H2O горение сероводорода в избытке кислорода: 2H2S+3O2 = 2SO2+2H2O при недостатке кислорода сероводород медленно окисляется до свободной серы: 2H2S+O2 = 2S+2H2O горение органических веществ в кислороде с образованием воды и углекислого газа: CH4+2O2 → CO2+2H2O C2H5OH+3O2 → 2CO2+3H2O при сгорании азотсодержащих органических веществ кроме углекислого газа и воды выделяется свободный азот: 4CH3NH5+9O2 → 4CO2+2N2+10H2O Многие вещества (спирты, альдегиды, кислоты) получают реакцией контролируемого окисления органических веществ. Также многие природные процессы, например, дыхание или гниение, по своей сути являются окислительными реакциями органических веществ. Еще более сильным окислителем, чем кислород, является озон, способный окислять йодид калия до свободного йона - эта реакция используется для качественного и количественного определения озона: O3+2KI+H2O = I2↓+2KOH+O2↑ Получение и применение кислорода Кислород находит достаточно широкое применение в промышленности и медицине: в металлургии кислород используется при выплавке стали (чугуна); в химической промышленности кислород нужен для производства кислот (серной и азотной), метанола, ацетилена, альдегидов; в космической промышленности кислород используется в качестве окислителя ракетного топлива; в медицине кислород применяют в дыхательных аппаратах; в природе кислород играет исключительно важную роль, - в процессе окисления углеводов, жиров и белков происходит высвобождение энергии, необходимой для живых организмов. Способы получения кислорода: промышленные способы: сжижением воздуха с последующим разделением жидкой смеси газов на компоненты; электролиз воды: 2H2O = 2H2 + O2. лабораторные способы (разложение солей при нагревании): перманганат калия: 2KMnO4 = K2MnO4 + MnO2 + O2; бертолетова соль: 2KClO3 = 2KCl + 3O2. термическое разложение нитратов щелочных металлов: 2NaNO3 = 2NaNO2+O2↑ каталитическое разложение пероксида водорода (катализатор MnO2): 2H2O2 = 2H2O+O2↑; взаимодействие пероксидов углекислого газа с пероксидами щелочных металлов: 2CO2+2Na2O2 = 2Na2CO3+O2↑. Получение и применение азота АЗОТ (лат. Nitrogenium - рождающий селитры), N (читается "эн") - химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14,0067. В свободном виде - газ без цвета, запаха и вкуса, плохо растворим в воде. Состоит из двухатомных молекул N2, обладающих высокой прочностью. Относится к неметаллам. Природный азот состоит из стабильных нуклидов 14N (содержание в смеси 99,635% по массе) и 15N. Конфигурация внешнего электронного слоя 2 s 2 2р 3. Радиус нейтрального атома азота 0,074 нм, радиус ионов: N3 - 0,132, N3+ - 0,030 и N5+ - 0,027 нм. Энергии последовательной ионизации нейтрального атома азота равны, соответственно, 14,53, 29,60, 47,45, 77,47 и 97,89 эВ. По шкале Полинга электроотрицательность азота 3,0 Изотопы Природный азот состоит из двух стабильных изотопов 14N — 99,635 % и 15N — 0,365 %. Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13N имеет период полураспада 10 мин. В промышленности азот получают из воздуха. Для этого воздух сначала охлаждают, сжижают, а жидкий воздух подвергают перегонке (дистилляции). Температура кипения азота немного ниже (-195,8°C), чем другого компонента воздуха - кислорода (-182,9°C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым. Потребителям газообразный азот поставляют в сжатом виде (150 атм. или 15 МПа) в черных баллонах, имеющих желтую надпись "азот". Хранят жидкий азот в сосудах Дьюара. В лаборатории чистый ("химический") азот получают добавляя при нагревании насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2: NaNO2 + NH4Cl = NaCl + N2 + 2H2O. Можно также нагревать твердый нитрит аммония: NH4NO2 = N2 + 2H2O. Распространенность в природе азот азотобактер азотофиксация изотоп Азот - один из самых распространенных элементов на Земле, причем основная его масса (около 4*1015 т) сосредоточена в свободном состоянии в атмосфере. В воздухе свободный азот (в виде молекул N2) составляет 78,09% по объему (или 75,6% по массе), не считая незначительных примесей его в виде аммиака и окислов. Среднее содержание азота в литосфере 1,9*10-3% по массе. Природные соединения азота - хлористый аммоний NH4CI и различные нитраты. Крупные скопления селитры характерны для сухого пустынного климата (Чили, Средняя Азия). Долгое время селитры были главным для связывания азота имеет промышленный синтез аммиака из азота воздуха и водорода). Небольшие количества связанного азота находятся в каменном угле (1 - 2,5%) и нефти (0,02 - 1,5%), а также в водах рек, морей и океанов. Азот накапливается в почвах (0,1%) и в живых организмах (0,3%). Хотя название “азот" означает “не поддерживающий жизни", на самом деле это - необходимый для жизнедеятельности элемент. В белке животных и человека содержится 16 - 17% азота. В организмах плотоядных животных белок образуется за счет потребляемых белковых веществ, имеющихся в организмах травоядных животных и в растениях. Растения синтезируют белок, усваивая содержащиеся в почве азотистые вещества, главным образом неорганические. Значительные количества азота поступают в почву благодаря азотфиксирующим микроорганизмам, способным переводить свободный азот воздуха в соединения азота. В природе осуществляется круговорот азота, главную роль в котором играют микроорганизмы - нитрофицирующие, денитрофицирующие, азотфиксирующие и др. Однако в результате извлечения из почвы растениями огромного количества связанного азота (особенно при интенсивном земледелии) почвы оказываются обедненными. Дефицит азота характерен для земледелия почти всех стран, наблюдается дефицит азота и в животноводстве (“белковое голодание”). На почвах, бедных доступным азотом, растения плохо развиваются. Хозяйственная деятельность человека нарушает круговорот азота. Так, сжигание топлива обогащает атмосферу азотом, а заводы, производящие удобрения, связывают азот из воздуха. Транспортировка удобрений и продуктов сельского хозяйства перераспределяет азот на поверхности земли. Применение В промышленности газ азот используют главным образом для получения аммиака. Как химически инертный газ азот применяют для обеспечения инертной среды в различных химических и металлургических процессах, при перекачке горючих жидкостей. Жидкий азот широко используют как хладагент, его применяют и в медицине, особенно в косметологии. Важное значение в поддержании плодородия почв имеют азотные минеральные удобрения. В лаборатории азот легко может быть получен при нагревании концентрированного нитрита аммония: NH4NO2 (N2 + 2H2O. Технический способ получения азота основан на разделении предварительно сжиженного воздуха, который затем подвергается разгонке. Основная часть добываемого свободного азота используется для промышленного производства аммиака, который затем в значительных количествах перерабатывается на азотную кислоту, удобрения, взрывчатые вещества и т.д. Помимо прямого синтеза аммиака из элементов, промышленное значение для связывания азота воздуха имеет разработанный в 1905 цианамидный метод, основанный на том, что при 10000С карбид кальция (получаемый накаливанием смеси известии угля в электрической печи) реагирует со свободным азотом: CaC2 + N2 (CaCN2 + C Образующийся цианамид кальция при действии перегретого водяного пара разлагается с выделением аммиака: CaCN2 + 3H2O (CaCO3 + 2NH3 Cвободный азот применяют во многих отраслях промышленности: как инертную среду при разнообразных химических и металлургических процессах, для заполнения свободного пространства в ртутных термометрах, при перекачке горючих жидкостей и т.д. Жидкий азот находит применение в различных холодильных установках. Его хранят и транспортируют в стальных сосудах Дьюара, газообразный азот в сжатом виде - в баллонах. Широко применяют многие соединения азота. Производство связанного азота стало усиленно развиваться после 1-й мировой войны и сейчас достигло огромных масштабов. |
