Роль воды и растворов в жизнедеятельности
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
|
Роль воды и растворов в жизнедеятельности. По агрегатному состоянию растворы могут быть газообразными, жидкими и твердыми. Любой раствор состоит из растворенных веществ и растворителя, хотя эти понятия в известной степени условны. Например, в зависимости от соотношения количества спирта и воды эта система может быть раствором спирта в воде или воды в спирте. Обычно растворителем считают тот компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. Учение о растворах представляет для медиков особый интерес потому, что 1. важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. 2. Биохимические реакции в организмах протекают в растворах 3. усвоение пищи происходит с переходом питательных веществ растворенное состояние 4. Биологические жидкости участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям, а также в выведении из организма метаболитов (мочевины, билирубина, углекислого газа и т. д.). Плазма крови является средой для клеток – лимфоцитов, эритроцитов, тромбоцитов. В жидких средах организма поддерживается постоянство кислотности, концентрации солей и органических веществ. Такое постоянство называется концентрационным гомеостазом. Термодинамика растворения. Процесс растворения связан с диффузией, т.е. с самопроизвольным распределением частиц одного вещества между частицами другого. В результате изменения структуры компонентов при переходе из индивидуального состояния в раствор, а также в результате происходящих при этом взаимодействий изменяются свойства системы. На это указывает, в частности, наличие тепловых (DН) и объемных (DV) эффектов при растворении. Растворение можно рассматривать как совокупность физических и химических явлений, разделяя его на три процесса: а) разрушение химических и межмолекулярных связей в растворяющихся газах, жидкостях или твердых веществах, требующее затраты энергии и происходящее с увеличением беспорядка (DН1 > 0, DS > 0); этот процесс называется фазовым переходом; б) химическое взаимодействие растворителя с растворяющимся веществом с образованием новых соединений - сольватов (или гидратов) - и сопровождающееся выделением энергии и уменьшением беспорядка (DН2 < 0, DS < 0); этот процесс называется гидратацией; в) самопроизвольное перемешивание раствора и равномерное распределение сольватов (гидратов) в растворителе, связанное с диффузией и требующее затраты энергии (DН3 > 0, DS > 0); этот процесс называется диффузией. Суммарная энтальпия процесса растворения (DН = DН1 + DН2 + DН3) Таким образом, процесс растворения можно записать: Влияние условий на растворимость. На растворимость веществ оказывают влияние многие факторы, главными из которых являются природа растворителя и растворяемого вещества, температура, давление, наличие в растворе других веществ (особенно электролитов). 2. Растворимость газов. Законы Генри, Дальтона, Сеченова. Растворимость газа – это максимальное количество газа, которое может быть растворено в единице объема пластовой нефти при определенных давлении и температуре. Газосодержание может быть равным растворимости или меньше ее. Его определяют в лаборатории по пластовой пробе нефти, постепенно снижая давление от пластового, при котором отобрана проба, до атмосферного. Процесс дегазирования пробы может быть контактным или дифференциальным. Контактным (одноступенчатым) называют процесс, при котором весь выделяющийся газ находится над нефтью в контакте с ней. При дифференциальном процессе дегазирования выделяющийся из раствора газ непрерывно отводится из системы. Закон Генри  Закон Дальтона   21. Предмет и основные понятия химической кинетики. Скорость реакции. Молекулярность. Порядок реакции. Предмет и основные понятия химической кинетики Химическая кинетика- учение о закономерностях протекания химических реакций. Она рассматривает скорость и механизм реакций. Их знание позволяет управлять реакциями, выбирать оптимальные условия для их проведения. По механизму реакции делятся на сложные и простые Простые реакции-осуществляются посредством однотипных элементарных актов (единичный акт взаимодействия или превращения частиц, в результате которого образуются новые частицы продуктов реакции или промежуточных соединений). Для осуществления сложных реакций необходимы два и более элементарных акта (параллельные, последовательные, сопряженные, каталитические, цепные) Скорость реакции-это изменение концентрации реагирующих веществ за единицу времени. Молекулярность- число молекул, участвующих одновременно в элементарном акте: мономолекулярные, бимолекулярные, тримолекулярные. Порядок реакции-это эмпирически установленная зависимость скорости от концентрации реагирующих веществ. Известны реакции: нулевого, первого, второго и дробного порядка. 22. Основой закон химической кинетики. Реакции нулевого, первого и второго порядков. Основой закон химической кинетики Гульдберг, Вааге и Бекетов (ЗДМ) Скорость простой реакции прямо пропорциональна произведению концентрации реагирующих веществ. Реакции нулевого, первого и второго порядков. Реакции нулевого порядка- скорость не зависит от концентрации исходных веществ. Это гетерогенные реакции.  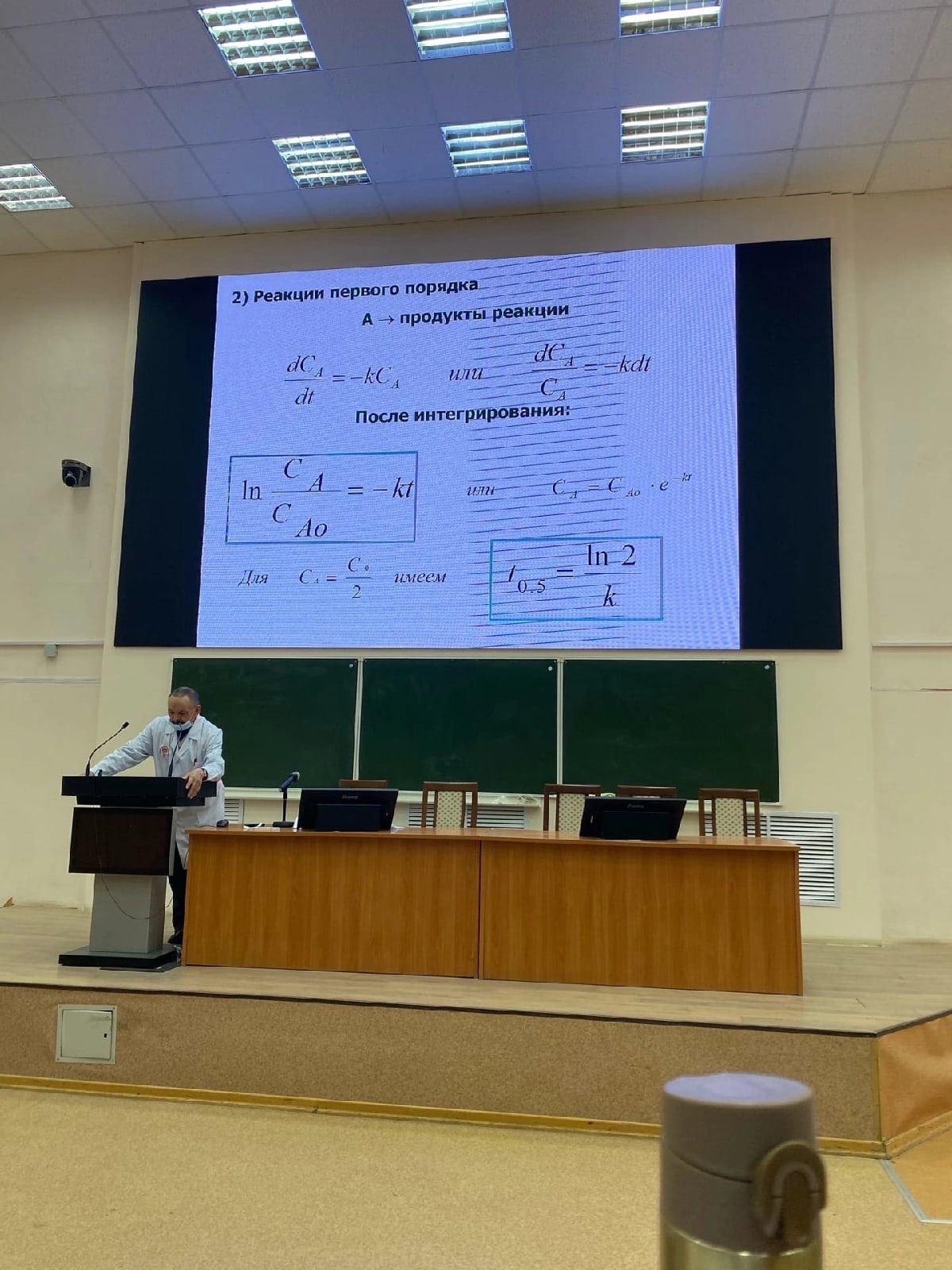  37. Коагуляция. Порог коагуляции. Правило Шульце-Гарди. Взаимная коагуляция. Коллоидная защита. Коагуляция – процесс слипания частиц дисперсной фазы при потере агрегатной устойчивости. Порог коагуляции – критическое значение концентрации, при котором данный электролит вызывает коагуляцию. Правило Шульце-Гарди: коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы. Коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора. Взаимная коагуляция - коагуляция, которая происходит при смешивании двух золей с противоположным знаком заряда частиц. Коллоидная защита - снижение способности коллоидов коагулироваться в результате введения в них некоторых высокомолекулярных веществ. Явление коллоидной защиты используется, например, при изготовлении лекарственных средств. 38. Коллоидные ПАВ (мыла, желчные кислоты). Критическая концентрация мицеллообразования. Липосомы. Коллоидные ПАВ - длинноцепочечные дифильные органические соединения с числом атомов углерода в радикале от 10 до 20. Пове́рхностно-акти́вные вещества́ (ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного натяжения. Критическая концентрация мицеллообразования ККМ – минимальная концентрация ПАВ, при которой образуются мицеллы Липосомы — самопроизвольно образующиеся в смесях фосфолипидов с водой замкнутые пузырьки. Их стенка состоит из одного или нескольких бислоёв фосфолипидов, в которые могут быть встроены другие вещества (например, белки). |
