Билет 27. С оотношение рН буферного раствора и константы диссоциации слабого электролита
 Скачать 149.39 Kb. Скачать 149.39 Kb.
|
|
27. Буферные растворы. Соотношение рН буферного раствора и константы диссоциации слабого электролита. Ацетатный и аммиачный буферные растворы. С  оотношение рН буферного раствора и константы диссоциации слабого электролита. Данное выражение называется уравнением Гендерсона-Гассельбаха. Связывает pH химического раствора слабой кислоты с числовым значением константы диссоциации кислоты Ka и отношением концентраций, кислоты и сопряженного с ней основания находятся в равновесии. 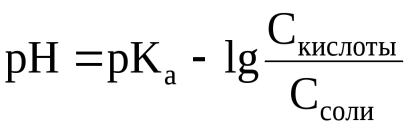 Ацетатный и аммиачный буферные растворы. Ацетатный буферный раствор представляет собой раствор уксусной кислоты СН3СООН и ацетата натрия NаСН3СОО. Аммиачный буферный раствор представляет собой раствор гидроксида аммония NH4OH и хлорида аммония NH4Cl. Буферное действие подобных растворов основано на следующих процессах. Если к ацетатному буферному раствору [СН3СООН + NаСН3СОО] прибавить в пределах буферной емкости раствор щелочи (NaOH или КОН), то будет происходить нейтрализация гидроксида слабой кислотой: (PH почти не меняется) СН3СООН + ОН– = СН3СОО– + Н2О. 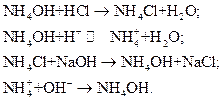 |
