теория_1-3_задание_ЕГЭ. 1-3 теория. Самый большой номер, который равен номеру периода
 Скачать 171.13 Kb. Скачать 171.13 Kb.
|
|
1,2. 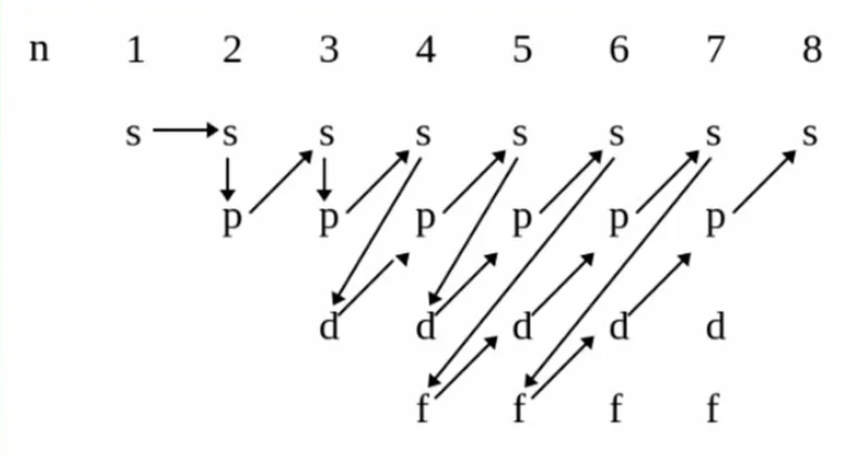 *Проскок электрона у меди и хрома (у них 4s1). Внешние электроны - это электроны, которые находятся на внешнем энергетическом уровне (электронном слое). Внешний энергетический уровень - это тот, который дальше всего находится от ядра атома, он имеет самый большой номер, который равен номеру периода. Изоэлектронные частицы – это частицы, которые имеют одинаковое строение электронной оболочки (одинаковое количество электронов на внешнем энергетическом уровне). Основные вещи: Атомный радиус увеличивается против часовой стрелки. Электроотрицательность увеличивается по часовой стрелке. Металлические свойства увеличиваются против часовой стрелки. Неметаллические свойства увеличиваются по часовой стрелке. Основные свойства увеличиваются против часовой стрелки. Кислотные свойства увеличиваются по часовой стрелке (исключение: HI > HBr > HCl). Восстановительные свойства увеличиваются против часовой стрелки. Окислительные свойства увеличиваются по часовой стрелке. Резюмируем: ПО ЧАСОВОЙ СТРЕЛКЕ УВЕЛИЧИВАЮТСЯ: Электротрицательность, неметаллические свойства, кислотные свойства, окислительные свойства.   Все логично, поскольку неметаллические свойства связаны со способностью принимать электроны связаны с электроотрицательностью и окислительными свойствами, от них напрямую зависят кислотные свойства Значит все противоположные свойства, а именно металлические, основные и восстановительные свойства увеличиваются против часовой стрелки. ПЛЮС запомнить атомный радиус сюда же. Все логично, поскольку неметаллические свойства связаны со способностью принимать электроны связаны с электроотрицательностью и окислительными свойствами, от них напрямую зависят кислотные свойства Значит все противоположные свойства, а именно металлические, основные и восстановительные свойства увеличиваются против часовой стрелки. ПЛЮС запомнить атомный радиус сюда же. ПРОТИВ ЧАСОВОЙ СТРЕЛКИ УВЕЛИЧИВАЮТСЯ: Атомный радиус, металлические свойства, основные свойства, восстановительные свойства. 3. Степень окисления — это такой заряд, который приобрел бы атом при условии, что все связи в молекуле были бы ионными
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов. Валентность показывает колличество связей. Она только положительная. У металлов - валентность = № группы; У неметаллов: высшая валентность - положительная валентность = № группы (соединение с кислородом). низшая валентность - отрицательная валентность = 8 - № группы (для соединений с металлами и водородом), но не всегда! 1 группа: I 2 группа: II 3 группа: Al и B— III, все остальные — I, III 4 группа: II, IV (*исключение углерод в CO III) 5 группа: N — III (мах – IV, а не V), все остальные — III, V 6 группа: O — II и III (CO), все остальные — II, IV, VI 7 группа: F — I, все остальные — I, III, V, VII 8 группа: 0. Благородные газы ни с кем не взаимодействуют * Fe (2,3,6), Co (2,3,5), Ni (2,3,4) – валентность два и три (у никеля есть еще четыре) * У хрома валентности 2,3,6 * У марганца 2,3,4,6,7 * Валентность фосфора чаще всего V, также возможны валентности III и IV 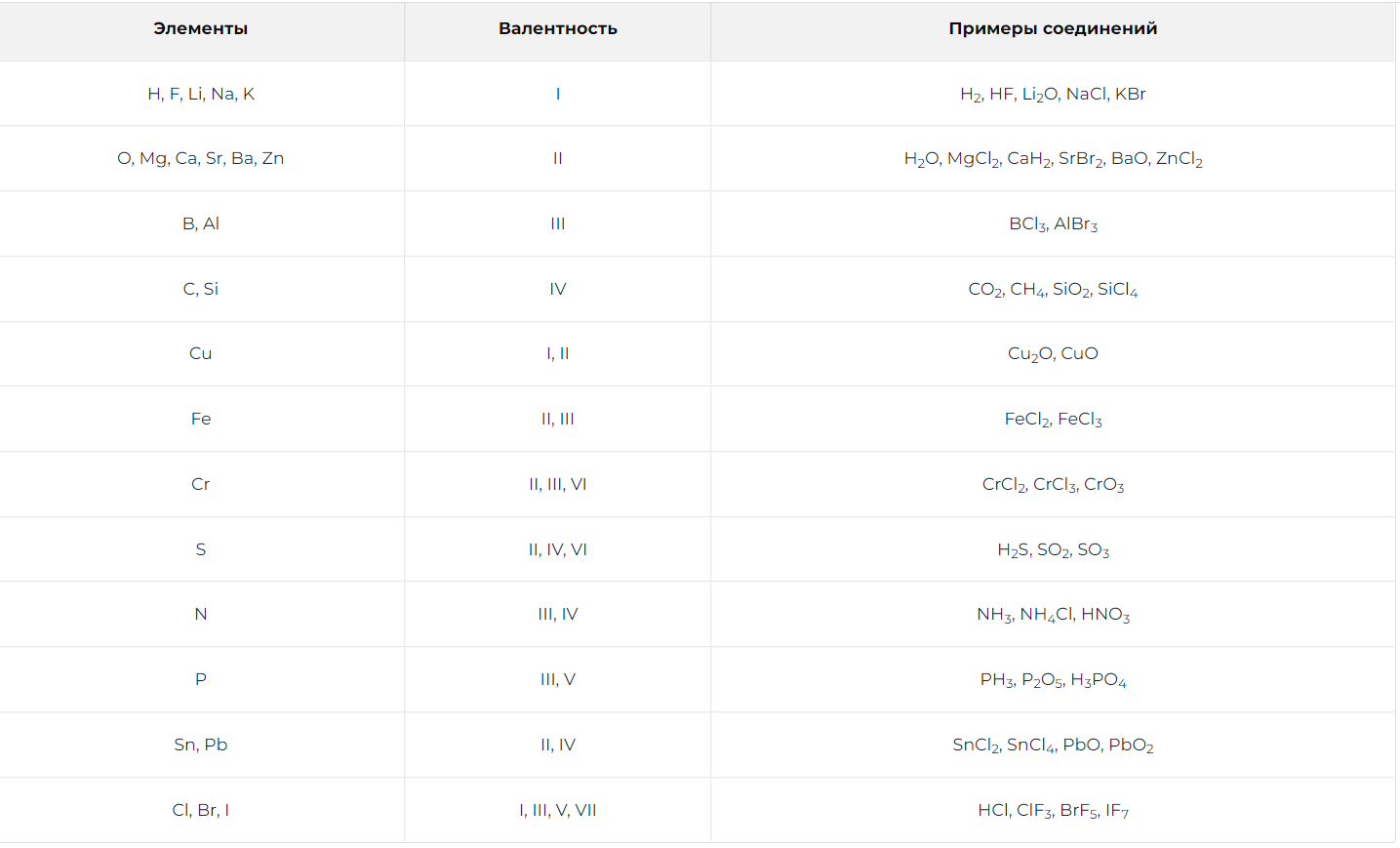 |
