исслед. работа. Самое главное вещество на Земле
 Скачать 43.13 Kb. Скачать 43.13 Kb.
|
|
Муниципальное автономное общеобразовательное учреждение «Средняя общеобразовательная школа №14» городского округа город Стерлитамак Исследовательская работа на тему: «Самое главное вещество на Земле» ( Жёсткость воды и способы её устроения) Выполнила: Фаткуллина Элина ученица 9 класса, МАОУ «СОШ№14» Руководитель: Борисова Ю.И. Стерлитамак 2021 г. Содержание 1. Введение 2. Цель и задачи работы 3. Актуальность работы 4. Теоретическая часть 4.1. Физические свойства воды 4.2. Вода в природе 4.3. Жёсткость воды, ёе виды, причины возникновения жёсткости воды 4.4. Признаки жесткости воды 4.5. Влияние жёсткости воды на организм человека, бытовую и промышленную технику. 4.6. Способы устранения жёсткости воды. 5. Практическая часть 5.1. Определение общей жёсткости воды. Методика выполнения эксперимента 5.2. Результаты анализа на жёсткость проб воды из 4-х источников 5.3. Выводы Заключение. Библиографический список. Введение Вода – великий дар природы, непременная часть всего живого и необходимая составляющая для большинства бытовых и производственных процессов. Актуальность: ежедневно мы используем воду с самыми разными целями, но не химически чистую – дистиллированную, а природную воду, насыщенную разнообразными растворными веществами. Необходимо знать, какие соли и в каком количестве должна содержаться в природной воде при её использовании в быту и технике. Проблема проекта: как правильно применять природную воду, содержащую растворённые в ней вещества. Объектом исследовательского проекта стало явление жёсткости воды, её влияние на жизнедеятельность человека и возможные способы устранения. Предметом исследования являются пробы природной воды (из водопроводной системы, реки Ашкадар, родника «Самовар») Гипотеза: вода, которая используется в быту и на предприятиях г.Стерлитамака, жесткая, что негативно влияет на работу бытовых приборов и промышленного оборудования. вода, которая используется в водопроводной системе посёлка, артезианская, то есть подземная, вода, используемая промышленными предприятиями посёлка, речная, предположим, что артезианская вода будет более жесткой по сравнению с речной водой. Цель: выяснить, что такое жёсткость воды, жёсткая ли вода в городе, какими способами её можно уменьшить и зачем. Для реализации поставленной цели были сформулированы следующие задачи: 1. Проанализировать, какие вещества могут содержаться в природной воде и почему. 2. Узнать, что такое жёсткость воды, от чего она зависит, виды жёсткости. 3. Влияние жёсткости воды на работу бытовых приборов и промышленного оборудования. 4. Исследовать способы устранения жесткости воды, подготовить рекомендации по их применению. Для решения данных задач использовались следующие методы научного познания: эксперимент, наблюдение, сравнение, анализ, расчет. 4. Теоретическая часть 4.1. Физические свойства воды «Воде дана волшебная власть стать соком жизни на Земле» Леонардо да Винчи Вода - уникальнейшее вещество, основа всех живых организмов на планете. Молекула воды, как мы знаем, состоит из одного атома кислорода и двух атомов водорода. Ее формула записывается так: H2O. Данное вещество может иметь три состояния: твердое - в виде льда, газообразное - в виде пара, и жидкое - как субстанция без цвета, вкуса и запаха. Кстати, это единственное вещество на планете, которое может существовать во всех трех состояниях одновременно в естественных условиях. Например: на полюсах Земли - лед, в океанах - вода, а испарения под солнечными лучами - это пар. Плотность воды составляет примерно 1 г/см3. Кипение воды наступает при повышении температуры до 1000С, а при падении температуры до 00С жидкость превращается в лед. У воды есть много очень интересных свойств. Она обладает самой большой на Земле удельной теплоёмкостью – 4200 Дж/кг∙0С. За счет этого вода стабилизирует температуру воздуха на всей нашей планете. Вода - это самое подвижное вещество после воздуха. Электропроводность воды очень мала, а теплопроводность высока и составляет примерно 0,58 Вт/м∙К (Ватт на метр Кельвин). Мы ежедневно используем это свойство воды, сами того не замечая. Например, наливая холодную воду в тару и остужая в ней напитки или продукты. Холодная вода забирает тепло у бутылки, контейнера, взамен отдавая холод, возможна и обратная реакция. После ртути вода обладает самым высоким значением поверхностного натяжения. Нельзя не заметить, что случайно пролитая на ровной поверхности капля иногда становится внушительным пятнышком. В этом проявляется тягучесть воды. Еще одно свойство проявляется у нее при понижении температуры до четырех градусов. Как только вода остывает до этой отметки, она становится легче. Поэтому лед всегда плавает на поверхности воды и застывает корочкой, покрывая собой реки и озера. Благодаря этому в водоемах, замерзающих зимой, не вымерзает рыба. [1] Важность этого вещества трудно переоценить. Вода занимает большую часть планеты, образует океаны, моря, реки и прочие водоемы. Она непосредственно участвует в формировании климата и погоды, обеспечивая тем самым определенные условия существования в том или ином уголке планеты. Для многих организмов она служит средой обитания. Кроме того, практически каждое живое существо в той или иной мере состоит именно из воды. Например, содержание ее в организме человека составляет от 70 до 90 процентов. 4.2. Вода в природе Вода покрывает 3/4части всей поверхности Земли, также в больших количествах находится в атмосфере и в земной коре. Водную оболочку земли называют гидросферой. Большую ее часть составляет соленая вода морей и океанов, а меньше - пресная вода озер, рек, ледников, грунтовые воды и водяной пар. В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). 4.3. Жёсткость воды, ёе виды, причины возникновения жёсткости воды В целом жесткость воды - это совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости») Виды жесткости воды Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния, выраженная в ммоль/л или моль/кг. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости. Карбонатная жесткость. Она обусловлена наличием в воде гидрокарбонатов (при рН>8,3, слабо щелочная среда) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется ещё временной жесткостью. При кипячении воды происходит следующий процесс: Са(НСО3)2 + Mg(НСО3)2 → СаСО3↓ + MgCO3↓ + 2СО2↑ + 2Н2О Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость). Различают воду мягкую (общая жёсткость до 2 ммоль/л), средней жёсткости (2 – 10 ммоль/л) и жёсткую (больше 10 ммоль/л). [2] Жёсткость воды, кроме ммоль/л или моль/кг, могут выражать и в мг-экв/л. Таким образом, 20,04мг кальция [Ca2+] обусловливают 1мг-экв/л кальциевой жёсткости, 12,16мг магния [Mg2+] – 1мг-экв/л магниевой жёсткости. Общую жёсткость воды обычно определяют по формуле: Общ. ж. = 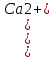 + + 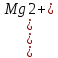 , , где [Ca2+] и [Mg2+] – содержание ионов кальция и магния в 1л воды в миллиграммах. В настоящее время разработаны методы, позволяющие определять общую жёсткость воды без раздельного определения жёсткости по кальцию и магнию; при этом находят сумму миллиграмм-эквивалентов кальция и магния в 1л воды. При таком определении вода с жёсткостью менее 4мг-экв/л характеризуется как мягкая, от 4 до 8мг-экв/л – как жёсткая, а выше 12мг-экв/л – как очень жёсткая. [3]
Верхний предел Ж.в. в системах водоснабжения составляет, как правило, 7ммоль/л (в исключительных случаях – до 10ммоль/л) Выделяют несколько видов воды по её химическому составу: мягкая и жесткая, лёгкая и тяжёлая, пресная и солёная… Как вещество, вода играет уникальную роль, определяющую возможность существования и саму жизнь всех существ на Земле. Также она играет роль универсального растворителя, в котором выполняются многие биохимические процессы. Откуда берётся жесткость воды? Вода, проходя через круговорот воды в природе, из мягкой превращается в жёсткую. Это происходит за счет того, что попадая в почву, вода растворяет в себе породы гипса СаSO4∙2H2O, известняка CaCO3, доломитов CaCO3∙MgCO3. Нерастворимые карбонаты в природных условиях взаимодействуют с растворённым в воде углекислым газом и образуют растворимые гидрокарбонаты. Жесткость поверхностных вод меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/л) [2] 4.4. Признаки жесткости воды Характерными признаками жесткости воды являются: одежда после стирки в такой воде теряет форму, ткань становится более грубой, мыло и порошки плохо пенятся, после кипячение такой воды на стенках кастрюль появляется налёт, портятся вкусовые качества еды приготовленной в жёсткой воде. 4.5. Влияние жёсткости воды на организм человека, бытовую и промышленную технику Жесткая вода несет проблемы. Оседая на стенках трубопровода, накипь вызывает коррозию и закупоривает его, снижая теплопроводность. 60% электроэнергии уходит на то, чтобы нагреть отложившуюся накипь. В результате образования известкового налета потери электроэнергии в системе центрального отопления могут составлять до 60%, а денежные затраты увеличиться до 30%. Чем толще слой накипи, тем выше затраты на электроэнергию. Слой накипи толщиной 1мм увеличивает сумму счетов за электроэнергию на 10%. Котельное оборудование из-за жесткой воды может испортиться. Поэтому умягчение в данном случае - процедура обязательная. Влияние жёсткой воды на организм человека: Высокая жесткость способствует росту мочевых камней и развитию мочекаменной болезни. Это связано с накоплением солей, которые просто не успевают выводиться из организма. При умывании жесткая вода сушит кожу. Это происходит из-за появления «мыльных шлаков» образованных из мыла, которое не способно мылиться и растворяться в жесткой воде. Эти мыльные шлаки закупоривают поры, не давая им свободно дышать, вследствие чего могут развиваться кожные воспаления, не давать покоя зуд и жжение кожи. Образование тонкой корке на волосах разрушает естественную жировую пленку. Происходит это так же, как и на коже рук – «мыльные шлаки» не вымываются и постепенной накапливаются. Это может вызвать зуд кожи головы, перхоть и даже выпадение волос. 4.Влияние сильно жесткой воды на здоровье животных не отличается от воздействия на человеческий организм. Существует высокий риск развития мочекаменной болезни. У питомцев, питающихся сухими кормами, этот риск возрастает в несколько раз. Возможно появление проблем с шерстью и кожей, как у собак, так и у кошек при их регулярном купании. 5.Замедляется процесс приготовления пищи, из-за многочисленных солей плохо разваривается мясо. Это приводит к плохому усвоению белка и может вызвать заболевания желудочно-кишечного тракта. [7] 4.6. Способы устранения жёсткости воды. 1) Для избавления от временной жёсткости необходимо просто вскипятить воду. При кипячении воды гидрокарбонаты разлагаются с образованием осадка среднего или основного карбоната: Ca(HCO3)2 = СаСО3↓+ СО2↑+ Н2О, 2Mg(HCO3)2 = Мg2(ОН)2СО3↓ +3СО2↑ + Н2О, и жёсткость воды снижается. Поэтому гидрокарбонатную жёсткость называют временной. 2) Умягчить жёсткую воду можно и обработкой воды различными химическими веществами. Так, временную (карбонатную) жёсткость можно устранить добавлением гашеной извести: Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O Са2+ +2НСО–3 + Са2+ + 2ОН– = 2СаСО3↓+ 2Н2О Mg(HCO3)2 + Ca(OH)2 = MgCO3↓ + CaCO3↓ + 2H2O Mg2+ +2НСО–3 + Са2+ + 2ОН– = MgCO3↓+СаСО3↓+ 2Н2О. При одновременном добавление извести и соды можно избавиться от карбонатной и некарбонатной жёсткости (известково-содовый способ). Карбонатная жёсткость при этом устраняется известью, а некарбонатная – содой: Ca(HCO3)2 + Na2CO3 = СаСО3↓ + 2NaHCO3 СаСl2 + Na2CO3 = CaCO3↓+ 2NaCl Са2+ + СО32- = СаСО3↓ Mg(HCO3)2 + Na2CO3 = MgСО3↓ + 2NaHCO3 MgСl2 + Na2CO3 = MgCO3 ↓+ 2NaCl. Mg2+ + СО32- = Mg СО3 3) Для борьбы с постоянной жёсткостью воды используют такой метод, как вымораживание льда. Необходимо просто постепенно замораживать воду. Когда останется примерно 10 % жидкости от первоначального количества, необходимо слить не замершую воду, а лёд превратить обратно в воду. Все соли, которые образую жёсткость, остаются в не замершей воде. 4) Ещё один способ борьбы с постоянной жёсткостью – перегонка, т.е. испарение воды с последующей её конденсацией. Так как соли относятся к нелетучим соединениям, то они остаются, а вода испаряется, затем конденсируется, получается дистиллированная вода. 5.Практическая часть 5.1. Определение общей жёсткости воды. Методика выполнения эксперимента Трилонометрическое определение жесткости состоит в следующем: ионы Са2+ и Мg2+ образуют с красителями окрашенные комплексные соединения в эквивалентной точке. Прочность этих «индикаторных» комплексов значительно меньше, чем прочность комплексов катионов с трилоном — Б. Поэтому добавление раствора трилона-Б к окрашенным растворам, содержащими комплексы Са2+ и Мg2+ с индикаторами, разрушает их, восстанавливая цвет свободного индикатора. Прибавление раствора трилона-Б до полного восстановления цвета индикатора является ошибочным: по мере добавления трилона-Б цвет жидкости вблизи эквивалентной точки изменяется постепенно. Окончанием титрования считать наиболее резкое изменение окраски. Необходимые реактивы: 1. Титрованные растворы трилона-Б 0,1Н и 0,01Н концентрации 2. Аммиачная буферная смесь 2%-ная по аммиаку и 2%-ная по хлориду аммония 3. Раствор индикатора: 0,5% кислотный хром тёмно-синий 4. Дистиллированная катионированная вода 5. Боратный буферный раствор. Ход определения. Для определения жесткости воды берут коническую колбу на 250-300мл, отмеряют пипеткой нужное количество воды (указано в таблице инструкции, приложение 1), этот объём доводят катионированной дистиллированной водой до 100мл, добавляют 5мл аммиачного буферного раствора и 7-8 капель раствора индикатора кислотный хром тёмно-синий. После чего медленно титруют раствором трилона-Б, всё время интенсивно перемешивая до изменения окраски с красной на синевато-сиреневую. Для вычисления жесткости воды с высокой жесткостью применяют формулу: Ж = 1000∙ 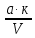 , мг - экв/л, где а - расход 0,1Н раствора трилона-Б, мл; к - коэффициент децинормальности раствора трилона-Б (0,1мг-экв/мл); V— объем пробы анализируемой воды, отобранной для титрования, мл. , мг - экв/л, где а - расход 0,1Н раствора трилона-Б, мл; к - коэффициент децинормальности раствора трилона-Б (0,1мг-экв/мл); V— объем пробы анализируемой воды, отобранной для титрования, мл.Для вычисления жесткости воды с низкой жесткостью применяют формулу: Ж = 0,1•а•к, мг-экв/л, где а - расход 0,01 Н раствора трилона-Б, мл, к - коэффициент сантинормальности раствора трилона-Б (0,01мг-экв/мл) [6] 5.3. Результаты анализа на жёсткость проб воды Проба №1 – водопроводная вода - жёсткость воды составляет 37 мг-экв/л,т.е.водопроводная (артезианская) вода является очень жёсткой Проба №2 – вода из родника «Самовар» - жёсткость воды составляет 10 мг-экв/л - вода является очень жёсткой. Проба №3 – вода из реки Ашкадар - жёсткость воды составляет 4мг-экв/л – вода мягкая. Проба №4 – вода дистилированная - жёсткость воды составляет 0,001 мг-экв/л – вода глубокоумягчённая Выводы Результаты исследования, проведённого в ходе выполнения проектной работы, полностью подтвердили выдвинутую гипотезу. Водопроводная вода жёсткая. Жёсткую воду перед употреблением целесообразно умягчить – кипячением. При стирке белья в стиральной машине необходимо добавлять в стиральный порошок средства для умягчения воды. Для питья и полива цветов можно использовать фильтры разных модификаций. Заключение Результаты исследования, проведённого в ходе выполнения работы, полностью подтвердили выдвинутую гипотезу. Водопроводная вода действительно жёсткая. Жесткость воды в основном карбонатная из-за особенностей геологического строения территории, на которой расположен город. Жёсткую воду перед употреблением целесообразно умягчить. Наша вода, применяемая для питья, легко умягчается кипячением. Вода, поступающая в стиральные, посудомоечные машины, в газовые котлы для отопления, обязательно должна умягчаться специальными химическими фильтрами. При стирке белья в стиральной машине необходимо добавлять в стиральный порошок средства для умягчения воды. Однако для жизнедеятельности человеческого организма ионы кальция и магния необходимы, так как играют важную роль в процессах формирования костной ткани, свёртываемости крови, сокращения сердечной мышцы, передачи нервных импульсов. Установлено, что в местностях с пониженным содержанием кальция и магния в питьевой воде сердечные заболевания более распространены. Отсюда следует, что важно вести контроль над содержанием солей кальция и магния в питьевой воде. [7] Библиографический список 1. Сайт FB.ru>article/337312 Вода: электропроводность и теплопроводность. Единицы измерения электропроводности воды 2. Химический энциклопедический словарь. Главный редактор И.Л. Кнунянц. М: «Советская энциклопедия», 1983 3. Справочник по элементарной химии. Под общ. ред. А.Т. Пилипенко.Изд. 2-е, перераб. и доп. К., «Наукова думка», 1978 4. Инструкция по анализу воды, пара, накипи и отложений в теплосиловом хозяйстве. Госуд. энерг. издательств. Москва, Ленинград, 1953 5. Атлас Курской области. Главное управление геодезии и картографии при Совете Министров СССР., Москва, 1968 6. Инструкция по определению жёсткости воды. 7. www.webmedinfo.ru. Влияние солей кальция и магния на организм человека | |||||||||||||||||
