|
|
Типовой расчёт №1, Вар 13 (цифровой вариант). Самостоятельная работа по химии 1 1го курса очной формы обучения Вариант 13 Студент группы э1009
Государственное образовательное учреждение высшего профессионального образования
МОСКОВСКИЙ ЭНЕРГЕТИЧЕСКИЙ ИНСТИТУТ
(ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ)
ФАКУЛЬТЕТ ИЭЭ
Самостоятельная работа по химии №1
1-го курса очной формы обучения
Вариант №13
-
Студент группы Э-10-09
Чеботарёв М.Ю. ______________
|
Руководитель
Пуцилов И.А. ______________
|
Москва 2009 г.
|
|
|
Самостоятельная работа №1
Задание 1.
1.1. Определите, атому какого элемента и какому его состоянию отвечает следующая
электронная формула:
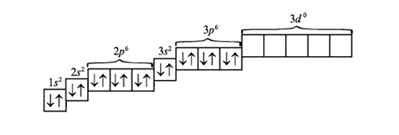
1s2 2s2 2p6 3s2 3p6
18Ar (Аргон)
1.2. Для данного элемента покажите распределение электронов предвнешнего и внешнего
энергетических уровней по атомным орбиталям графически.
1.3. Определите возможные валентности атома.
B = 0 B* = 2, 4, 6, 8.
|
|
|
|
|
|
|
|
лист
|
|
|
|
|
|
|
1
|
|
изм
|
лист
|
№ докум
|
подпись
|
дата
|
|
Задание 2.
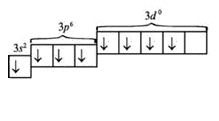
2.1. Укажите элемент, иону которого отвечает следующая электронная формула
Ион: Э3-
Формула: 1s2 2s2 2p6
7N (Азот)
2.2. Руководствуясь Периодической системой, найдите для Вашего иона изоэлектронные атомы или другие ионы. (Изоэлектронные частицы - частицы, содержащие одинаковое число электронов).
-
1s2 2s2 2p6
|
Степень окисления
|
Ne
|
0
|
F1-
|
-1
|
O2-
|
-2
|
N3-
|
-3
|
C4-
|
-4
|
|
|
|
|
|
|
|
|
лист
|
|
|
|
|
|
|
2
|
|
изм
|
лист
|
№ докум
|
подпись
|
дата
|
|
Задание 3.
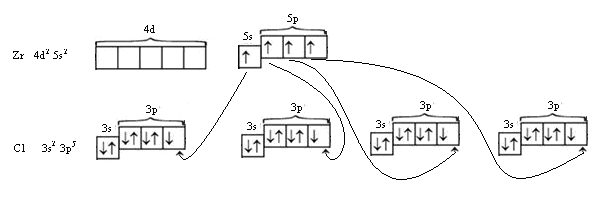
3.1. По координатам элемента в Периодической системе составьте формулу его атома, определите порядковый номер элемента и его название.
5й период, IV Б группа
40Zr7 → 1s2 2s2 2p63s2 3p63d10 4s2 4p64d0 5s0 (Цирконий)
3.2. Укажите квантовые числа (n, l, ml, ms) формирующего электрона атома, найденного
в задании 3.1, и определите число не спаренных электронов в данном атоме.
n = 5 l = 2 ml = -2; -1; 0; 1;2 ms = - 1/2
Число не спаренных электронов равна 0.
3.3. Составьте электронную конфигурацию одноатомного иона найденного элемента указанными в графе 4 зарядом. Определите общее число валентных электронов.
4+
1s2 2s2 2p63s2 3p63d10 4s2 4p6
Общее число валентных эелктронов равна 0.
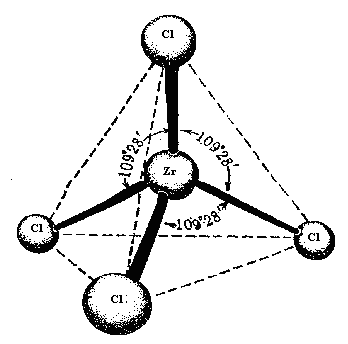
3.4. Определите геометрическую форму указанных в графе 5 частиц. Имеет ли место гибридизация атомных орбиталей и если да, то какая? Укажите полярна или неполярна данная молекула.
ZrCl4
Геометрическая форма - тетраэдр
sp3 - гибридизация атомных орбиталей
Молекула неполярная, т.к. она симметрична и отрицательные заряды стягивают на себя электронную плотность. Сумма моментов диполей = 0.
3.5. Сравните полярность связи в молекуле соответствующей Вашему варианту с полярностью молекулы, приведённой в варианте на единицу меньше.
-
№В
|
Координаты в ПСХЭ
|
Формальный или реальный заряд иона
|
Частица
|
Период
|
Группа
|
12
|
5
|
II A
|
2+
|
SrCl2
|
13
|
5
|
IV Б
|
4+
|
ZrCl4
|
|
|
|
|
|
|
|
|
лист
|
|
|
|
|
|
|
3
|
|
изм
|
лист
|
№ докум
|
подпись
|
дата
|
|
ZrCl4
СП = 4
НП = 0
sp3 - гибридизация
Тетраэдр
т.к. δ ЭО = (2,83 - 1,22) => связь полярная.
μмол = ∑ μсв ≠ 0 => молекула неполярная.
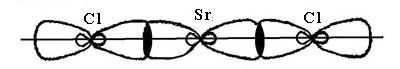
SrCl2
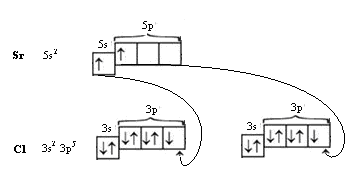
 СП = 2 СП = 2
НП = 0
Sp - гибридизация
Линейная
т.к. δ ЭО = (2,83 - 0,99) => связь полярная.
μмол = ∑ μсв ≠ 0 => молекула неполярная.
SrCl2 - связь более полярна, т.к. δ ЭОSrCl2 > ЭОZrCl4
|
|
|
|
|
|
|
|
лист
|
|
|
|
|
|
|
4
|
|
изм
|
лист
|
№ докум
|
подпись
|
дата
|
|
Задание 4.
4.1. Определите виды межмолекулярного взаимодействия (Эффект Кьезома, Дебая и Лондона,
Н-связи)
Cl2- Cl2
Вандервальсовы силы - единственная составляющая для неполярных молекул.
Ответ: Вандервальсовы силы
4.2. Какое межмолекулярное взаимодействие является универсальным и действует между любыми частицами?
Ответ: Вандервальсовы силы
4.3. При каких условиях в газах практически отсутствует межмолекулярное взаимодействие? Как оно изменяется и почему при понижении температуры и повышении давления?
1. разрежение, низкая температура.
2. при повышении температуры межмолекулярное взаимодействие уменьшается (молекулы движутся медленнее), а при повышении давления взаимодействие увеличивается (молекулы чаще сталкиваются)
|
|
|
|
|
|
|
|
лист
|
|
|
|
|
|
|
5
|
|
изм
|
лист
|
№ докум
|
подпись
|
дата
|
|
Задание 5.
5.1. Составьте формулу комплексного соединения, если комплексообразователь Pt4+
№В
|
Компл. орб-тель
|
Лиганд
|
К.ч.
|
Внеш. сфера
|
13
|
Cl2-
|
4Cl-
2OH-
|
6
|
H+
|
H2[PtCl4(OH)2]
5.2. Какая связь формируется между внутренней и внешней сферами и какая связь внутри самого комплекса?
Внутри комплекса - донорно-акцепторный механизм
Снаружи - силы электростатического притяжения
5.3. Определите структуру комплексного иона.
Pt - 6 орбиталей
Sp3d2 - октаэдр
5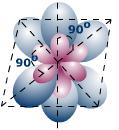 .4. Нарисуйте энергетическу диаграмму расщепления АО комплексообразователя. .4. Нарисуйте энергетическу диаграмму расщепления АО комплексообразователя.
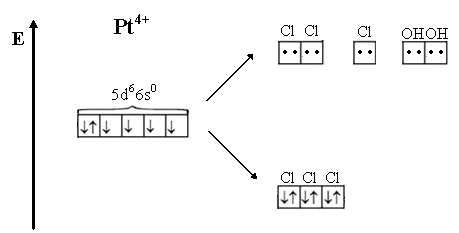
5.5. Определите, является ли комплекс:
а) внешнеорбитальным или внутриорбитальным;
б) высокоспиновым или низкоспиновым;
в) парамагнетиком или диамагнетиком.
Ответ: а) внутриорбитальный
б) низкоспиновый
в) диамагнетик
|
|
|
|
|
|
|
|
лист
|
|
|
|
|
|
|
6
|
|
изм
|
лист
|
№ докум
|
подпись
|
дата
| |
|
|
 Скачать 3.27 Mb.
Скачать 3.27 Mb.