Теория Производство серы. охт сера теория. Серная кислота при обычных условиях представляет собой бесцветную маслянистую жидкость без цвета и запаха
 Скачать 325.62 Kb. Скачать 325.62 Kb.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при н. у.) | 2,070 г/см³ |
| Температура плавления | 386 К (112,85 °С) |
| Температура кипения | 717,824 К (444,67 °С) |
| Уд. теплота плавления | 1,23 кДж/моль |
| Уд. теплота испарения | 10,5 кДж/моль |
| Молярная теплоёмкость | 22,61[2] Дж/(K·моль) |
| Молярный объём | 15,5 см³/моль |
Таблица 1. Термодинамические свойства простого вещества серы
В настоящее время элементную серу в промышленности получают из природного газа, где сера в больших количествах содержится в виде сероводорода, а также из руд и месторождения серы.
На следующем этапе производства серной кислоты из диоксида серы получают триоксид серы. Если в качестве исходного сырья используют отходящие газы, содержащие диоксид серы, тогда можно перейти сразу к этой ступени.
В промышленности окисление диоксида серы проводят контактным методом с использование катализаторов. Больше всего процесс окисления ускоряют: платина, оксид ванадия (V) и оксид железа. На практике лучше всего себя проявляет катализатор из оксида ванадия (V). Реакция окисления диоксида серы описывается уравнением вида: 2SO2+O2=2SO3.
На последнем этапе производства серной кислоты триоксид серы переводят в серную кислоту с помощью абсорбции. Уравнение можно представить в виде: SO3+H2O=H2SO4.
Характеристика целевого продукта
Серная кислота H2SO4представляет собой соединение олеума и воды. Одну молекулу H2SO4 следует рассматривать как соединение одной молекулы SO3 и одной молекулы H2O. В широком смысле под серной кислотой понимается соединение любого количества олеума с водой. В растворе возможно содержание свободных молекул воды в серной кислоте, или содержание свободных молекул олеума в серной кислоте, в зависимости от массового отношения компонентов.
Безводная серная кислота при нормальных условиях представляет собой бесцветную маслянистую жидкость, которая кристаллизуется при 10С. Максимальную температуру кипения имеет раствор серной кислоты с концентрацией 98,3% - температура кипения 336,5С. Плотность паров над раствором при этой же концентрации минимальна, при других концентрациях она увеличивается.
При повышении температуры пары H2SO4 с большей скоростью разлагаются на триоксид серы и воду.
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
| H2SO4 | SO3 (свободный) | |||
| 10 | - | 1,0661 | −5,5 | 102,0 |
| 20 | - | 1,1394 | −19,0 | 104,4 |
| 40 | - | 1,3028 | −65,2 | 113,9 |
| 60 | - | 1,4983 | −25,8 | 141,8 |
| 80 | - | 1,7272 | −3,0 | 210,2 |
| 98 | - | 1,8365 | 0,1 | 332,4 |
| 100 | - | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Таблица 2. Свойства водных растворов серной кислоты и олеума
При повышении концентрации теплоёмкость и теплопроводность серной кислоты уменьшается.
Серная кислота обладает максимальной вязкостью при повышении концентрации. Повышение температуры способствует снижению вязкости серной кислоты.
Серная кислота является одной из самых сильных минеральных кислот.
При нагревании проявляет сильные окислительные свойства.
Серная кислота хорошо взаимодействует с водой и используется для сушки, или обезвоживания, газов, жидкостей и твердых тел в тех случаях, когда не присутствует сильный восстановитель, который мог бы взаимодействовать с серной кислотой.
Серная кислота при нагревании используется для очистки поверхностей металлов. При нагревании она способна реагировать с образующимися на поверхности оксидами металлов. Также серная кислота реагирует со всеми металлами, стоящими в ряду напряжений металлов левее водорода, с выделением водорода.
Серная кислота образует два ряда солей – сульфаты и гидросульфаты.
Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производства
Обжиг серосодержащего сырья. На первой стадии, в том случае, если за исходное сырье мы принимаем не отходящие газы, содержащие SO2, нам необходимо провести обжиг и окисление серосодержащего сырья для получения диоксида серы. При горении колчедана происходит несколько реакций:
1. 2FeS2=2FeS+S (-103,9 кДж/моль)
2. S+O2=SO2 (+362,4 кДж/моль)
По такой схеме происходит и горение элементной серы.
Железный колчедан сгорает с образованием оксидов железа Fe2O3 и Fe3O4. Суммарно схему сгорания колчедана можно представить:
1. 4FeS2+11O2= 2Fe2O3+ 8SO2 (+3415,7 кДж/моль)
2. 3FeS2+8O2= Fe3O4+ 6SO2 (+2438,2 кДж/моль)
Для получения Fe3O4 лучше проводить реакцию при высокой температуре и при избытке SO2. Тогда образующийся Fe2O3 можно снова использовать для окисления FeS2.
1. FeS2+ 16Fe2O3= 11Fe3O4+ 2SO2 (-450,8 кДж/моль)
2. 11Fe3O4+2,75O2=16,5Fe2O3 (+1279,2 кДж/моль)
Суммарный тепловой эффект процесса составляет 828,4 кДж/моль, что обеспечивает автотермичность процесса и позволяет получать высококонцентрированный SO2.
Так как в качестве исходного сырья мы используем элементную серу, то нашему процессу отвечает реакция: S+O2=SO2 (+362,4 кДж/моль)
Так как горение серы начинается при нагревании, а в результате реакции выделяется тепло – реакция является автотермичной и может поддерживать себя самостоятельно.
Реакция окисления SO2 в SO3 протекает по уравнению: 1. SO2 +1/2 O2 = SO3 (тепловой эффект реакции: -98,8 кДж/моль)
Реакция окисления сернистого газа в серный простая, обратимая, экзотермическая.
В интервале температур 400 – 1000°С реакция окисления SO2 обратима. При температурах ниже 400°С равновесие почти полностью смещено в сторону SO3, при температурах выше 1000°С – в сторону исходных веществ. На равновесную степень превращения в соответствии с принципом Ле-Шателье положительно влияют понижение температуры, повышение давления, увеличение концентрации кислорода и вывод SO3 из зоны реакции.
Реакция не протекает без катализатора из-за высокого значения энергии активации (Еа=280 кДж/моль). Реакция ускоряется в присутствии платины (Еа=70 кДж/моль) при температуре не ниже 25О°С, оксида железа (III) (Еа=150 кДж/моль) при температуре не ниже 55О°С, оксида ванадия (V) при температуре не ниже 400°С (Еа=90 кДж/моль).
Платиновый катализатор обладает наибольшей активностью, однако дорог и быстро отравляется ядами (мышьяком, селеном, хлором и др.). Оксид железа (III) - малоактивный катализатор. В настоящее время в производстве серной кислоты применяется только ванадиевый катализатор.
Процесс гетерогенного катализа на пористом катализаторе многостадиен. В общем виде различаются следующие стадии:
Перенос газообразных веществ из объема к поверхности катализатора (внешняя диффузия);
Диффузия реагирующих веществ внутри пор катализатора (внутрен- няя диффузия);
Адсорбция O2 и SO2 на катализаторе;
Химическое взаимодействие исходных веществ с участием катализа- тора;
Десорбция SO3;
Диффузия SO3 внутри зерна катализатора к его поверхности (внутрен- няя диффузия);
Отвод продукта реакции в газовую фазу (внешняя диффузия).
Скорость всего процесса определяется скоростью наиболее медленной стадии. В зависимости от выбранных условий скорость образования SO3 определяется скоростью внешней или внутренней диффузии или же скоростью химического взаимодействия.
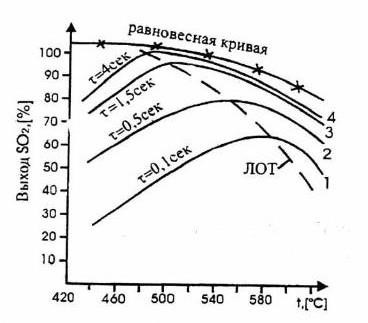
Рисунок 1.Зависимость практического выхода SO3 от температуры при различном времени контактирования.
С увеличением времени контактирования максимумы на кривых
смещаются в сторону более низких температур. Кривую, соединяющую эти максимумы, называют линией оптимальных температур (ЛОТ). При проведении процесса по линии оптимальных температур окисление оксида серы (IV) протекает с максимально возможными скоростями в каждый момент. Понижение температуры к концу процесса с 600 до 4000С позволяет получить высокий выход продукта.
Абсорбция оксида серы SO3 в воде описывается следующим уравнением: nSO3+H2O↔H2SO4+(n-1)SO3 -∆H
Реакция является обратимой экзотермической и проходит с выделением большого количества тепла. Тепловой эффект зависит от значения n. Для n=1 ∆H=92 кДж.
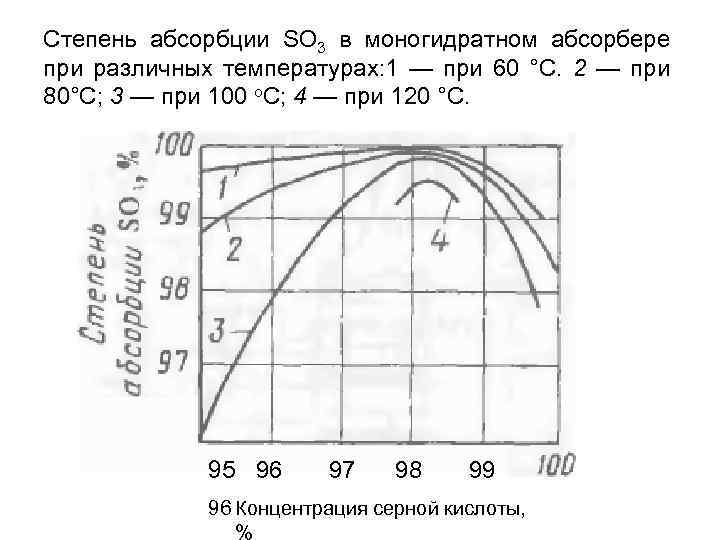
В случае использования воды в качестве поглотителя, вследствие взаимодействия молекул из-за большого равновесного давления паров над поверхностью, образуется туман из молекул H2SO4. Самым лучшим растворителем для олеума является 98,3% H2SO4.
Таким образом, растворение олеума проводят в системах при постоянном отводе большого количества тепла.
Функциональная схема производства серной кислоты из серы методом двойного контактирования:
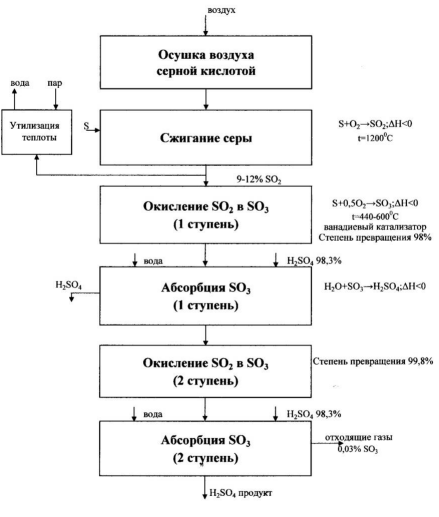
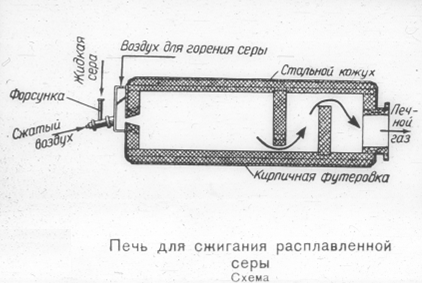
Описание технологической схемы процесса
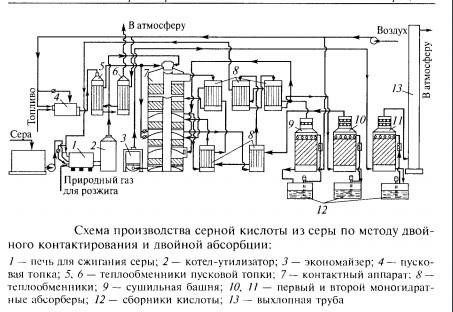
Рисунок 4. Технологическая схема производства серной кислоты из серы методом двойного контактирования и абсорбции
Расплавленная сера проходит через сетчатые фильтры, чтобы очистить ее от возможных механических примесей и направляется в печь 1, предварительно осушенный продукционной серной кислотой в сушильной башне 9. Обжигающий газ, выходящий из печи, охлаждается в котле-утилизаторе 2 с 1100-1200 Т до 440 ° С.
450 °C и направлен при этой температуре, равной температуре воспламенения промышленных катализаторов на основе пентоксида ванадия, на первый полочный слой контактного аппарата 7.
Температурный режим, необходимый для приведения рабочей линии процесса к линии оптимальных температур, регулируется путем пропускания потоков частично прореагировавшего топочного газа через теплообменники 8, где он охлаждается потоками нагретого газа после После третьей ступени контактирования обжиговый газ охлаждают в теплообменниках 8 и направляют в промежуточный моногидратный абсорбер 10, орошаемый циркулирующей через сборник кислоты 12 серной кислотой с концентрацией, близкой к 98,3%. После извлечения в абсорбере 10 триоксида серы и достигнутого вследствие этого отклонения от почти достигнутого равновесия газ вновь нагревают до температуры зажигания в теплообменниках 8 и направляют на четвертую ступень контактирования.
В этой схеме для охлаждения газа после четвертой ступени и до равновесного перемешивания в него добавляется часть осушенного воздуха. Прореагировавшие в контактном устройстве газы проходят для охлаждения через экономайзер 3 и направляются в конечный поглотитель моногидрата 11, из которого газы, не содержащие оксидов серы, выпускаются через выхлопную трубу 13 в атмосферу.
Для запуска установки нужны пусковая печь 4 и теплообменники пусковой печи 5 и 6. Эти устройства отключаются после ввода установки в эксплуатацию.
ПРИНЦИПЫ НАИЛУЧШЕГО ИСПОЛЬЗОВАНИЯ СЫРЬЯ, ЭНЕРГИИ, ОБОРУДОВАНИЯ.
Принцип наилучшего использования сырья в производстве серной кислоты реализуется благодаря использованию системы двойного контактировании и двойной абсорбции, чтобы не допускать побочные реакции и добиться высокой степени превращения. Также применяют комбинирование производства так, что сырьём для производства серной кислоты могут служить отходящие газы металлургических производств;
Принцип наилучшего использования энергии реализуется благодаря передаче тепла на стадии охлаждения реагента для создания пара, который используется на более поздней стадии производства. А также благодаря проведению превращения при оптимальной температуре так, чтобы добиться максимального выхода.
Принцип наибольшей интенсивности процесса реализуют благодаря подбору давления, времени контактирования, системе двойного контактирования и двойной абсорбции в каждый момент проведения процесса согласно ЛОТ.
Принцип экологической безопасности производства реализован благодаря рациональному использованию тепловой энергии, то есть её утилизации в процессе, а также благодаря высокой степени очистки отходящих газов и повторному использованию непрореагировавшего сырья.
Принцип технологической соразмерности реализуется нахождением баланса между термодинамикой и кинетикой в процессе окисления SO2 в SO3: для работы катализатора необходима высокая температура, но из-за того, что реакция обратима и при высокой температуре выход смещается в сторону реагентов. Необходимо проводить процесс при переменной оптимальной температуре так, чтобы добиться максимального выхода при высокой скорости процесса.
