Матлаб. мтлб6срсСейіткерім Құндыз. СЖ 6Стационарлы кйлерді реакция жылдамдыыны тратылыына туелділігін зерттеіз
 Скачать 69.98 Kb. Скачать 69.98 Kb.
|
|
Сейіткерім Құндыз Хи-316 СӨЖ 6-Стационарлық күйлердің реакция жылдамдығының тұрақтылығына тәуелділігін зерттеңіз. Стационарлық күй – белгілі бір шамаларының маңызды сипаттамалары (әр түрлі жағдайда түрліше болады) уақытқа тәуелсіз физикалық жүйе күйі. Мысалы, егер қозғалыс жылдамдығы кеңістіктің әрбір нүктесінде уақыт бойынша өзгермесе, онда сұйықтық ағысының күйі стационарлы. Кванттық механикада Стационарлы күй деп энергия белгілі бір мәнде (уақыт бойынша өзгермейтін) болатын күйді атайды. Химиялық реакцияның жылдамдығы деп уақыт бірлігінде жүйедегі жүретін реакциялардың элементар актісіндегі зат концентрациясының өзгерісін (гомогенді реакция) айтады. Ал, гетерогенді реакция үшін – оның элементар актісіндегі фазаның бөліну бетінде концентрацияның уақыт бірлігіндегі өзгерісін айтады. Уақыттың өте аз бөлігіндегі концентрация өзгерісін лездік жылдамдық деп атайды, ол суреттегі (6.1) бұрыштың тангенсімен анықталады. Зат концентрациясының уақытқа байланысты өзгерісін көрсететін графикті кинетикалық қисығы деп атайды. (6.2) формуладағы S –меншікті беттік аудан, бұл шама неғұрлым кіші мәнді болса, яғни бөлшек ұсақ болса, реакция жылдамырақ жүреді. Реакция жылдамдығына температура әсері Атом-молекулалық ілім тұрғысынан температура артқан сайын молекулалардың қозғалыс жылдамдығы артып, олардың бір-бірімен соқтығысу дәрежесі артатыны түсінікті. Ал, осының заңдылығы Вант-Гофф ережесімен анықталады. 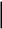 Температураны әрбір 10 оС-қа арттырған сайын реакция жылдамдығы 2-4 есе артады. Температураны әрбір 10 оС-қа арттырған сайын реакция жылдамдығы 2-4 есе артады.Бұл ереженің математикалық өрнегі:  (6.4) (6.4)мұндағы t2>t1, γ – температуралық коэффициент, оның мәні 2-4 аралығында болады. Молекулалардың кез келген соқтығысуы реакцияға әкеліп жеткізбейді, тек химиялық белсенді молекулалар соқтығысы реакцияның жүруіне себепші болады, олай болса, молекулалар өзара әрекеттесуі үшін олардың белгілі бір энергия қоры болуы қажет. Жылдамдық константалары белгілі болса, температуралық коэффициенті мына формула бойынша есептеуге болады: 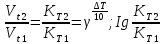 = = 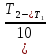 Ig γ(6.5) Ig γ(6.5)Химиялық әсерлесу актін жүзеге асыруға қажетті минимальды энергия қорын активтендіру энергиясы (Еа) деп атайды, ол әрекеттесетін зат табиғатына байланысты болады. Активтендіру энергиясы неғұрлым үлкен болса, реакция жылдамдығы аз және керісінше Еакт мәні кіші болса, реакция жылдамдығы жоғары болады. Температура артқан сайын химиялық белсенді молекулалар саны артады. Осындай молекулалар соқтығысы жалпы соқтығысатын молекулалар санына тәуелді. Жылдамдық константасы мен активтендіру энергиясының байланысын Аррениус формуласы береді: K = A· e–EA/RT (6.6) Мұнда, А – тұрақты шама, температураға байланыссыз. Егер логарифмдесек: IgK = lgA – 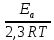 (6.7) (6.7)Сонда (6.7) теңдеуі y = ax+b түзуінің теңдеуіндей болады. Осыдан lgK – 1/T арасындағы байланыс графигін құрып, активтендіру энергиясының сандық мәнін анықтауға болады. Жылдамдық константасы екі температурада берілсе: 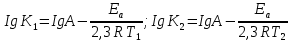 Екі теңдікті бірінен екіншісін алсақ: 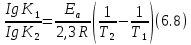 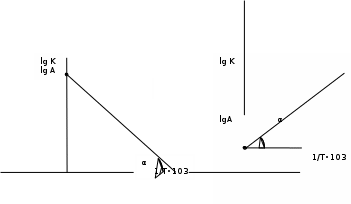 а ә Сурет 6.2Реакцияның активтендіру энергиясын анықтауға арналған lnA – 1/T арасындағы байланыс. а – эндотермиялық үдеріс, ә – экзотермиялық үдеріс. Реакцияның активтендіру энергиясының сандық мәнін есептеп те шығаруға болады. Ол үшін мына формуланы пайдаланамыз: 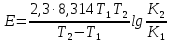 Активтендіру энергиясы химиялық реакциялар үшін 40-400 кДж/моль аралығында болады. Сонда, реакцияның жүру барысының энергетикалық өзгерістерін сызбанұсқамен беруге болады; оны реакцияның энергетикалық диаграммасы деп атайды: реакцияға қатысатын зат → химиялық белсенді кешен → реакция өнімі.  Химиялық белсенді кешен ----------------------------------------      Химиялық белсенді кешен E ---------------------------------- E EA        Реакция өнімі Бастапқы заттарΔH>0 ----------------------------     EA Бастапқы заттар ΔH UС ---------------- ---------------------------- Реакция өнімі     --------------------   ΔH<0     UD UA UB   a) реакция координатасы ә) реакция координатасы a) реакция координатасы ә) реакция координатасыСурет 6.3 Реакциялардың (A→B – Q, ΔH>0 (a) C → D+Q, ΔH<0 (ә) энергетикалық диаграммалары А – диаграммасы U(А) >U(В) болатындығын және а-реакциясының эндотермиялық, ә-реакциясында U(C) >U(В), олай болса ол - экзотермиялық екендігін көрсетеді. Химиялықтепе-теңдікті сан жағынан сипаттайтынкөрсеткіш тепе-теңдік константасы (тұрақтысы) (К) деп аталады: aA+bB=pP+qQ, мұндағы бас әріптер — заттардыңформулалары, кіші әріптер — реакциядағымолекула сандарын көрсететінкоэффициенттер. Тепе-теңдік константасытура және кері реакциялардың жылдамдықконстанталарының (k1,k2) қатынасы деп те аталады: K=k1/k2. К — белгілі температурада тура реакция өнімдері менреакциясы алынған заттардың мольдіккөбейтінділерінің қатынасын көрсететінтұрақты шама. Тепе-теңдікконстантасының теңдеуі реакцияғақатысқан заттардың тепе-теңдікконцентрацияларының бір-бірінетәуелділігін көрсетеді. Химиялық тепе-теңдікті зерттеудің теориялық жәнепрактикалық маңызы бар. Химиялық тепе-теңдік қайтымдыреакцияларда орнатылады -алға жәнеқарама-қарсы бағытта жүруі мүмкінреакцияларда. Егер aA + bB ↔ cC + dD) реакциясы қайтымды болса, бұл А және Вреагенттері C және D өнімдеріне (тікелейреакция) айналуға қабілетті, ал C және D өнімдері, өз кезегінде, бір-бірімен әрекеттесеалады дегенді білдіреді. А және В қайтаданбастапқы заттарды құрайды (кері реакция).  Қайтымды реакция aA + bB ↔ cC +dD үшін Kc өрнегі келесі түрде болады: Қайтымды реакция aA + bB ↔ cC +dD үшін Kc өрнегі келесі түрде болады:Кс = . Реакциялардың кинетикалықтеңдеулеріндегі сияқты тепе-теңдікконстанталарына арналған өрнектердеконденсацияланған күйдегі заттардыңконцентрациялары олардың тұрақтылығынабайланысты жазылмайды. |
