Навигация по странице:< 0).
|
Химическая кинетика и равновесие. Скоростью химической реакции
Скорость реакции определяется числом элементарных актов взаимодействия между частицами (молекулами) реагирующих веществ в единице объёма в единицу времени.
Практически, скоростью химической реакции называют изменение концентрации реагирующего вещества за единицу времени в единице реакционного пространства.
В гомогенной системе реакционным пространством служит объём сосуда, в котором протекает взаимодействие.
В химической кинетике различают среднюю и истинную (или мгновенную) скорость реакции. Средняя скорость равняется отношению изменения количества вещества в единице объёма, т. е. изменения концентрации, к промежутку времени, в течение которого оно произошло:
Δn 1 Δn ΔC
 υ = ± ⋅ ; = ΔC;υ = ± υ = ± ⋅ ; = ΔC;υ = ±  . (1) . (1)
V Δτ V Δτ
Истинная скорость реакции в данный момент выражается изменением концентрации, отнесенным к бесконечно малому промежутку времени, т.е. производной концентрации по времени:
dC
υ = ±  . (2) . (2)
dτ
Поскольку изменение концентрации может быть и положительной величиной (для продуктов реакции), и отрицательной (для исходных веществ), а скорость реакции должна быть величиной положительной, в выражениях (1) и (2) ставят перед дробью знак «+» или «–».
Скорость реакции зависит от природы реагирующих веществ, их концентрации, среды, в которой протекает реакция, температуры, наличия катализатора.
Зависимость скорости реакции от концентрации определяется законом действующих масс:
при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
В общем случае для реакции аА + вВ = сС + dD
υ= k[A]a[B]b, (3)
где k - константа скорости (удельная скорость) реакции. Она равна скорости реакции при условии, что концентрации реагирующих веществ или их произведение равняются единице. Константа скорости реакции зависит от всех факторов, влияющих на скорость реакции, за исключением концентрации реагирующих веществ. Поэтому константа скорости остается неизменной в течение реакции, является ее фундаментальным кинетическим параметром.
В гетерогенной системе реакция осуществляется на поверхности раздела фаз. Поверхность раздела фаз является в этом случае реакционным пространством. Поэтому концентрация газообразных и жидких веществ, участвующих во взаимодействии, измеряется количеством этих веществ, приходящихся на единицу реакционной поверхности, и называется поверхностной концентрацией Cs.
 
Скорость гетерогенной реакции - средняя υ−=±ΔСs или истинная υ=±dСs
Δτ dτ
- измеряется изменением поверхностной концентрации одного из веществ (газа или жидкости), участвующих в реакции, за единицу времени. Концентрация компонента, находящегося в твердой фазе, постоянна. Значение этой постоянной включается в величину k. Зависимость скорости гетерогенной реакции от поверхностной концентрации реагентов определяется законом действующих масс. Так, например, зависимость скорости процесса
Zn(кр) +O2(г) = ZnO(кр)
при постоянной температуре от поверхностной концентрации О2
имеет вид υ=kCs(O2), где k = k׳·S (S – площадь поверхности цинка).
В тех случаях, когда измерение поверхностной концентрации затруднено, скорость гетерогенного процесса вычисляют, используя вместо поверхностной концентрации объёмную концентрацию. Например, скорость реакции Zn(кр) + O2(г) = ZnO(кр) рассчитывают по уравнению υ = k[O2] .
Зависимость скорости реакции от температуры
С повышением температуры скорость реакции резко увеличивается. Зависимость скорости реакции от температуры приближенно описывается эмпирическим правилом Вант-Гоффа:
при повышении температуры на каждые 10 скорость реакции увеличивается в 2-4 раза.
Величина, которая показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10°, называется температурным коэффициентом скорости реакции γ .
γ=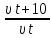
. (4)
Поскольку при концентрациях реагирующих веществ I моль/л скорость химической реакции численно равна константе скорости k, то
γ=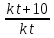 (5) (5)
Энергия активации – это минимальная энергия взаимодействующих частиц, уровень которой достаточен для того, чтобы все частицы вступили в химическую реакцию. Энергия активации реакции характеризует энергетический барьер, преодоление которого реагирующими частицами приводит к образованию конечных веществ. Энергия активации процесса зависит только от природы реагирующих веществ. Значения энергии активации для химических реакций могут составлять от 40 до 200 кДж/моль.
Предэкспоненциальный множитель А равен произведению стерического фактора Р на общее число соударений молекул Z реагирующих веществ в единице объема за единицу времени.
А = Р · Z
Стерический фактор учитывает число благоприятных способов ориентации молекул по отношению к общему числу способов их возможной взаимной ориентации. Значения Р обычно лежат в пределах от 10-9 до 1.
Из уравнения (8) следует, что при Еа=0 k=A. Предэкспоненциальный множитель можно рассматривать как зкстраполяционное значение константы скорости реакции, когда все молекулы реакционноспособны, т.е. все их соударения эффективны. В реальных условиях, когда Еа > 0, не все соударения являются эффективными. Более того, их доля от общего числа соударений, как правило, незначительна. Доля эффективных соударений
Еа − определяется экспоненциальным множителем е RT .
Зависимость скорости реакции от катализатора
Скорость химической реакции может резко изменяться в присутствии катализатора. Катализаторами называются вещества, которые резко увеличивают скорость реакции или вызывают реакцию, если она не протекает, но принципиально осуществима
(∆Gреакц.< 0).
В ходе каталитической реакции катализатор остается химически неизменным, а его количество - постоянным.
Ускорение реакций в гомогенном катализе (реагирующие вещества и катализатор находятся в одной фазе) объясняется образованием промежуточных соединений. Если реакция А + В = АВ требует энергии активации Еа и без катализатора идёт медленно, то введением катализатора можно повести процесс через промежуточное соединение: в две стадии, протекающие с меньшими энергиями активации (рис.1.1).
1-я стадия: А + К = АК;
2-я стадия: АК + B= AB + K K-катализатор; АК- промежуточное соединение.
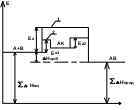
Путь процесса
Рисунок 1.1 – Энергетическая диаграмма экзотермической реакции:
1 - некатализируемая реакция; 2 - катализируемая реакция; Еа - энергия активации некатализируемой реакции; Ea1 и Еа2 - энергии активации 1-й и 2-й стадии катализируемой реакции
В гетерогенном катализе (катализатор находится в системе в виде самостоятельной фазы) процессы отличаются многостадийностью. Например, реакцию
СО + H2O←⎯ →Fe,Fe⎯3⎯O4 CО2 + Н2,
протекающую на железо-оксидном катализаторе, можно разделить на,
следующие стадии:
диффузия молекул СО и Н2О к поверхности катализатора;
адсорбция молекул СО и H2O на поверхности катализатора;
химическое взаимодействие молекул СО и Н2О, адсорбированных на поверхности катализатора;
диффузия молекул С02 и H2 от поверхности катализатора.
Отмечено, что каталитические процессы протекают только на отдельных участках поверхности катализатора - активных центрах. На активных центрах, как и в случае гомогенного катализа, образуются промежуточные (поверхностные) соединения. Поэтому состояние поверхности катализатора играет важную роль. Активность катализатора тем выше, чем больше его удельная поверхность и чем больше число дефектов строения кристаллов.
Химическое равновесие. Смещение равновесия
Химические реакции по степени завершенности химического процесса классифицируются на обратимые и необратимые. Большинство реакций являются обратимыми, т.е. они протекают в противоположных направлениях и не идут до конца, так как продукты реакции, взаимодействуя между собой, вновь образуют исходные вещества.
Состояние обратимого процесса, при котором скорости прямой и обратной реакции равны, называется химическим равновесием (рис. 2).
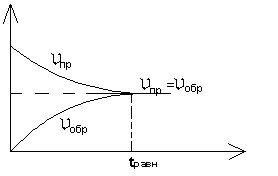
Рисунок 2 – Изменение скорости прямой и обратной реакции во времени
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются разновесными концентрациями. В основе химического равновесия лежит равенство скоростей прямой и обратной реакций.
Константа химического равновесия обратимого процесса равна отношению произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении химической реакции. Константа равновесия так же, как и константы скоростей kпр. и kобр., зависит от природы реагентов, температуры и не зависит от исходных концентраций веществ в системе.
Если обратимая реакция протекает в гетерогенной системе, например
Fe2O3(кр) + 3CO(г) ↔ 2Fe(кр) + 3СО2(г)
Химическое равновесие остаётся неизменным до тех пор, пока не изменяются условия (концентрации реагирующих веществ, температура, давление), при которых оно существует. Изменяя условия, можно сместить равновесие.
Смещение химического равновесия при изменении условий определяется принципом Ле Шателье:
Если на систему, находящуюся в равновесии, оказано внешнее воздействие (изменено какое-либо условие существования равновесия), то равновесие смещается в таком направлении, чтобы оказанное воздействие было ослаблено.
Например, в равновесной системе:
СаСО3(к) ↔ СаО(к) + СО2(г); ∆Н0=178 кДж
равновесие может быть смещено вправо:
а) повышением температуры - подводимое количество теплоты будет расходоваться на разложение карбоната кальция; б) понижением давления (по сравнению с равновесным) – оказанное воздействие будет ослаблено образованием новых количеств газообразного продукта СО2; в) уменьшением концентрации СО2 (отводом его из зоны реакции). |
|
|
 Скачать 45.14 Kb.
Скачать 45.14 Kb. υ = ± ⋅ ; = ΔC;υ = ±
υ = ± ⋅ ; = ΔC;υ = ±  . (1)
. (1)  . (2)
. (2) 


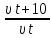
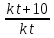 (5)
(5) 
