Составить схему гальванического элемента с марганцевым и железным электродами, погруженными в 0,025 М раствор МnSО4 и 0,0015 М р. Составить схему гальванического элемент. Составить схему гальванического элемента с марганцевым и железным электродами, погруженными в 0,025 м раствор МnSО4
 Скачать 17.29 Kb. Скачать 17.29 Kb.
|
|
Составить схему гальванического элемента с марганцевым и железным электродами, погруженными в 0,025 М раствор МnSО4 и 0,0015 М раствор FеСl3 соответственно. Написать уравнения электродных процессов и вычислить ЭДС элемента. Стандартный потенциал электродов равен: Е0(Mn2+/Mn) = -1,185 В ; Е0(Fe3+/Fe) = -0,425 В Поскольку марганцевый электрод имеет меньший потенциал, он будет являться анодом, а железный – катодом. Схема гальванического элемента: Анод (-) Мn │ МnSО4 (0,025 М) ║ FеСl3 (0,0015 М) │ Fe (+) Катод В процессе действия рассматриваемого гальванического элемента электроны во внешней цепи движутся от анода к катоду, т.е от марганцевого электрода к железному. На марганцевом электроде протекает реакция: Mn0 – 2е = Mn2+ На железном электроде протекает реакция: Fe3+ + 3е = Fe0 Суммарная реакция в элементе описывается уравнением: 2Fe3+ + 3Mn0 = 2Fe0 + 3Mn2+ Рассчитаем электродный потенциал марганца при заданной концентрации по уравнению Нернста: Е(Mn2+/Mn) = Е0(Mn2+/Mn) + 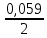 lg 0,025 = -1,185 – 0,047 = -1,232 В lg 0,025 = -1,185 – 0,047 = -1,232 ВПотенциал железного электрода по уравнению Нернста равен: Е(Fe3+/Fe) = Е0(Fe3+/Fe) + 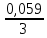 lg 0,0015 = -0,425 – 0,056 = -0,481 В lg 0,0015 = -0,425 – 0,056 = -0,481 ВВычислим ЭДС элемента: ЭДС = Ек – Еа = -0,481 – (-1,232) = 0,751 В |
