реферват. Современное представление об электронном строении атома. Квантовые числа и атомные орбитали
 Скачать 254.5 Kb. Скачать 254.5 Kb.
|
Ангарский Государственный Технологический Университет Реферат на тему: «Современное представление об электронном строении атома. Квантовые числа и атомные орбитали» Выполнил: студент 1 курса группы ТБз-21 Морозов А.Л Проверил: Иванова И.И. г. Ангарск 2021 Содержание: 1.Современные представления о строении атомов……..3 2.Корпускулярно-волновой дуализм электрона ………..5 3.Уравнение Шрёдингера. Волновая функция …………9 4.Квантовые числа электрона в атоме ………………..10 5.Принципы заполнения атомных орбиталей ………….15 1. Современные представления о строении атомов. Современные представления о строении атома зародились вначале нашего столетия в результате исследования природы катодных лучей (Дж.Томсон 1897), открытия радиоактивности (А.Беккерель, М.Склодовская- Кюри, П.Кюри 1896-1899), расшифровки спектров излучения раскалённых тел, а также опытов Э.Резерфорда (1911) по исследованию прохождения α-частиц через металлическую фольгу. Долгое время атом считался неделимым. Во второй половине 19 века появились высказывания о сложном строении атома. Открытие радиоактивности химических элементов (α-, β-, и γ-лучей) показало, что наряду с электронами атомы содержит материю, несущую положительный заряд. Первая гипотеза строения атома предложена английским учёным Томсоном (1904) так называемая статическая или электронно-ионная теория, согласно которой атом состоит из положительно заряженной сферы, в которую вкраплены отрицательные электроны (можно для простоты представить пудинг с изюмом, где вся масса заряжена положительно, а изюминки − это электроны). Для проверки гипотезы Томсона и более точного определения внутреннего строения атома, Резерфорд (1911) провёл серию опытов по рассеиванию α-частиц тонкими металлическими пластинами. При ударе об экран, покрытый слоем сульфида цинка ZnS, α-частицы вызывают вспышку, что позволяет вести подсчёт α- частиц. Оказалось, что небольшая часть α- частиц, проходя через металлическую пластинку, отклоняется от своего пути на различные углы, а отдельные частицы резко меняют направление полёта. Это явление известно под названием рассеяние α- частиц. 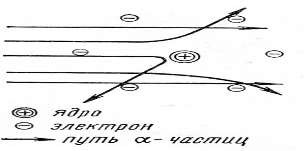 Резерфорд объяснил рассеяние α- частиц, предложив ядерную, планетарную модель строения атома, согласно которой атом состоит из положительно заряженного ядра, очень малого по размерам. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома. Аналогично движению планет солнечной системы (отсюда название модели − планетарная). Эта модель отражала истину в том, что основная масса атома содержится в малой части объёма − ядре, а в остальной части распределены электроны. Но характер движения электрона по орбите вокруг ядра атома противоречит законам электродинамики, по которым в результате потери энергии на излучение электрон должен упасть на ядро, и спектр излучения атомов должен быть сплошным. Датский физик Н.Бор в 1913 году внёс в планетарную модель атома Резерфорда квантовые представления и объяснил происхождение линейчатых спектров атомов, сформулировав 2 постулата. Основываясь на положении квантовой теории света о прерывистой, дискретной природе излучения сделал вывод, что энергия электронов в атоме не может меняться непрерывно, а изменяется скачками, т.е. дискретно. Иначе говоря, энергетические состояния электронов в атоме квантованы. 2. Корпускулярно-волновой дуализм электрона. Следующим этапом в становлении квантовой теории строения атома явилось обоснование двойственной природы электрона. В 1924 году французский физик Луи де Бройль предположил, что двойственная, корпускулярно-волновая природа свойственна не только фотонам, но и любым другим материальным телам. Применительно к электрону, можно сказать, что как и другие микрочастицы он обладает корпускулярно-волновым дуализмом, т.е. двойственностью. Понятие корпускулы, т.е. частицы, введено Ломоносовым, а электрон как частица обладает массой (9,1∙10-31 кг) и зарядом. Электрону как волне присущи волновые явления дифракции. Математический дуализм волна-частица выражается 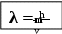 уравнением Луи де Бройля: где λ − длина волны – постоянная Планка (6,63·10-34 Дж/с) m − масса частицы − скорость частицы Уравнение легко выводится, если в уравнение Планка E = h· υ (υ - частота) подставить значение E из уравнения Эйнштейна Е = m · с2 m · c2 = h · υ  υ = с υ = сλ  m · c2 = h · с m · c2 = h · сλ  m · c2 = ℎ m · c2 = ℎλ  λ = h ·с, m λ = h ·с, mзаменив с – (скорость фотона) на скорость любой микрочастицы v, получим:  λ = 𝐡 · v λ = 𝐡 · v𝐦 Электрон, обладающий свойствами волны, может находиться в любой части пространства, окружающего ядро, т.е. он как бы «размазан» вокруг ядра атома в виде электронного облака. Из волновых свойств микрообъектов вытекает очень важный вывод: Принцип неопределённости Гейзенберга (1927): невозможно одновременно точно измерить скорость и положение (координаты) электрона. В классической физике, изучающей движение макрочастиц предполагается, что координату X и скоростьV частицы можно определить с любой точностью, т.е. погрешности ΔX и ΔV могут быть сколь угодно малы. В квантовой физике В.Гейзенберг (1927) установил, что для частиц микромира это неверно. Координаты и скорость всегда имеют погрешности определения. Погрешности определения координаты ΔX и составляющей скорости вдоль оси ΔX·ΔVx связаны соотношением Гейзенберга  Где x и р = ΔVx · m — неопределенности в измерении координаты и импульса. Это значит, что координаты и скорость для микрочастиц обладают некоторыми неопределённостями, они как бы размяты. Принцип неопределённости означает, что движение микрочастиц нельзя характеризовать траекторией как точной линией, а движение электрона нельзя рассматривать как движение точечного заряда (пули) по определённой замкнутой траектории-орбите. Для тел атомного масштаба нельзя указать одновременно их точное положение в пространстве и направление движения. Можно указать только вероятность нахождения электрона в определенном положении в любой момент времени. Электронное облако − это квантовомеханическая модель электрона в атоме. Схема строения атома водорода 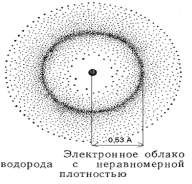 Плотность электронного облака неравномерна, максимальная плотность отвечает наибольшей вероятности пребывания электрона в данной части атомного пространства. Максимальная электронная плотность на расстоянии 0,53А (0,053нм), т.е. здесь наиболее вероятно нахождение движущегося электрона. По современным представлениям, ядро атома водорода окружено электронным облаком, т.е. электрон находится на атомной орбитали (АО). Орбиталь − это та часть пространства атома, где наиболее вероятно нахождение электрона в атоме. Строение ядра Атом − электронейтральная микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Ядра атомов состоят из 2-х типов частиц - протонов и нейтронов (нуклонов).
Линейный размер атома 10-8 см, ядра 10-12 — 10-13 см Основная масса атома сосредоточена в ядре и характеризуется массовым числом А, равным сумме чисел протонов (заряд ядра) Z и нейтронов N A = Z + N K 19 Заряд ядра определяет число электронов, находящихся вокруг ядра, совпадает с порядковым номером (атомным номером). В обозначении элемента указывают массовое Z число и количество протонов, АЭ , например 40 Изотопы − атомы с одинаковыми значениями Z, но различными А и N, например 16O , 17O , 18O K, Изобары − атомы с одинаковыми значениями А, но различными Z и N, например 40 Ar, 40 40Ca . 18 20 19 Устойчивому состоянию ядер атомов соответствует  определённые соотношения AZ≈ 2 для лёгких элементов, определённые соотношения AZ≈ 2 для лёгких элементов,≈ 2,6 для тяжёлых. При нарушении устойчивого протонно-нейтронного соотношения ядро (а вместе с ним и атом) становится радиоактивным.Радиоактивностью называется самопроизвольное превращение неустойчивых ядер в другие ядра, сопровождающееся испусканием различных частиц, например, α –распад 8 8 . 210 Po 206Pb 4He ( α – частица) 84 82 2 3. Уравнение Шрёдингера. Волновая функция. В квантовой механике поведение микрочастиц описывается волновым уравнением Шрёдингера, являющимся математической записью основного закона их движения. Австрийский учёный Эрвин Шрёдингер в уравнение стоячей волны подставил вместо длины волны её значение из уравнения Луи де Бройля и получил уравнение волнового движения, связывающее энергию электрона с пространственными координатами и переменной величиной ψ (пси) − волновой функцией. 2 2 2ψ 2Ψ 2ψ 8π2 me dx 2 dy dz h2 E U ψ 0 ψ = f (x,y,z) где, m – масса электрона h постоянная Планка Е – полная энергия электрона U – потенциальная энергия электрона Уравнение Шрёдингера описывает состояние электрона в атоме. Из уравнения следует, что изменение волновой функции ψ зависит от полной энергии E, от потенциальной энергии U и от координат (x,y,z). Волновую функцию, или амплитуду, электронной волны, называют также орбиталью. Величина ψ может как и амплитуда любого волнового процесса иметь знак + и −, т.е. находиться на положительной и отрицательной оси. Но ψ 2 всегда положительная. Физический смысл ψ выражает вероятность нахождения электрона в данном месте пространства, причём вероятность характеризуют квадратом этой функции, поскольку вероятность не может быть отрицательной величиной. Т.е. орбиталь это ψ − функция электрона. ψ равна нулю там, где электрон не может находиться. Изучение атомных спектров и химических свойств элементов показало, что электроны в атоме распределяются по энергетическим уровням (энергетическое состояние электрона характеризуется квантовыми числами). 4. Квантовые числа электрона в атоме. Существуя в трёхмерном пространстве, электрон имеет 3 степени свободы. Решая уравнение Шрёдингера современная квантовая химия определяет 3 квантовых числа, характеризующие состояние электрона в атоме, которые изменяются целочисленно, т.е. квантуются. (Квант − наименьшая, неделимая порция энергии). Их значения указывают местонахождение электрона в атоме − его наиболее вероятный «адрес». 3 квантовых числа вычислены для атома водорода при решении уравнения Шрёдингера. Главное n Орбитальное ℓ Магнитное mℓ 1.Главное квантовое число n характеризует энергетический уровень, или общий запас энергии электрона, а также размеры электронного облака. Для реально существующих атомов n может иметь значения целых чисел от 1 до 7, соответственно номеру периода, в котором находится элемент,
соответствующие энергетические уровни (электронные слои) обозначаются большими буквами латинского алфавита. С увеличением n возрастают энергия электрона и размер электронного облака. 2.Орбитальное или побочное квантовое число ℓ характеризует энергетический подуровень и форму электронного облака. В пределах уровня электроны распределяются по подуровням. Значения ℓ связаны со значением n и принимают число значений, равное n. ℓ изменяется от 0 до n-1 Например, при n=4, ℓ может иметь 4 значения 0, 1 ,2 и 3, т.е. этот уровень состоит из 4-х подуровней. Используя обозначения, принятые в спектроскопии подуровни обозначают малыми буквами латинского алфавита.
Число подуровней равно номеру уровня (n) Схема подразделения энергетических уровней на подуровни 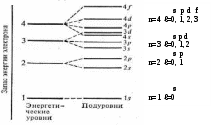 Согласно квантово-механическим расчётам s-орбитали имеют форму шара  p-орбитали имеют форму гантели  f-, и d-орбитали более сложные формы розетки. Магнитное квантовое число ml определяет ориентацию электронного облака в пространстве, связано с орбитальным квантовым числом и может принимать целочисленные значения от –l до +l через 0. Для s -подуровня ℓ= 0, ml = 0, поэтому для s-орбитали один вариант расположения в пространстве. Для p-подуровня ℓ = 1, ml = -1, 0, +1, т.е. соответствуют три значения ml, три орбитали взаимно перпендикулярные, т.к. координированы вдоль осей x, y, z. Такие орбитали обозначаются px, py, pz. Облакам d электронов (ℓ = 2), соответствует 5 значений магнитного квантового числа ml = –2, –1, 0, +1, +2. f-электронам (ℓ = 3) соответствуют 7 значений магнитного квантового числа ml = –3, –2, –1, 0, +1, +2, +3. Имеет место, соответственно, 5 и 7 различных ориентаций f-, и d-орбиталей в пространстве.  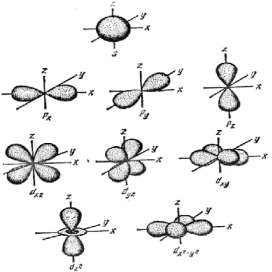 Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси. Может  принимать всего 2 начения + 1 принимать всего 2 начения + 12 как и остальные квантовые числа, на единицу.  Если спин равен + 1, то электрон вращается по часовой и – 1, которые отличаются, Если спин равен + 1, то электрон вращается по часовой и – 1, которые отличаются,  стрелке, если – 12,то противчасовой стрелки, (в2графических формулах клетка –орбиталь, стрелка –электрон) стрелке, если – 12,то противчасовой стрелки, (в2графических формулах клетка –орбиталь, стрелка –электрон)  ms = +1/2 ms = +1/2 Таким образом, состояние электрона в атоме может быть описано с помощью 4-х квантовых чисел n, ℓ, ml, ms. Они характеризуют спин, энергию электрона, объём и форму пространства, в котором вероятно его пребывание около ядра. При переходе атома из одного квантового состояния в другое, в связи с чем меняются значения квантовых чисел, происходит перестройка электронного облака. При этом атом поглощает или испускает квант энергии. 5. Принципы заполнения атомных орбиталей. Распределение электронов в атоме, находящемся в основном состоянии определяется зарядом ядра. При этом электроны размещаются согласно принципу наименьшей энергии. Наиболее устойчивое состояние электрона в атоме соответствует минимально возможному значению его энергии. Конкретная реализация этого принципа отражается с помощью принципа Паули и правила Хунда, а также правила Клечковского. Распределение электронов по энергетическим уровням и подуровням изображают в виде электронных формул и энергетических ячеек так называемых графических электронных формул. По принципу наименьшей энергии каждый электрон в атоме занимает свободную орбиталь с наиболее низкой энергией. С ростом порядкового номера элемента электроны заполняют орбитали и уровни в порядке возрастания их энергии: уровни заполняются от 1 до 7, а подуровни в последовательности s, p, d, f. Опытным путём определена последовательность возрастания энергии − так называемая шкала энергии. Эта шкала имеет вид, где вертикальными линейками отделены периоды.
Электронная формула водорода 1s1. В графических электронных формулах каждая ячейка обозначается клеткой, клетка − орбиталь, стрелка − электрон, направление стрелки − направление спина, свободная клетка − свободная орбиталь. Заполнение электронами орбиталей происходит в соответствии с принципом Паули и правилом Хунда. Принцип исключения Паули − в атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел. Это значит, что на орбитали не может быть более двух электронов. Два электрона, находящиеся на одной орбитали, отличаются друг от друга значениями спинового квантового числа, т.е. они имеют одинаковые значения n, ℓ, ml, но противоположно направлены или имеют антипараллельные спины, обозначаются противоположно направленными стрелками ↑↓ и называются спаренными. Неспаренные электроны изображаются одной стрелкой ↑, они являются валентными. Валентность − способность одного атома элемента присоединять определённое число электронов и определяется числом неспаренных электронов. Распределение электронов по нескольким ячейкам одного подуровня происходит в соответствии с правилом Хунда: в пределах подуровня электроны заполняют наибольшее число орбиталей, в связи с чем сумма их спиновых чисел должна быть максимальной. В электронных формулах число впереди − номер энергетического уровня, буквой выражается подуровень (тип орбитали), индекс справа вверху − число электронов на подуровне. В качестве примера рассмотрим распределение электронов в атомах элементов второго периода. 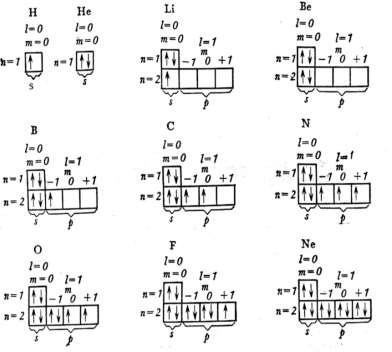 Принцип Паули позволяет рассчитать ёмкость электронных уровней и подуровней. На N-ом уровне может разместиться столько электронов, сколько возможно сочетаний из ℓ, ml, ms . Ёмкость энергетического уровня (число электронов в уровне) легко определить по формуле Nn = 2n2 N1 = 2 N2 = 2·4 =8 N3 = 2·9 =18 N4 =2·16 =  Число электронов в подуровнена подуровнях s ℓ = 0 Число электронов в подуровнена подуровнях s ℓ = 0Ns = 2 (2·0+1 ) = 2 p ℓ = 1 Np = 2 (2·1+1) = 6 d ℓ = 2 Nd = 2 (2·2+1) = 10 f ℓ = 3 Nf = 2 (2·3+1) = 14 Общее число состояний (квантовых ячеек или орбиталей) в уровне равно n2 : I – 1, II – 4, III – 9, IV – 16 Порядок заполнения АО электронами определяется также правилом Клечковского, которое учитывает зависимость энергии орбитали от значений главного (n) и орбитального (ℓ) квантовых чисел: АО заполняются электронами в порядке последовательного увеличения суммы n + l, а при одинаковых значениях этой суммы − в порядке последовательного возрастания главного квантового числа n.
Так, орбиталь 1s энергетически более выгодна, чем орбиталь 2s, и поэтому электронами заполняется раньше.4s орбиталь заполняется раньше 3d, так как сумма n + ℓ у нее меньше При написании электронных формул следует учитывать так называемый «проскок электрона» из ns подуровня на (n-1) d. Так, электронная формула меди должна быть 1s22s22p63s23p63d94s2, однако на внешнем уровне у атома меди не 2 электрона, а один − второй электрон «провалился» на d-подуровень второго снаружи уровня, т.е. на (n - 1) d -подуровень. Расположение электронов у 28Сu 1s22s22p63s23p63d104s1. Провал электронов наблюдается у следующих 10 элементов: Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, Рd, Pt. Исключение составляет палладий − у него 2s-электрона провалились на соседний уровень. Провал электронов энергетически более выгоден, т.к. образуются более устойчивые электронные конфигурации (p0 , p3 , p6 ; d0, d5 , d10). Состояние атома с полностью или наполовину заполненным подуровнем (т.е. когда на каждой орбитали имеется по одному электрону) является более устойчивым. Для атома углерода электроны разместятся по уровням и подуровням следующим образом, что соответствуют нормальному состоянию атома, т.е. минимальному значению энергии. 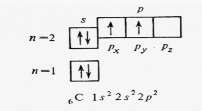 Однако при затрате сравнительно незначительной энергии возможен перевод электронов в пределах одного и того же уровня, с одного подуровня на другой, энергетически более высокий. Углерод переходит в возбуждённое состояние, что сопровождается разъединением спаренных электронов, т.е. распадом двухэлектронных облаков на одноэлектронные. Такой процесс называют промотированием. Такое состояние атома, в котором при незаполненном нижнем подуровне имеются электроны на более высоком подуровне, называется возбуждённым. 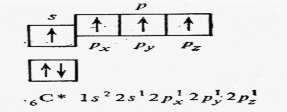 В нормальном состоянии углерод двухвалентен, в возбуждённом − четырёхвалентен. В нормальном состоянии углерод двухвалентен, в возбуждённом − четырёхвалентен.Бериллий в нормальном состоянии нульвалентен, только при возбуждении атома бериллия, связанного с затратой энергии (Ве + 324 кДж/моль → Ве*) 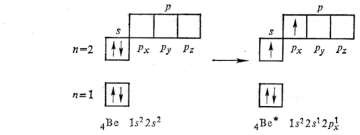 происходит разделение электронной пары, и он становится способным проявлять валентность, равную 2. происходит разделение электронной пары, и он становится способным проявлять валентность, равную 2.Заключение. По современным представлениям атом состоит из положительно заряженного ядра, очень малого по размерам, вокруг которого вращаются электроны. Масса атома сосредоточена в ядре, электрон в атоме обладает двойственными, корпускулярно-волновыми свойствами частицы и волны. Электрон может находиться в любой части пространства и образует электронное облако. Часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая ( 90%), называется орбиталью. Каждому электронному слою соответствует определенный уровень энергии находящихся на нем электронов, поэтому электронные слои называются еще энергетическими уровнями. Число энергетических уровней в атоме химического элемента равно номеру периода, в котором этот элемент расположен. Уровень, на котором находится максимально возможное число электронов, называется завершенным. Завершение внешнего уровня наступает при 8 электронах. Число подуровней, на которые расщепляется данный энергетический уровень, равно числу значений орбитального квантового числа ℓ, соответствующих значению главного квантового числа n, характеризующему этот уровень. Каждому электрону в атоме соответствует набор четырех квантовых чисел, которые определяют место нахождения электрона в атоме: уровень ( n ), подуровень (ℓ ), ориентацию облака в пространстве ( ml ), собственное вращение электрона вокруг своей оси ( ms ). Атомные орбитали заполняются по уровням и подуровням согласно принципу наименьшей энергии, запрету Паули, правилу Хунда, правилу Клечковского. Список литературы 1. Алексеев И. С. Развитие представлений о структуре атома. – М.: Наука, 2000. 2. Бочкарев А. И. Бочкарева Т.С, Саксонов С.В. Концепции современного естествознания. - М.: Наука, 2008. 3. Горбачев В. В. Концепции современного естествознания, - М.: Альфа-М, 2003. 4. Коренев Ю. М. Общая и неорганическая химия, в 3-х частях. М.: «Издательство Московского университета», 2002. 5. Кудрявцев Л. С. Курс истории физики. – М.: Наука, 2006. 6. Карпенков С. Х. Концепции современного естествознания. Учебник для вузов. – М.: Академический Проект, 2000. 7. Трофимова Т. И. Курс физики: учебное пособие. - М.: Высшая школа, 2007. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
