Создание новых лекарственных средств
 Скачать 26.19 Kb. Скачать 26.19 Kb.
|
|
Разработчик: Т.В. Семенова Курс: Фармакология Тема: Создание новых лекарственных средств Вы являетесь участником актива учебной группы по художественному оформлению. Преподаватель по Фармакологии попросила вас подготовить плакат, наглядно представляющий порядок внедрения в медицинскую практику новых лекарственных средств. Прочитайте источник. Составьте эскиз плаката, самостоятельно выбрав способ структурирования информации.
Изыскание новых лекарственных средств и пути внедрения их в медицинскую практику Первым шагом в процессе разработки новых лекарственных средств является получение химического соединения, обладающего заданным фармакологическим действием. Получить химическое соединение, обладающее заданным фармакологическим действием можно двумя способами: А. Целенаправленный поиск, когда заказчик, (государство или какая-то фирма) дает задание химической лаборатории на химический синтез лекарственного средства с определенным фармакологическим действием. К методам целенаправленного поиска относят: 1. Фармакологический скрининг - это метод поиска веществ с определенным типом фармакологической активности среди множества химических соединений, синтезированных химиками по специальному заказу. Проведение скрининга - чрезвычайно трудоемкий и затратный процесс: для обнаружения одного лекарственного средства исследователю приходится тестировать несколько сотен или тысяч соединений. 2. Молекулярное конструирование лекарств. Использование компьютерных технологий позволили получать трехмерные изображения активных центров рецепторов и ферментов и подбирать к ним молекулы, конфигурация которых точно соответствует их форме. Методом молекулярного конструирования были получены ингибиторы нейраминидазы - новая группа противовирусных препаратов. Однако, по своей экономической стоимости, данный метод не уступает скринингу. Б. Эмпирический путь - случайные находки. Примеры случайных находок: 1. Синтезировали какое-то одно вещество, а оказалось, что оно обладает лечебными свойствами. Так было выявлено противомикробное действие азокрасителя - красного стрептоцида, в результате чего появилась целая группа химиотерапевтических средств - сульфаниламиды. 2. В результате спешки английский ученый Флеминг в Рождество оставил не вымытыми чашки Петри с микробной культурой, а когда пришел после праздника, обнаружил, что появилась какая-то новая плесень, а колония микробов вокруг нее исчезла. Так был открыт антибиотик пенициллин. В итоге получают химическое соединение с определенным фармакологическим действием. Каждое такое средство до применения в практической медицине, должно пройти определенную процедуру изучения и регистрации, которая гарантировала бы, с одной стороны эффективность при лечении какой-то патологии, а с другой стороны – безопасность применения этого средства. Таким образом, следующим шагом разработки лекарственного средства являются доклинические испытания. Доклинические испытания проводят в фармакологической лаборатории на животных. Исследуют: механизм действия, фармакологические эффекты, токсичность, тератогенное действие, мутагенное действие. Срок таких испытаний длится до 4 лет. После завершения испытаний, материалы передаются для экспертизы в Фармакологический комитет - экспертный орган МЗ РФ. Далее Фармакологический комитет санкционирует проведение клинических испытаний. На этом этапе испытания проводятся на людях-добровольцах, и длятся в среднем 8-9 лет. Цель клинических испытаний выявить: является ли полученное химическое вещество безопасным для человека; оказывает ли это вещество фармакологически активное действие на организм человека; является ли это вещество эффективным при лечении какого-либо заболевания. На завершающем этапе разработки новых лекарственных средств, все полученные результаты вновь направляют в Фармакологический комитет, который решает, давать ли разрешение на дальнейшее использование этого лекарственного средства. При положительной экспертизе на лекарственное средство выдается регистрационное удостоверение, лекарственное средство регистрируют в «Государственном реестре лекарственных средств, разрешенных к применению на территории РФ», что является пропуском к запуску данного лекарственного средства в производство и дальнейшей реализации его через аптечную сеть. Использованы материалы источника: Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 04.06.2018) «Об обращении лекарственных средств» «Регистрация лекарственных средств в России», Фармацевтический Вестник, №18 от 16.05.13. Инструмент проверки 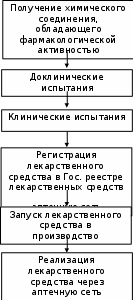
|
