как. Химиялекция1. Степень окисления и составление химических формул
 Скачать 59.47 Kb. Скачать 59.47 Kb.
|
|
Добрый день! Мы начинаем с вами изучение курса химии. Курс будет небольшой, всего 26 часов. Итак, вспоминаем, что такое химия.  СТЕПЕНЬ ОКИСЛЕНИЯ И СОСТАВЛЕНИЕ ХИМИЧЕСКИХ ФОРМУЛ Состав химических соединений выражают химическими формулами, при составлении которых используется характеристика состояния элемента в соединении – степень окисления (с. о.).
Степень окисления при необходимости указывают над символом элемента в формуле или римской цифрой в названии вещества. Для расчета степеней окисления элементов используют следующие правила: степень окисления элемента в простом веществе равна нулю 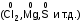 ; ;степень окисления кислорода в большинстве сложных веществ равна -2 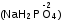 ; ;степень окисления водорода и щелочных металлов в большинстве сложных веществ равна +1 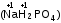 ; ;алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю, в ионе – его заряду. Пример. Рассчитайте степени окисления элементов в соединениях: а) NH3; б) P2O5; в) NH4NO3. Решение а) с. о. водорода равна +1. С. о. азота рассчитываем, приравнивая алгебраическую сумму с. о. атомов, образующих данную молекулу, нулю. Сумма с.о. атома азота (x) и трех атомов водорода 3(+1) x + 3(+1) = 0, откуда x = 3. 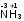 ; ;б) с.о. кислорода равна 2. Аналогично предыдущему составляем выражение алгебраической суммы с.о. двух атомов фосфора (2х) и пяти атомов кислорода: 2х + 5(-2) = 0, откуда х = +5. 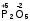 ; ;в) большинство элементов в соединениях проявляют несколько различных степеней окисления. Рассчитать степени окисления атомов азота в соединении NH4NO3 можно, разделив эту соль на ионы NH4+ и NO3. Далее для каждого иона составляем выражение суммы степеней окисления, включая неизвестную степень окисления атома азота х, и приравниваем его заряду иона. Для иона NH4+: х + 4 (+1) = +1, х = 3; для иона NO3: х + 3(2) = 1, х = +5. Формула нитрата аммония с указанием с. о. азота: 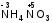 . .КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Химические вещества могут быть простыми и сложными. Среди простых веществ выделяют металлы и неметаллы (см. далее). Граница между металлами и неметаллами размыта, выделенные элементы проявляют двойственность свойств.
La* – первый элемент семейства лантаноидов (14 лантаноидов), Ас** – первый элемент семейства актиноидов (14 актиноидов). Сложные неорганические соединения делят на три основных класса – оксиды, гидроксиды и соли. Оксиды
Если элементы проявляют переменную с.о., то образуют оксиды различного состава, что учитывают в названии оксида указанием с.о. элемента. Если элемент образует один оксид, то в названии оксида с.о. не указывают. Например, Al2O3 – оксид алюминия (алюминий проявляет единственную с. о., равную +3); N2O3 – оксид азота (III) (азот проявляет различные с. о., в данном оксиде с. о. азота равна +3).
Несолеобразующиеоксиды весьма немногочисленны – например CO, NO, N2O.
Основные оксиды образуют только типичные металлы в степени окисления +1, +2 (не всегда), +3 (редко). Кислотные оксидыобразуют неметаллы, а также металлы в высоких степенях окисления (+6, +7). Оксиды неметаллов ‑ SO2,P2O5, оксиды металлов – 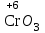 , , 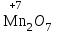 . .Амфотерные оксидыобразуют металлы в степени окисления +3, +4, +5, иногда +2, а также элементы, расположенные вблизи условной диагонали, разделяющей металлы и неметаллы (As ‑ As2O3, Sb ‑ Sb2O3). Амфотерные оксиды некоторых металлов в степени окисления +2 –ZnO, PbO, SnO, BeO – полезно запомнить. Амфотерные оксиды сочетают свойства основных и кислотных оксидов. Химические свойства оксидов Отношение к воде Из основных оксидов с водой реагируют только оксиды щелочных (IА подгруппа) и щелочноземельных (IIА подгруппа, кроме Be и Mg) металлов, в результате образуются растворимые основные гидроксиды BaO + H2O = Ba(OH)2. Большинство кислотных оксидов реагируют с водой, в результате образуются растворимые кислотные гидроксиды (кислоты) SO3 + H2O = H2SO4. Некоторые кислотные оксиды, в том числе SiO2, с водой не реагируют. Амфотерные оксиды с водой не реагируют. Кислотно-основные взаимодействия Оксиды вступают в кислотно-основные взаимодействия, в результате которых образуются соли. Реагируют только вещества, одно из которых проявляет кислотные свойства, а другое ‑ основные MgO + SiO2 = MgSiO3, основной кислотный соль оксид оксид BaO + Al2O3 = Ba(AlO2)2, основной амфотерный соль оксид оксид BaO + 2HNO3 = Ba(NO3)2 + H2O, основной кислота соль оксид N2O5 + PbO = Pb(NO3)2, кислотный амфотерный соль оксид оксид P2O5 + 6NaOH = 2Na3PO4 + 3H2O, кислотный основание соль оксид ZnO + H2SO4 = ZnSO4 + H2O, амфотерный кислота соль оксид ZnO + 2NaOH = Na2ZnO2 + H2O. амфотерный основание соль оксид (щелочь) Амфотерные оксиды в реакциях с кислотами и кислотными оксидами проявляют основные свойства, в реакциях со щелочами и основными оксидами – кислотные свойства. Гидроксиды
Общая формула гидроксидов – Э(OH)n, где n равно степени окисления элементаи принимает значения 1÷6. При n 2 гидроксиды могут существовать в разных гидратных формах.
Каждому солеобразующему оксиду соответствует гидроксид, причем в паре оксид - соответствующий гидроксид одинаковы кислотно-основной характер соединений и их отношение к воде.  Na2O – основной оксид, реагирует с водой, Na2O – основной оксид, реагирует с водой,NaOH – основание, растворимое в воде.  SiO2 – кислотный оксид, нерастворимый в воде, SiO2 – кислотный оксид, нерастворимый в воде,H2SiO3 – кислота, в воде не растворяется.  SnO – амфотерный оксид, нерастворимый в воде, SnO – амфотерный оксид, нерастворимый в воде,Sn(OH)2 – амфотерный гидроксид, нерастворимый в воде. Основания. Основания– гидроксиды, которые в водных растворах диссоциируют (распадаются) с образованием гидроксид-ионов (OH). Основания образуют элементы, соответствующие оксиды которых имеют основной характер. Название оснований составляют из слова ‘‘гидроксид’’ и названия элемента с указанием степени окисления, если степень окисления переменна, например: Ca(OH)2 – гидроксид кальция, Fe(OH)3 – гидроксид железа (III). По растворимости в воде основания делят на две группы – растворимые (щелочи) и нерастворимые. Растворимые основания образуют щелочные и щелочноземельные металлы. Кислоты. Кислоты – соединения, которые в водных растворах диссоциируют с образованием ионов водорода (H+). В формулах кислот атомы водорода ставят на первое место: НnЭOm. Кислоты имеют традиционные названия, которые производят от русского названия центрального атома с прибавлением различных суффиксов и окончаний, которые определяются степенью окисления центрального атома: H2SO4 – серная кислота; H2SO3– сернистая кислота; HClO4 – хлорная кислота; HClO – хлорноватистая кислота. В класс гидроксидов не входят бескислородные кислоты (H2S, HF, HCl, HBr, HI), их называют соответственно сероводородной, фтороводородной, хлороводородной (соляной), бромоводородной, йодоводородной кислотами. Амфотерные гидроксиды. Амфотерные гидроксиды обладают свойствами оснований и кислот. Формулы и названия амфотерных гидроксидов принято составлять аналогично формулам оснований, однако для удобства им можно придать и форму кислот: Zn(OH)2 – гидроксид цинка (или H2ZnO2 – цинковая кислота). Амфотерные гидроксиды нерастворимы в воде. Химические свойства гидроксидов Гидроксиды вступают в кислотно-основные взаимодействия, в результате которых образуются соли: 2NaOH + CO2 = Na2CO3 + H2O, основание кислотный соль оксид Cu(OH)2 + H2SO4 = CuSO4 + 2H2O, основание кислота соль 2NaOH + PbO = Na2PbO2 + H2O, основание амфотерный соль оксид 2NaOH + Pb(OH)2 = Na2PbO2 + 2H2O, основание амфотерный соль гидроксид 2H3PO4 + 3Na2O = 2Na3PO4 + 3H2O, кислота основной соль оксид H2SO4 + SnO = SnSO4 + H2O, кислота амфотерный соль оксид H2SO4 + Sn(OH)2 = SnSO4 + 2H2O. кислота амфотерный соль гидроксид Амфотерные гидроксиды в реакциях с кислотами проявляют основные свойства: 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O, со щелочами (основаниями) – кислотные свойства: H3AlO3 + 3NaOH = Na3AlO3 + 3H2O, или H3AlO3 + NaOH = NaAlO2 + 2H2O. Основания и кислоты реагируют с солями, если в результате образуется осадок или слабый электролит. Слабые кислоты – H3PO4, H2CO3, H2SO3, H2SiO3 и другие. 2NaOH + NiSO4 = Ni(OH)2 + Na2SO4, основание соль 3H2SO4 + 2Na3PO4 = 2H3PO4 + 3Na2SO4 кислота соль Бескислородные кислоты вступают в те же реакции, что и ранее рассмотренные кислородсодержащие кислоты. Пример. Составьте формулы гидроксидов, соответствующих оксидам: а) FeO; б) N2O3; в) Cr2O3. Назовите соединения. Решение а) FeO – основной оксид, следовательно, соответствующий гидроксид – основание, в формуле основания число гидроксогрупп (OH) равно степени окисления атома металла; формула гидроксида железа (II) – Fe(OH)2. б) N2O3 – кислотный оксид, следовательно, соответствующий гидроксид – кислота. Формулу кислоты можно получить, исходя из представления кислоты как гидрата соответствующего оксида: N2O3.H2O = (H2N2O4) = 2HNO2 – азотистая кислота. в) Cr2O3 – амфотерный оксид, следовательно, соответствующий гидроксид амфотерен. Амфотерные гидроксиды записывают в форме оснований – Cr(OH)3 – гидроксид хрома (III). Соли Соли – вещества, которые состоят из основных и кислотных остатков. Так, соль CuSO4 состоит из основного остатка – катиона металла Cu2+ и кислотного остатка– SO42 . По традиционной номенклатуре названия солей кислородных кислот составляют следующим образом: к корню латинского названия центрального атома кислотного остатка добавляют окончание –ат (при высших степенях окисления центрального атома) или –ит (для более низкой степени окисления) и далее – остаток от основания в родительном падеже, например: Na3PO4 – фосфат натрия, BaSO4 – сульфат бария, BaSO3 – сульфит бария. Названия солей бескислородных кислот образуют, добавляя к корню латинского названия неметалла суффикс –ид и русское название металла (остатка от основания), например CaS – сульфид кальция.
Средние соли не содержатв своем составе способных замещаться на ионы металла ионов водорода и гидроксогрупп, например CuCl2, Na2CO3 и другие. Химические свойства солей Средние соли вступают в реакции обмена со щелочами, кислотами, солями. Примеры соответствующих реакций см. выше. Кислые соли содержатв составе кислотного остатка ион водорода, например NaHCO3, CaHPO4, NaH2PO4 и т.д. В названии кислой соли ион водорода обозначают приставкой гидро-, перед которой указывают число атомов водорода в молекуле соли, если оно больше единицы. Например, названия солей вышеприведенного состава соответственно – гидрокарбонат натрия, гидрофосфат кальция, дигидрофосфат натрия. Кислые соли получают взаимодействием основания имногоосновной кислоты при избытке кислоты: Ca(OH)2 + H3PO4 = CaHPO4 + 2H2O; взаимодействием средней соли многоосновной кислоты и соответствующей кислоты или более сильной кислоты, взятой в недостатке: CaCO3 + H2CO3 = Ca(HCO3)2, Na3PO4 + HCl = Na2HPO4 + NaCl. Основные соли содержатв составе остатка основания гидроксогруппу, например CuOHNO3, Fe(OH)2Cl. В названии основной соли гидроксогруппу обозначают приставкой гидроксо-, например, названия вышеприведённых солей соответственно: гидроксонитрат меди (II), дигидроксохлорид железа (III). Основные соли получают взаимодействием многокислотного (содержащего в своем составе более одной гидроксогруппы) основания и кислоты при избытке основания: Cu(OH)2 + HNO3 = CuOHNO3 + H2O; взаимодействием соли, образованной многокислотным основанием, и основания, взятого в недостатке: FeCl3 + NaOH = FeOHCl2 + NaCl, FeCl3 + 2NaOH = Fe(OH)2Cl + 2NaCl. Кислые и основные соли обладают всеми свойствами солей. Они могут взаимодействовать и с кислотами, и со щелочами. Na2HPO4 + NaOH = Na3PO4 + H2O, Na2HPO4 + 2HCl = H3PO4 + 2NaCl, FeOHCl2 + HCl = FeCl3 + H2O, FeOHCl2 + 2NaOH = Fe(OH)3 + 2NaCl. Пример 1. Составьте формулы всех солей, которые могут быть образованы основанием Mg(OH)2 и кислотой H2SO4. Решение Формулы солей составляем из возможных основных и кислотных остатков, соблюдая правило электронейтральности. Возможные основные остатки – Mg2+ и MgOH+, кислотные остатки – SO42- и HSO4. Заряды сложных основных и кислотных остатков равны сумме степеней окисления составляющих их атомов. Сочетанием основных и кислотных остатков составляем формулы возможных солей: MgSO4 – средняя соль – сульфат магния; Mg(HSO4)2 – кислая соль – гидросульфат магния; (MgOH)2SO4 – основная соль – гидроксосульфат магния. Пример 2. Напишите реакции образования солей при взаимодействии оксидов а) PbO и N2O5; б) PbO и Na2O. Решение В реакциях между оксидами образуются соли, основные остатки которых формируются из основных оксидов, кислотные остатки – из кислотных оксидов. а) В реакции с кислотным оксидом N2O5 амфотерный оксид PbO проявляет свойства основного оксида, следовательно, основной остаток образующейся соли – Pb2+ (заряд катиона свинца равен степени окисления свинца в оксиде), кислотный остаток – NO3 (кислотный остаток соответствующей данному кислотному оксиду азотной кислоты). Уравнение реакции PbO + N2O5 = Pb(NO3)2. б) В реакции с основным оксидом Na2O амфотерный оксид PbO проявляет свойства кислотного оксида, кислотный остаток образующейся соли (PbO22) находим из кислотной формы соответствующего амфотерного гидроксида Pb(OH)2 = H2PbO2. Уравнение реакции Na2O + PbO = Na2PbO2. (пример). Укажите класс следующих соединений: SnCl2, NiO, Pb(OH)2, H2SO3, NaH2PO4. Решение PbCl2 – средняя соль; NiO – основной оксид; Sn(OH)2 – амфотерный гидроксид; H2SO3 – кислота; КH2PO4 – кислая соль. Задание Укажите класс следующих соединений: Cu(NO3)2, MnO, H2S, (NiOH)2SO4, Fe(OH)3. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
