Строение атома. Классификация химических элементов на основе строения атома Атом сложная частица
 Скачать 108.03 Kb. Скачать 108.03 Kb.
|
|
Химия Лекция Тема: Строение атома. Классификация химических элементов на основе строения атома Атом – сложная частица. До конца XIX столетия атом считали элементарной (т.е. неделимой) частицей. Научные открытия на рубеже XIX — XX вв. показали, что атом имеет сложное строение. Атом – элементарная химически неделимая частица, состоящая из положительно заряженного ядра и, вращающихся вокруг него отрицательно заряженных электронов. Ядро (протоны и нейтроны) имеет сложное строение. В настоящее время ученые считают, что в ядре содержится около100 элементарных частиц. Радиус атомного ядра в сто тысяч раз меньше радиуса атома, но вся масса атома сосредоточена в ядре, так как электроны, вращающиеся вокруг него имеют ничтожно малую массу (1/1836 частей). Объём атомного ядра мал, но его плотность очень велика. Если заполнить 1 см3 ядрами атомов, то их масса составит около 116 млн т. Например, радиус атома водорода 0,046 нм, а радиус ядра атома водорода — 6,5 • 10"' нм. Протоны — это частицы с положительным зарядом +1 (в условных единицах) и относительной массой, равной 1. Протон обозначают латинской буквой р(или +1р). Нейтроны — это электронейтральные (незаряженные) частицы с относительной массой, также равной 1. Нейтрон обозначают латинской буквой п (или 0n). Следовательно, положительный заряд ядра равен числу протонов. Электроны (обозначают е- ) — это частицы с отрицательным зарядом -1 (в условных единицах) и относительной массой, равной массы протона. Экспериментально доказано, что положительный заряд ядра атома (число протонов в ядре) равен атомному (порядковому) номеру химического элемента в Периодической системе элементов. Найдите в Периодической системе химических элементов углерод. Каким символом его обозначают? Обратите внимание на то, что атомный (порядковый) номер углерода 6. Следовательно, в ядре атома углерода находятся 6 протонов (6 +1р)и заряд ядра равен +6. Атомный номер элемента, заряд ядра атома и число протонов в ядре обозначают буквой Z,а число нейтронов — буквой N. Суммарное число протонов Zи нейтронов N называют массовым числом атома и обозначают буквой А: A = Z + N Из этой формулы следует, что число нейтронов в ядре атома равно разности между массовым числом элемента А и его атомным номером Z: N =A— Z. Массовое число атома А приблизительно (округлённо) равно относительной атомной массе Аг. химического элемента. Разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разные массовые числа, называют изотопами (слово «изотоп» образовано от двух греческих слов: изос — один и топос — равный). Пример: атомы с массовым числом 35 (хлор-35) и атомы с массовым числом 37 (хлор-37), но с одним и тем же зарядом атомных ядер +17). Изотопы одного и того же элемента имеют одинаковое число протонов и электронов, но разное число нейтронов. Изотопы находят широкое применение в биологии, медицине, географии, технике и археологии. Например, в медицине кобальт-60 применяют для лечения рака, железо-59 — для измерения скорости тока крови и изучения заболеваний крови, иод-130 — для диагностики заболеваний щитовидной железы, барий-137 — для диагностики заболеваний пищеварительной системы. Найдите в Периодической системе химических элементов алюминий. Каким символом его обозначают? Обратите внимание на то, что атом алюминия имеет массовое число (округлённую относительную атомную массу) 27 и порядковый номер 13. Следовательно, ядро атома содержит 13 протонов (13 +1р)и 14 нейтронов (14 0п),(N=A-Z=27-13 =14). Химический элемент — это вид атомов с одинаковым зарядом ядра. Положительный заряд ядра является главной характеристикой атома. Он определяет строение атома, число электронов, движущихся вокруг ядра, и служит отличительным признаком различных видов атомов. Атомный номер элемента в Периодической системе указывает на: 1).заряд ядра, 2).число протонов в ядре, 3). число электронов, содержащихся в атоме, — в этом заключается физический смысл атомного (порядкового) номера элемента в Периодической системе химических элементов. Что показывает атомный номер химического элемента? Назовите частицы, которые входят в состав ядер атомов. Укажите, что между ними общего, бщего они чем различаются. Объясните, почему атом электронейтрален. Что такое изотопы? Что такое химический элемент? Вопросы: Максимальное число электронов, которые могут находиться на том или ином энергетическом уровне, определяется по формуле: N = 2n2 , где N — максимальное число электронов на уровне; n — номер энергетического уровня. Следовательно, на первом энергетическом уровне (n = 1) может находиться не более двух электронов (2 * I2 = 2); на втором (n= 2) — не более восьми (2 * 22 = 8); на третьем (n = 3) — не более восемнадцати {2 * З2 = 18) и т.д. Кроме того, установлено, что на внешнем энергетическом уровне может находиться не более восьми электронов. Если энергетический уровень содержит максимально возможное число электронов, то его называют завершённым. Энергетические уровни, не содержащие максимального числа электронов, называют незавершёнными. Теперь мы можем составить электронные схемы строения атомов, руководствуясь следующими правилами: Общее число электронов в атоме равно заряду ядра атома, т. е. атомному номеру элемента. Максимальное число электронов на каждом энергетическом уровне равно 2n2. На внешнем энергетическом уровне может находиться не более восьми электронов, а на первом — не более двух электронов. Схему расположения электронов по электронным слоям, или энергеетическим уровням, называют электронной схемой (электронной конфигурацией) атома. СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМОВ ЭЛЕМЕНТОВ ПЕРВОГО И ВТОРОГО ПЕРИОДОВ Атом водорода Ядро атома водорода Н имеет заряд +1, поэтому вокруг  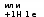 ядра движется только один электрон, находящийся на первом энергетическом уровне.  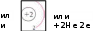 Атома гелия - первый электронный слой завершён.   Атом лития КЛАССИФИКАЦИЯ ЭЛЕМЕНТОВ НА ОСНОВЕ СТРОЕНИЯ ИХ АТОМОВ На основе теории строения атомов предложено несколько способов классификации элементов. Один из них — классификация элементов по числу электронов на внешнем энер гетическом уровне. По этому признаку различают три категории элементов. Металлы - элементы, атомы которых на внешнем энергетическом уровне имеют, как правило, 1, 2, 3 (иногда 4) электрона (исключение: водород, гелий, бор). Атомы металлов могут только отдавать электроны другим атомам. Чем легче атомы элемента отдают электроны с внешнего уровня, тем в большей степени выражены металлические свойства вещества. Неметаллы - элементы, атомы которых на внешнем энергетическом уровне имеют, как правило, 4, 5, 6, 7 электронов (к неметаллам относятся также водород и бор). Атомы неметаллов обладают способностью как присоединять, так и отдавать электроны. Чем легче атомы элемента принимают электроны, недостающие до завершения внешнего уровня, тем в большей степени выражены неметаллические свойства вещества. Благородные газы - атомы элементов, имеющие завершённый энергетический уровень. Их атомы в отличие от атомов других элементов не обладают способностью принимать электроны. Задание: Составьте схемы строения атомов элементов с атомными номерами: а) 4; 6)7; в) 10; г) 13; д) 15; е) 18. Определите по этим схемам, атомы каких элементов образуют металлы, неметаллы и благородные газы. На основе информации Периодической системы химических элементов Д. И. Менделеева запишите обозначения изотопов бора В, атомы которых содержат 5 и 6 нейтронов. Литий имеет два изотопа: 11|Li и 10Li. Содержание в природе первого изотопа составляет 92,7%, второго Не — 7,3%. Вычислите относительную атомную массу лития. Объясните, почему химический элемент аргон (атомная масса 39,948) расположен перед калием (атомная масса 39,102), кобальт (атомная масса 58,933) — перед никелем (атомная масса 58,70), теллур (атомная масса 127,60) — перед йодом (атомная масса 126,905).   Итак, в Атом  |
