М 3. Тема 1.Теория. Строение атома и П.С. Д.И.Менделеева.. Строение вещества
 Скачать 157.75 Kb. Скачать 157.75 Kb.
|
|
Орбитальное квантовое число (l) определяет форму атомной орбитали и принимает значения от 0 до (n-1), то есть n значений. Орбитальное квантовое число принято обозначать буквенными символами:
Электроны с одинаковым значением l образуют в атоме энергетический подуровень. Таблица 2.2 Обозначение орбитального квантового числа и подуровней
Каждому значению l соответствует орбиталь определенной формы. Решение уравнения Шредингера показало, что s-орбиталь (l= 0) имеет форму шара, p-орбиталь (l=1) форму гантели и т. д. (рис. 2.1). 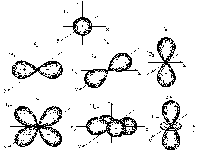  Рис. 2.1. Формы атомных орбиталей Для электронов первого энергетического уровня (n = 1) возможна только одна форма орбитали (s), для второго (n = 2) две (s и p) и т. д. Таким образом, энергетические уровни состоят из одного или нескольких энергетических подуровней. Для n = 1 возможен только один подуровень с l= 0, для n = 2 два с l= 0 и l=1 и т д. Состояние электрона в атоме обозначают цифрами и буквами. Например, электрон, у которого n = 1 и l= 0, обозначают 1s. Состояние 4p означает, что электрон находится на четвертом энергетическом уровне (n = 4); форма орбитали соответствует гантели (l= 1) и т.д. Магнитное квантовое число (m) характеризует пространственную ориентацию орбитали. Оно зависит от орбитального квантового числа и принимает значения от –l до нуля и от нуля до +l. Например, если орбитальное квантовое число равно 0 (s-орбиталь), то магнитное квантовое число имеет одно значение (0), если орбитальное квантовое число равно 1 (р-орбиталь), то магнитное квантовое число имеет три значения: –1, 0 и +1, а если орбитальное квантовое число равно 2 (d-орбиталь), то магнитное квантовое число имеет пять значений: –2, –1, 0, +1 и +2 и т.д. Таким образом, для каждого значения l имеется (2l+ 1) значений m. Все орбитали одного подуровня l обладают одинаковой энергией, но по-разному ориентированы относительно друг друга (рис 2.1). Такие состояния электронов в квантовой механике называются вырожденными: р-состояние трехкратно вырождено, d-состояние пятикратно и т.д. (табл. 2.3). Таблица 2.3 Подуровни и атомные орбитали
Изучение атомных спектров показало, что трех квантовых чисел недостаточно для описания свойств электронов. Дополнительное четвертое квантовое число спиновое (s) ("spin" вращение, веретено) характеризует собственный механический момент движения электрона, которое условно представляют как вращение вокруг собственной оси. Оно может происходить в двух взаимно противоположных направлениях. Поэтому спиновое квантовое число имеет только два значения: +1/2 и 1/2. Наличие спина у электрона было подтверждено экспериментально. Электроны с разными спинами обозначаются стрелками, направленными вверх 1.7.Заполнение атомных орбиталей электронами в многоэлектронном атоме Распределение электронов в многоэлектронных атомах по энергетическим уровням и подуровням подчиняется следующим законам: 1. Принцип наименьшей энергии. Электроны в атоме распределяются по орбиталям таким образом, что энергия атома оказывается наименьшей. Каждой атомной орбитали отвечает определенная энергия. Порядок следования АО по энергии определяется двумя правилами Клечковского: 1) энергия электрона в основном определяется значениями главного (n) и орбитального (l) квантовых чисел, поэтому сначала электронами заполняются те подуровни, для которых сумма (n + l) меньше. Например, можно было бы предположить, что 3d-подуровень по энергии ниже, чем 4s. Однако, согласно правилу Клечковского, энергия 4s-состояния меньше, чем 3d, так как для 4s сумма (n + l) = 4 + 0 = 4, а для 3d (n + l) = 3 + 2 = 5. 2) В случае, если сумма (n + l) для двух подуровней одинакова (например, для 3d- и 4p-подуровней эта сумма равна 5), сначала заполняется электронами уровень с меньшим n. Поэтому формирование энергетических уровней атомов элементов четвертого периода происходит в такой последовательности: 4s 3d 4p. Например: 21Sc 1s22s22p63s23p64s23d1, 31Ga 1s22s22p63s23p64s23d104p1 Таким образом, с учетом правил Клечковского энергия атомных орбиталей возрастает согласно ряду 1s < 2s < 2p < 3 < 3p < 4s ≤ 3d < 4p < 5s ≤ 4d < 5p < 6s ≤ 4f ≤ 5d < 6p < 7s ≤ 5f ≤ 6d < 7p Примечание. Знак ≤ означает, что энергии АО близки, так что здесь возможно нарушение правил Клечковского. Пользуясь этим рядом, можно определить электронное строение любого атома. Для этого нужно последовательно добавлять и размещать на подуровнях и атомных орбиталях электроны. При этом необходимо учитывать принцип Паули и два правила Хунда. 3. Принцип Паули определяет емкость АО: в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Иными словами, на одной АО, характеризуемой тремя квантовыми числами, может разместиться только два электрона с противоположными спинами, т.е. для одной АО можно записать два возможных варианта её заполнения: одним электроном ↑ и двумя электронами ↓↑ . При этом конкретное направление спина для одного электрона на орбитали не имеет значения, важно лишь, что спины для двух электронов на одной АО имеют противоположные знаки. Принцип Паули и взаимозависимость между значениями n, l, и m определяют максимально возможное количество электронов на орбитали, подуровне и уровне (табл. 2.4): на одной АО 2 электрона; на подуровне l 2(2l+1) электрона; на уровне n 2n2 электронов. Таблица 2.4 Распределение электронов по энергетическим уровням, подуровням и орбиталям
4. Два правила Хунда описывают порядок заполнения электронами АО одного подуровня: Первое правило: в данном подуровне электроны стремятся заполнять энергетические состояния (АО) таким образом, чтобы сумма их спинов по абсолютной величине была максимальна. При этом энергия системы минимальна. Например, рассмотрим электронную конфигурацию атома углерода. Атомный номер этого элемента равен 6. Это означает, что в атоме 6 электронов и они расположены на 2-х энергетических уровнях (атом углерода находится во втором периоде), т.е. 1s22s22p2. Графически 2р-подуровень можно изобразить тремя способами: 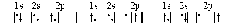 m 0 0 +1 0 1 0 0 +1 0 1 0 0 +1 0 1 а б в Сумма спинов в варианте а равна нулю. В вариантах б и в сумма спинов равна: ½ +½ = 1 (два спаренных электрона в сумме всегда дают ноль, поэтому учитываем неспаренные электроны). При выборе между вариантами б и в руководствуемся вторым правилом Хунда: минимальной энергией обладает состояние с максимальной (по абсолютной величине) суммой магнитных квантовых чисел. В соответствии с правилом Гунда, преимуществом обладает вариант б (сумма |1+ 0| равна 1) , так как в варианте в сумма |+1–1| равна 0. Определим, например, электронную формулу элемента ванадия (V). Так как его атомный номер Z = 23, то нужно разместить на подуровнях и уровнях (их четыре, так как ванадий находится в четвертом периоде) 23 электрона. Последовательно заполняем: 1s22s22p63s23p64s23d3 (подчеркнуты незаконченные уровни и подуровни). Размещение электронов на 3d –АО по правилу Гунда будет: m +2 +1 0 1 2 3d Для селена (Z = 34) полная электронная формула: 1s22s22p63s23p63d104s24p4, незаконченным является четвёртый уровень. Заполнение этого подуровня по правилу Гунда: 4p Особую роль в химии играют электроны последних незаполненных уровней и подуровней, которые называются валентными (в формулах V, Se – подчеркнуты). Например, у ванадия это электроны незаполненного четвертого уровня 4s2 и незаполненного подуровня 3d3, т.е. валентными будет 5 электронов 4s23d3; у селена 6 электронов 4s24p4. По названию последнего заполняемого подуровня элементы называются s-элементами, р-элементами, d-элементами и f-элементами. Найденные по описанным правилам формулы валентных электронов называются каноническими. В действительности реальные формулы, определяемые из эксперимента или квантовомеханическим расчетом, несколько отличаются от канонических, т.к. правила Клечковского, принцип Паули и правила Гунда иногда нарушаются. Причины этих нарушений рассмотрены ниже. Пример 1. Записать электронную формулу атома элемента с атомным номером 16. Валентные электроны изобразить графически и один из них охарактеризовать квантовыми числами. Решение. Атомный номер 16 имеет атом серы. Следовательно, заряд ядра равен 16, в целом атом серы содержит 16 электронов. Электронная формула атома серы записывается: 1s22s22p63s23p4 . (Подчеркнуты валентные электроны). Графическая формула валентных электронов:  Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами. Электронная формула дает значения главного квантового числа и орбитального квантового числа. Так, для отмеченного электрона состояние 3p означает, что n = 3 и l = 1(р). Графическая формула дает значение еще двух квантовых чисел магнитного и спинового. Для отмеченного электрона m = 1 и s = 1/2. Пример 2. Охарактеризовать валентные электроны атома скандия четырьмя квантовыми числами. Решение. Скандий находится в 4-м периоде, т.е. последний квантовый слой четвертый, в 3-й группе, т.е. три валентных электрона. Электронная формула валентных электронов: 4s23d1. Графическая формула: 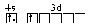  m 0 +2 +1 0 1 2 m 0 +2 +1 0 1 2№ электрона 1 2 3 Значения квантовых чисел валентных электронов Sc
2. Периодическая система и изменение свойств элементов. 2.1. Электронное строение атомов и периодическая система элементов Д.И. Менделеева Построение периодической системы и ее формы. Периодическая система элементов была установлена в 1869 г. Д.И. Менделеевым на основе химического опыта задолго до разработки электронной теории атома. Он установил закономерность, состоящую в том, что свойства элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от их атомных масс. В отличии от предшественников и современников (И. Деберейнер –1829 г., Дж. Ньюленус – 1865 г., Л. Мейер – 1869 г. и др.) Д.И. Менделеев руководствовался при построении Периодической системы не одним признаком (например, атомной массой), а их совокупностью: он изменил порядок ряда элементов, основываясь на их химических свойствах. Такой разносторонний подход позволил ему предсказать существование еще не открытых элементов, и эти предсказания очень скоро были подтверждены. Эта предсказательная сила Периодической системы и привела к всемирному признанию авторства Д.И. Менделеева. Современный периодический закон отличается от установленного Д.И. Менделеевым лишь тем, что свойства элементов и их соединений ставятся в зависимости от заряда ядра, а не от атомной массы. Периодическая система в современном понимании является отражением электронного строения атомов. В ней период соответствует постепенному заполнению электронами электронного уровня, характеризуемого главным квантовым числом n (равным номеру периода). Периоды состоят из семейств s-, р-, d-, f-элементов. Периоды располагают в параллельных строках так, чтобы элементы с одинаковым строением (одинаковые l и число электронов внешних подуровней nвэ) располагались друг под другом, образуя группы и подгруппы (одинаковые nвэ и l ). Таким образом, в периодах при увеличении номера элемента Z происходит заполнение электронами подоболочек (подуровней) s, p, d, f, а в подгруппах элементы имеют одинаковое электронное строение внешнего уровня и, следовательно, похожие физические и химические свойства. Периодичность изменения свойств состоит в их постепенном изменении в периодах и рядах, резком изменении при переходе к новому периоду и повторению в нем свойств элементов предшествующего периода. Форм периодической системы предложено очень много (порядка 500), однако основными являются две: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
