Шпаргалки по предмету Строение вещества. Шпоры на экз. Структурные изомеры
 Скачать 1.43 Mb. Скачать 1.43 Mb.
|
|
Базоцентрированная (БЦ) ячейка кроме частиц в узлах имеет частицы в центрах верхней и нижней граней. Если добавить частицы в центры остальных граней, получим гранецентрированную (ГЦ) элементарную ячейку с четырьмя частицами. Объемноцентрированная (ОЦ) ячейка отличается от примитивной тем, что содержит в центре еще одну частицу. Очевидно, что существует 14 различных решеток Браве (четвертый столбец таблицы). Можно строго доказать, что это действительно так. Реальные кристаллы. Типы дефектов в реальных кристаллах. Реальные кристаллы – это кристаллы, имеющие существенные нарушения или дефекты кристаллической решетки, которые образуются в результате изменения равновесных условий роста и захвата примесей при кристаллизации, а также под влиянием различного рода внешних воздействий. Дефекты кристаллического строения принято разделять по геометрическому признаку на точечные (нульмерные), линейные (одномерные), поверхностные (двумерные) и объемные (трехмерные). Точечные(нульмерные) дефекты малы во всех измерениях, их размеры по всем направлениям не превышают нескольких атомных диаметров. К таким несовершенствам относятся вакансии, межузельные атомы, примесные атомы внедрения и замещения, а также их комплексы. Линейные(одномерные) дефекты в двух измерениях имеют малые размеры, а в третьем – значительную величину, соизмеримую с длиной кристалла. К линейным дефектам относятся дислокации, цепочки вакансий и межузельных атомов. Поверхностные(двумерные) дефекты малы только в одном измерении; ими являются границы зерен, субзерен и двойников, границы доменов, поверхность раздела фаз и тому подобные двумерные объекты. Точечные, линейные и поверхностные дефекты считаются микроскопическими, т.к. (по крайней мере в одном направлении) их протяженность измеряется лишь несколькими атомными диаметрами. В противоположность этим дефектам объемные несовершенства обычно принято относить к типу макроскопических, поскольку имеют во всех трех измерениях сравнительно большие размеры, совершенно несопоставимые с величиной атомного диаметра. В определенных случаях эти дефекты можно наблюдать и невооруженным глазом. К объемным дефектам обычно относят поры, трещины, царапины. Вместе с тем такое толкование объемных дефектов следует рассматривать как достаточно условное. Как будет показано, объемные дефекты могут быть и микроскопических размеров. Поэтому более корректным является определение их как дефектов, имеющих соразмерные размеры во всех направлениях и представляющих собой трехмерные полости. Реальные кристаллы. Нульмерные дефекты. Реальные кристаллы – это кристаллы, имеющие существенные нарушения или дефекты кристаллической решетки, которые образуются в результате изменения равновесных условий роста и захвата примесей при кристаллизации, а также под влиянием различного рода внешних воздействий. Нульмерные (точечные) дефекты– это нарушения, локализованные в отдельных точках кристаллической решетки. Они могут быть структурными или примесными. Структурные точечные дефекты обусловлены тепловым движением атомов кристаллической решетки. Точечные(нульмерные) дефекты малы во всех измерениях, их размеры по всем направлениям не превышают нескольких атомных диаметров. К таким несовершенствам относятся вакансии, межузельные атомы, примесные атомы внедрения и замещения, а также их комплексы Реальные кристаллы. Одномерные дефекты. Реальные кристаллы – это кристаллы, имеющие существенные нарушения или дефекты кристаллической решетки, которые образуются в результате изменения равновесных условий роста и захвата примесей при кристаллизации, а также под влиянием различного рода внешних воздействий. Линейные(одномерные) дефекты в двух измерениях имеют малые размеры, а в третьем – значительную величину, соизмеримую с длиной кристалла. К линейным дефектам относятся дислокации, цепочки вакансий и межузельных атомов. Реальные кристаллы. Двумерные дефекты. Реальные кристаллы – это кристаллы, имеющие существенные нарушения или дефекты кристаллической решетки, которые образуются в результате изменения равновесных условий роста и захвата примесей при кристаллизации, а также под влиянием различного рода внешних воздействий. Поверхностные(двумерные) дефекты малы только в одном измерении; ими являются границы зерен, субзерен и двойников, границы доменов, поверхность раздела фаз и тому подобные двумерные объекты. Типы химических связей в кристаллах. Гомо- и гетеродесмические структуры. Типы химических связей: Металлическая связь – разновидность гомеополярной связи, реализующаяся в металлах. Пример: КЧ=8, 12 Cu 10, Li 39 ккал/моль(энергия связи) ;Электро- и теплопроводность Ионная связь или электровалентная связь обусловлена переносом валентных электронов с одного атома на другой с образованием положительных и отрицательных ионов. Пример: КЧ=6, 8 NaCl 180 ккал/моль ; обычно диэлектрик, плохая теплопроводность Ковалентная связь – гомеополярная связь, возникающая между двумя атомами одного сорта, при обобществлении принадлежащих им электронов Пример: КЧ (С)=4, алмаз 170 ккал/моль ;Диэлектрик, плохая теплопроводность Ван-дер-ваальсовы -Структуры с этим типом связи состоят из нейтральных изолированных или связанных в группы атомов - молекул. Пример: Cl2 0,5-3 ккал/моль ;Диэлектрик, пложая теплопроводность, нестабильны в твердом состоянии Водородная связь — это связь, которую атом водорода образует с двумя электроотрицательными атомами, такими как О, F, N, Сl. Пример: H2O 5-10 ккал/моль Гомо- и гетеродесмические структуры Гомодесмическими являются такие структуры, в которых химическая связь между структурными единицами одинаковая. Пр: NaCl, Cu, Mg, Fe Гетеродесмические структуры,в которых структурные единицы связаны химическими связями различного типа . Пр: кальцит , сухой лёд, графит. Физические свойства кристаллов. Наиболее общими макроскопическими свойствами кристаллов являются: 1) однородность, 2) анизотропия, 3) симметрия кристаллического пространства. Решетчатое строение кристаллов объясняет остальные характеристики кристаллического вещества: твердость, анизотропность, способность самоограняться, симметрию. Скалярными называются физические свойства, величина которых не зависит от направления, в котором они определяются. Векторными являются простейшие направленные величины, такие как сила и напряженность электрического поля и др. Векторные свойства возникают в кристалле как анизотропной среде при скалярном — изотропном — воздействии на него, т. е. воздействии, не зависящем от направления. Тензорные свойства — это следующие по сложности (после векторных) направленные физические величины, описываемые в некоторой системе координат. Если одна векторная величина b является функцией другой а, то в простейшем случае они связаны линейной зависимостью: b = T • а. Тензор второго ранга Тензоры более высоких рангов 1 удельная электропроводность, Пьезоэлектрический эффект (3-й ранг) 2 теплопроводность, Упругость (4-й ранг) 3 диэлектрическая проницаемость, 4 магнитная восприимчивость, 5 термоэлектричество Плотность Плотность вещества (ρ) — фундаментальное физическое свойство, определяемое как масса единичного объема вещества, выраженная в граммах на кубический сантиметр. Зависит 1 от типа кристаллической структуры вещества, 2 химического состава вещества, 3 коэффициента упаковки атомов, 4 валентностей атомов 5 радиусов атомов. 6 температура 7 давление Идеальные кристаллы. Координационное число и координационный многогранник. Идеальный кристалл – математической объект, имеющий полную, свойственную ему симметрию, идеализированно ровные гладкие грани. Координационное число-это число ближайших к данному атому (иону) со-седних атомов (ионов) в структуре кристалла независимо от того, являются они атомами того же сорта, что и центральный, или иного. Геометрия расположения лигандов вокруг центрального атома (иона) характеризуется координационным полиэдром (КП) (координационным многогранником — КМ), в вершинах которого располагаются лиганды. Описание структур кристаллов в терминах плотнейших шаровых упаковок. Плотнейие шаровые упаковки (ПШУ)- упаковки, плотно прилегающие друг к другу. • Гексагональная (двухслойная). • Кубическая (трехслойная): в металлах, бинарных соединениях. Плотнейшие шаровые упаковки (ПШУ) получаются при наложении гексаго-нальных слоев плотнейшим образом: шары верхнего слоя попадают в лунки между шарами нижнего слоя. На каждый шар любой плотнейшей упаковки приходятся две тетраэдрические и одна октаэдрическая пустота. Плотные шаровые кладки (ПШК) – упаковки менее плотные, чем плотнейшие шаровые упаковки. следующие варианты расположения шаров в трехмерном пространстве: 1) Простая кубическая кладка: тетрагональные слои накладываются плотным образом; 2) Простая гексагональная кладка: гексагональные слои накладываются плот-ным образом; 3) Плотнейшая шаровая упаковка разной слойности: гексагональные слои накладываются плотнейшим образом, при этом расстояние между шарами в слое и между слоями одинаковое; 4) Объемноцентрированная кубическая к  ладка: тетрагональные слои накла-дываются по принципу «шар в лунку», при этом расстояние между шарами в слое немного больше, чем расстояние между слоями (иными словами, шары в слое раздвигаются). ладка: тетрагональные слои накла-дываются по принципу «шар в лунку», при этом расстояние между шарами в слое немного больше, чем расстояние между слоями (иными словами, шары в слое раздвигаются).Структурный тип меди. 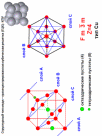 Структурный тип α-железа. 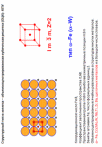 Структурный тип перовскита. Своё название структурный тип перовскита получил от минерала «перов-скит», имеющего формулу CaTiO3, представляющий собой кубическую плот-нейшую упаковку из ионов кислорода и катионов А и В (общая формула со-единения - АВО3), где катионы В заселяют октаэдры, образованные ионами кислорода. Она может быть представлена также как структура, в которой ок-таэдры ВО6 соединяются вершинами так, что в трёх взаимно перпендикуляр-ных направлениях образуются бесконечные прямолинейные цепочки -О-В-О-В-О-В-. Такой способ соединения правильных октаэдров приводит к кубиче-ской решётке с симметрией пространственной группы Рm3m, где катионы. А окружены двенадцатью анионами, расположенными в вершинах кубоокта-эдра. 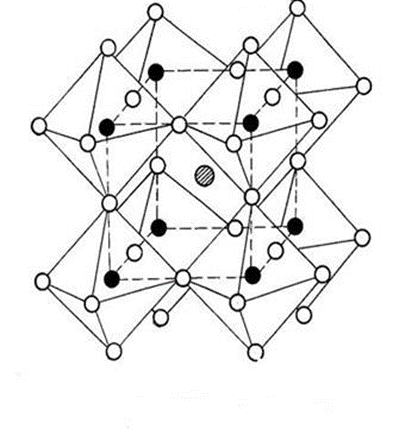 Структурный тип шпинели. К структурному типу шпинели относятся структуры некото-рых сульфидов состава RX2S4, где R2+ - Сo, Ni, Fe, Cu, а X3+ - Сo, Ni, Cr. Кристаллизуясь в кубической сингонии, образует в основ-ном октаэдрические кристаллы. В элементарной ячейке структуры шпинели - 32 аниона кислорода образуют плотнейшую кубическую упаковку с 64 тетра-эдрическими пустотами (катионами занято 8) и 32 октаэдрическими (катио-нами занято 16). Виды шпинели. По характеру распределения катионов в занятых тетраэдрических и октаэдри-ческих позициях структуры выделяют: нормальные (8 тетраэдров занято ка-тионами A2+, 16 октаэдров - катионами B3+), обращенные (8 тетраэдров занято B3+, 16 октаэдров- 8 B3+ и 8 A2+, причём катионы B3+ и A2+ в октаэдрических пустотах могут распределяться как статистически, так и упорядоченно) и промежуточные шпинели. Структурный тип алмаза. Кристаллы кубической сингонии (гранецентрированная решётка), пространственная группа Fd3m, параметры ячейки a = 0,357 нм, Z = 8. Атомы углерода в алмазе находятся в состоянии sp³-гибридизации. Каждый атом углерода в структуре алмаза расположен в центре тетраэдра, вершинами которого служат четыре ближайших атома. Именно прочная связь атомов углерода объясняет высокую твёрдость алмаза. 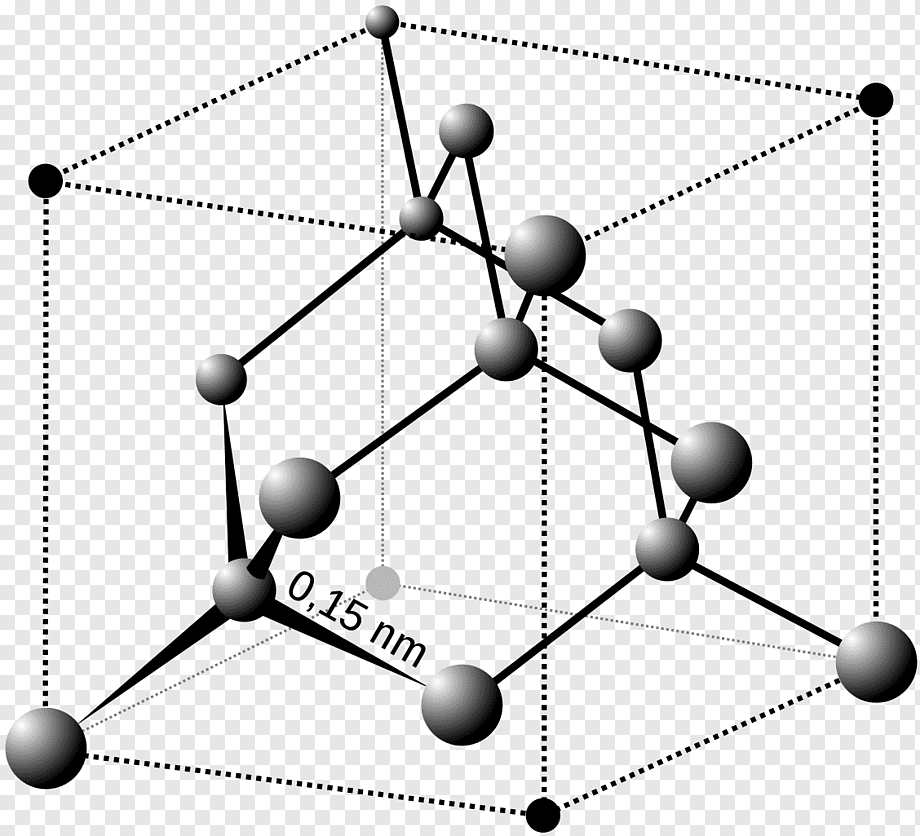 Структурный тип графита. Графит — гексагональная модификация углерода. Структура графита слоистая, причем каждый из чередующихся слоев (0001) построен по одному и тому же закону из гексагональных ячеек. Каждый слой смещен по отношению к двум соседним, точно повторяющим друг друга, на половину большой диагонали гексагона. Структура двухслойная с чередованием слоев, ….АВАВАВ… Каждый из слоев состоит из гексагональных ячеек. Под незаполненным слоем одного гексагона лежит вершина гексагона следующего слоя. Третий слой повторяет первый. В элементарной ячейке содержатся четыре атома. В структуре графита есть две правильные системы точек с кратностью 2. Пространственная группа структуры графита P63/mmc. 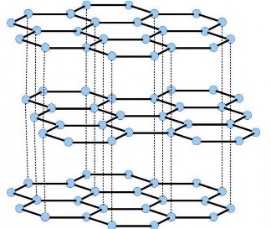 Строение поверхности кристаллов.  Методы выращивания кристаллов. Метод изменения температуры растворов. (перепад температур) В этих методах пересыщение раствора достигается двумя путями: либо снижением температуры во всем объеме на протяжении всего цикла выращивания, либо созданием в кристаллизаторе двух зон с различной температурой (в одной происходит растворение, в другой — рост кристаллов). Такие методы называются методами температурного перепада. В первом случае кристаллизация происходит в замкнутом сосуде. Перегретый (чтобы не было спонтанной кристаллизации) насыщенный раствор заливается в герметически закрывающийся кристаллизатор. В раствор подвешивается затравочный кристалл, а кристаллизатор помещается в термостат, температура которого снижается по заданной программе. При этом важно избежать перехода в лабильную область, чтобы не вызвать массового зарождения паразитических кристаллов. В простейшем варианте использования метода температурного перепада применяется высокий сосуд, в нижней части которого помещается исходное вещество в виде твердой фазы, а в другой — верхней — подвешивается затравка. Температура в нижней части сосуда поддерживается выше, чем в верхней. В результате благодаря конвекции раствора, обеспечивающей постоянный перенос вещества снизу вверх, в зону роста, на затравку отлагается растворенное вещество. 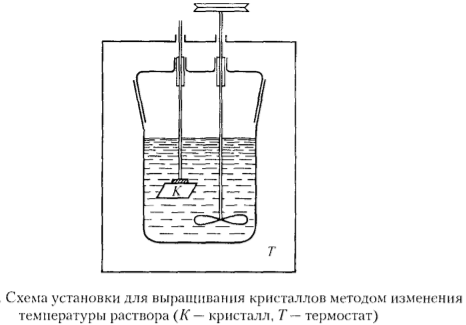 Методы выращивания кристаллов. Метод температурного перепада. (см. метод изменения температур) Методы выращивания кристаллов. Метод кристаллизации в гелях. Кристаллизация в гелях — одна из разновидностей метода кристаллизации путем химических реакций. Иллюстрацией этого метода является следующий опыт: в U-образную трубку заливается желатин, раствор агар-агара или гель кремнезема (жидкое стекло). Поверх геля в одно колено заливают раствор Л С, а в другое — раствор BD. Ионы А+ и С- и ионы В+ и D- диффундируют в геле навстречу друг другу и реагируют, образуя кристаллы малорастворимого вещества, например AD. Таким образом получают кристаллы карбонатов, вольфраматов, хлоридов, силикатов и т. п. Недостаток метода — низкая скорость роста кристаллов, так как длительность процесса составляет несколько месяцев. 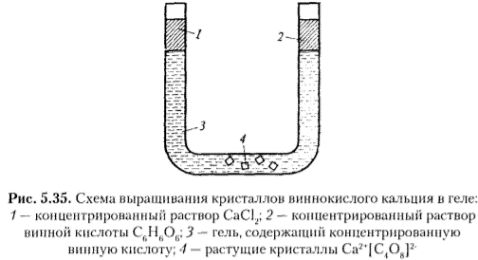 Методы выращивания кристаллов. Метод выращивания из гидротермальных растворов. Для большого числа веществ растворимость при Т < 100° С столь мала, что выращивание кристаллов в этих условиях становится невозможным. Один из путей увеличения растворимости состоит в повышении температуры раствора, что возможно при повышении давления пара (раствора). На этом основан гидротермальный метод. В нижнюю часть автоклава — сосуда высокого давления, заполненного определенным количеством растворителя, помещают шихту — исходный материал (например, обломки кристаллов природных минералов). Автоклав нагревают, при этом необходимое пересыщение создается понижением температуры в верхней зоне роста кристаллов (Т.,) относительно температуры (Г,) в нижней его части (зоне растворения) — Г, > Т. В нижней зоне автоклава шихта растворяется, и раствор поднимается в верхнюю, менее нагретую часть, становится там пересыщенным и отлагает на затравку избыток растворенного вещества. Охлаждаясь, раствор опускается вниз, вновь нагревается и растворяет новые порции шихты. Величина пересыщения задается разностью температур в зонах роста и растворения. Описываемый метод обеспечивает непрерывный перенос вещества до полного растворения шихты. Такой многократный процесс приводит к образованию весьма чистых и совершенных кристаллов. 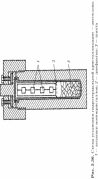 Методы выращивания кристаллов. Выращивание кристаллов из растворов в расплаве методом вытягивания.(Метод Чохральского) Метод, названный по имени создателя методом Чохральского, отличается от метода Киропулоса тем, что кристалл-затравка растет над зеркалом расплава при постоянной температуре (рис. 5.406). При медленном подъеме стержня — метод вытягивания — затравка вырастает в большой монокристалл с округленной внешней формой. Скорость, с которой растет кристалл из расплава, практически постоянна и лежит в интервале 1-80 мм/ч, что значительно превышает скорость роста из раствора. Таким способом можно получить кристаллы — були — длиной во много сантиметров и диаметром несколько сантиметров. |
