Название соединения
|
Структурная формула
|
Физические свойства
|
Химические свойства (перечислить с чем реагирует без уравнений)
|
Биологическая роль
|
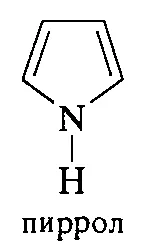
Пирол
|
|
бесцветная жидкость с запахом хлороформа, Ткип= 1300С, практические не растворим в воде, растворяется в спирте и ацетоне, на воздухе быстро окисляется и темнеет.
|
Взаимодействие с активными металлами , Реакции присоединения
Гидрирование
Полимеризация ,Реакции электрофильного замещения
Нитрование
Сульфирование Галогенирование
|
Пиррольные структуры содержатся в гемоглобине, хлорофилле, витамине В12 и некоторых других природных соединениях. В состав молекул этих сложных веществ входит тетрапиррольный фрагмент (порфин)
|
П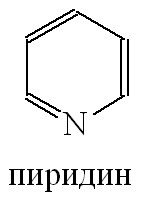 иридин иридин
|
|
Пиридин – бесцветная жидкость с характерным неприятным запахом, Ткип= 1150С. Хорошо растворяется в воде и органических жидкостях. Ядовит! Вдыхание его паров может привести к тяжелому поражению нервной системы.
|
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния
Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота
|
применяется для лечения пеллагры (кожное заболевание). Многие производные пиридина играют важную роль в природе и жизни человека: они являются витаминами, биологически активными веществами, лекарственными препаратами, красителями и т.п.
|
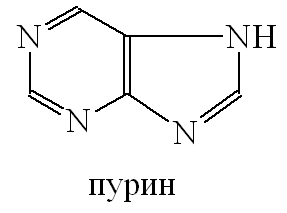
Пурин
|
|
Пурин - бесцветные кристаллы, с t пл. = 216-217°C, легко растворимы в воде, в теплом спирте, плохо - в ацетоне, хлороформе, диэтиловом эфире
|
хорошо растворимые в воде, горячем этаноле и бензоле, плохо растворимые в диэтиловом эфире, ацетоне и хлороформе.
|
Циклы замещенных производных пиррола входят в состав хлорофилла и гема. В молекуле хлорофилла четыре замещенных пиррольных кольца связаны с атомом магния, а в геме - с атомом железа
|
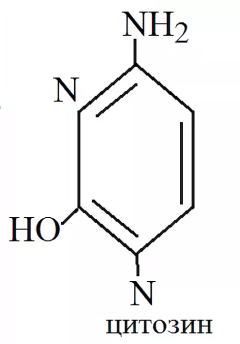
1) Цитозин
|
|
Бесцветные кристаллы. Раствор цитозина поглощает ультрафиолетовый свет: максимум абсорбции (λмакс) — 276 нм (pH 1-3), 267 нм (pH 7-10), 282 нм (pH 14).
|
реагирует с щелочами и кислотами, реагируя с азотистой кислотой дезаминируется, превращаясь в урацил.
|
|
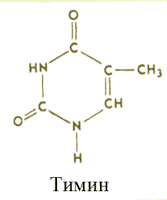
2) Тимин
|
|
Имеет молярную массу 126,12 g·mol−1, температура плавления от 316 до 317 ° C, температура кипения - 335 ° C (при кипении разлагается).
|
|
|
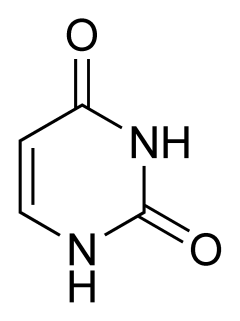
3) Урацил
|
|
Белая смесь или иглоподобные кристаллы, растворимые в горячей воде.
|
взаимодействия а) тимина с дезоксирибозой б) урацила с рибозой и ортофосфорной кислотой в) гуанина с рибозой.
|
уридиндифосфат - переносчик остатков сахара в реакциях взаимопревращения моносахаридов, уридиндифосфоглюкоза - кофермент фермента гликогенсинтетазы
|
П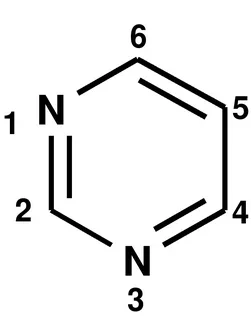 иримидин иримидин
|
|
бесцветные кристаллы с характерным запахом.
|
Нуклеофильное замещение протекает легко. Лучше реакция идет при наличии заместителя в пиримидиновом кольце
Электрофильное замещение в пиримидине происходит только при наличии сильного электронодонорного заместителя в кольце (ОН, NH2)
|
обусловлена их участием в построении нуклеиновых кислот, многих коферментов и нуклеотидов.
|
1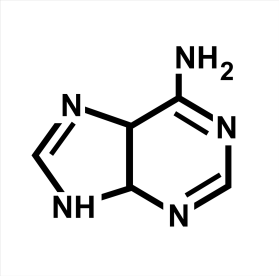 ) Аденин ) Аденин
|
|
При нормальных условиях аденин — бесцветные кристаллы. Плавится при температуре 360—365 °C.
Обладает характерным максимумом поглощения в ультрафиолетовой части спектра (λмакс) при 266 нм (при кислотности раствора pH=7)
|
Плохо растворим в воде, с понижением температуры воды растворимость аденина в ней падает. Плохо растворим в спирте, в хлороформе, эфире. Растрорим в кислотных щелочах
|
|
2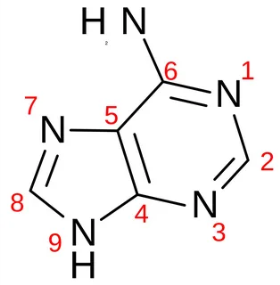 ) Гуанин ) Гуанин
|
|
Бесцветный, аморфный кристаллический порошок. Температура плавления 365 °C. Раствор гуанина в HCl флуоресцирует. В щелочных и кислых средах имеет по два максимума абсорбции (λмакс) в ультрафиолетовом спектре: при 275 и 248 нм (pH 2) и 246 и 273 нм (pH 11).
|
Хорошо растворим в кислотах и щелочах, плохо растворим в эфире, спирте, аммиачных и нейтральных растворах, нерастворим в воде.
|
Обладает серебристым цветом и присутствует в качестве пигмента в чешуе многих видов рыб, таких как: сельдь, лосось, и многих других. А также в стенках плавательных пузырей глубоководных видов рыб, где микроскопические чешуйки гуанина служат для снижения потерь газа в крови.
|
 Скачать 133.87 Kb.
Скачать 133.87 Kb.

 иридин
иридин



 иримидин
иримидин ) Аденин
) Аденин ) Гуанин
) Гуанин