Доклад колебательные реакции. ДОКЛАД К ЗАЩИТЕ. Тема моей курсовой работы Колебательные реакции
 Скачать 22.81 Kb. Скачать 22.81 Kb.
|
|
Здравствуйте Тема моей курсовой работы «Колебательные реакции». Открытие русским учебным Белоусовым колебательной реакции положило начало развитию целого класса реакций, названных в честь русских ученых Белоусова и Жаботинского, которые занимают достойное место в мировой науке, особенно в ее новой перспективной области – синергетике. Цель моей работы - изучение колебательных реакций на примере реакций Белоусова-Жаботинского и Бриггса-Раушера. Для достиженипя цели были поставлены следующие задачи: провести литературный обзор по объекту исследования, рассмотреть механизмы реакций Бриггса-Раушера и Белоусова-Жаботинского, выполнить эксперементальную работу и провести анализ полученных результатов. История открытия колебательных реакцийВпервые колебательную химическую реакцию, проявляющуюся в виде периодических вспышек свечения при окислении паров фосфора, наблюдал Роберт Бойль в конце XVII века. Также были открыты колебательные реакции на границе раздела двух фаз. Из них наиболее известны реакции на границе металл-раствор, получившие названия "железный нерв" и "ртутное сердце". Изучая цикл Кребса, Борис Павлович Белоусов ставил перед собой задачу открыть неорганический аналог, и в 1951 году Б. П. Белоусов открыл реакцию окисления лимонной кислоты броматом 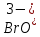 , катализируемой ионами церия. В 1961 году аспирант А. М. Жаботинский обратил внимание на ту же самую систему и начал в ней исследования , катализируемой ионами церия. В 1961 году аспирант А. М. Жаботинский обратил внимание на ту же самую систему и начал в ней исследования Реакция Белоусова — Жаботинского стала одной из самых известных в науке химических реакций и была занесена в Золотой фонд науки 20 века. Большой вклад в развитие колебательных реакций внес Альфред Лотка, который предложил математическую модель концентрационных колебаний в чисто гомогенных системах. На данный момент модель Лотки-Вольтерра является оснОвой большей части используемых математических моделей колебательных реакций. Процесс в данной модели протекает с участием двух промежуточных веществ – X и Y; концентрация Y увеличивается из-за явления автокатализа – ускорения протекания стадии продуктом этой же стадии, пока не исчерпается запас вещества Х, после происходит уменьшение концентрации Y из-за его превращения в конечный продукт реакции В и начинает работать стадия, в результате которой снова появляется вещество X. По мере роста его концентрации начинается ускорение второй стадии, снова включается автокатализ, концентрация Y начинает расти, концентрация Х – падать. Основные понятия и классификацияКолебательные реакции классифицируются следующим образом: 1) Каталитические - 2) Гомогенные 3) Реакции катализируемые ферментами 4) Реакции катализируемые ионами металлов 5) Гетерогенные, реакции на твердых катализаторах. 6) Автокаталитические Механизм реакции Бриггса-РаушераВ 1972 году Бриггс и Раушер (Briggs T.S., Rauscher W.C.) впервые сообщили о новом химическом осцилляторе, названном «иодными часами». Основные стадии автоколебательного режима реакции Бриггса-Раушера приведены на слайде: Один из основных компонентов «иодных часов» - перекись водорода (H2O2) из-за наличия неспаренного электрона на внешнем энергетическом уровне и наличию водородных связей. Разложение пероксида водорода, катализируемое йодатом, включает в себя два процесса: окисление йода до иодноватой кислоты пероксидом водорода восстановление йодноватой кислоты до йода пероксидом водорода Молекулярный Кислород участвует практически на всех стадиях реакции. Таким образом, молекулярный кислород присутствует в реакции в основном в соединении с водородом и играет одну из важных ролей в протекании реакции Бриггса-Раушера. Механизм реакции Белоусова-Жаботинского: Основные стадии автоколебательной реакции БЖ указаны на слайде. Рассмотрим колебания концентраций Ce3+ и Ce4+ в данной колебательной реакции БЖ. Постепенно увеличивается количество ионов Ce4+ в растворе, концентрация бромид ионов также невелика и растет. Как только будет достигнута некоторая критическая концентрация ионов Ce4+, концентрация бромид-ионов резко возрастет, что приведет к связыванию бромистой кислоты , которая необходима для каталитического окисления ионов Ce3+. Из этого следует, что прекратится накопление ионов Ce4+ в растворе ,что приведет к уменьшению концентраций. Высокая концентрация бромид-ионов вызовет увеличение скорости их расхода, в результате снижение концентрации бромид-ионов практически остановит реакции образования молекулярного брома и бромноватистой кислоты, приводя к накоплению бромистой кислоты, концентрация ионов Ce4+ повышается и цикл повторяется. Механизмы данных реакций можно наглядно продемонстрировать в следующих синтезах. Синтез №1. Реакция Бриггса-РаушераДля проведения реакции Бриггса-Раушера было приготовлено три раствора: сернокислый раствор йодата калия, крахмальный раствор малоновой кислоты с добавлением сульфата марганца 2 и раствор пероксида. В химический стакан был налит раствор №1. Затем при постоянном помешивании былот добавлено содержимое стаканов с растворами №2 и №3. Изменение цвета автоколебательной реакции Бриггса-Раушера происходит благодаря периодическому изменению концентрации иодид-крахмального комплекса, а характер протекания реакции зависит от соотношения химических потенциалов ионов в двух фазах. Синтез №2.Для проведения реакции Белоусова-Жаботинского необходимо приготовить 3 раствора: раствор бромат калия, раствор малоновой кислоты и бромида калия, раствор соли трехвалентного церия и раствор ферроина. Ставится химический стакан и поочередно добавляются первые два раствора. Через 60 секунд добавляется раствор С и наблюдается реакция. Для улучшения демонстрации реакции был добавлен раствор ферроина. Процессы, происходящие в стакане, постоянно конкурируют друг с другом. Наблюдается периодическое изменение концентраций молекулярного брома, бромат-ионов и бромид-ионов. При окислении ионов-церия наблюдается выделение углекислого газа. ЗаключениеВ ходе изучения данной темы мною были достигнуты все поставленные цели и задачи. Открытие знаменитой колебательной реакции Белоусова-Жаботинского привело к развитию нового класса соединений . Изучение реакции Белоусова-Жаботинского имеет огромное значение, ведь она нашла применение в различных областях науки и техники. Светочувствительная модификация реакции Белоусова-Жаботинского может служить прототипом вычислительного комплекса, который возможно, придет на смену электронно-вычислительной машины. СПАСИБО ЗА ВНИМАНИЕ |
